鸭致病性大肠埃希菌的分离鉴定与毒力基因检测及菌蜕制备
袁橙,郭长明,张步彩,左伟勇,唐晨晨,蔺辉星
(1.江苏农牧科技职业学院动物医学院,江苏 泰州 225300;2.南京农业大学动物医学院,江苏 南京 210095)
菌蜕是利用裂解基因制成的革兰阴性细菌的菌壳,可以刺激机体产生良好的体液、细胞和黏膜免疫,被认为是一类新型的候选疫苗[1–2]。研究[3–6]发现,菌蜕在不同种的血清型之间能诱导交叉免疫保护作用。同时,菌蜕具有免疫佐剂性质及递送系统功能,可以将其他抗原锚定于菌蜕表面,制备成重组疫苗,或将药物装载于菌蜕,用于疾病的靶向治疗;菌蜕疫苗和载体还具备制备工艺简单、保存与运输方便等优点;因此,菌蜕有较为广阔的应用前景。
禽致病性大肠埃希菌(avian pathogenicEscherichia coli,APEC)能够通过呼吸道感染宿主(鸡、火鸡等各种禽类),继而在宿主体内定殖,引发宿主一系列的临床症状,造成重大的经济损失[7–9]。APEC菌蜕与活疫苗相比,具有相同功能的膜抗原表面结构,可诱导动物机体产生体液免疫和细胞免疫应答;与传统变性灭活菌苗相比,菌蜕完好地保留了细菌菌体的各种抗原结构,又没有任何免疫原性的改变。有研究[10–11]显示,用 APEC强毒株或基因缺失株制备的菌蜕在动物免疫试验中表现出比传统甲醛灭活疫苗更高的保护效率,是一种较有潜力的候选疫苗。
目前,对牛、猪、鸡和鱼用革兰阴性菌菌蜕疫苗研制的报道较多[1–6,12],但对水禽致病性大肠埃希菌菌蜕疫苗制备的报道较少。本研究中,从具有禽大肠埃希菌病典型临床症状的鸭内脏器官中分离 1株鸭致病性大肠埃希菌,分析其血清型、系统进化分群及相关毒力基因,并将表达噬菌体裂解蛋白的溶菌质粒转化入该菌株,制备鸭致病性大肠埃希菌菌蜕,检测菌蜕的免疫原性,旨在为研制禽致病性大肠埃希菌菌蜕疫苗和可用于禽类细菌病、病毒病和寄生虫病的新型疫苗载体或佐剂提供依据。
1 材料与方法
1.1 供试鸭和菌株及主要试剂
试验动物樱桃谷鸭购自江苏省某种鸭公司。温控表达质粒 pBV221、DH5α菌株由江苏农牧科技职业学院动物流行病学研究中心保存。禽致病性大肠埃希菌菌株分离自江苏省某水禽场的病鸭。
药敏纸片和微量生化发酵管购自浙江省杭州滨和微生物试剂有限公司。大肠埃希菌单因子血清购自中国兽医药品监察所。麦康凯琼脂干粉、SOC培养基、琼脂粉、氯化钠、TBE电泳缓冲液、甘油等购自索莱宝生物科技有限公司。PCR试剂盒、Ultra GelRed Nucleic Acid Stain、DL2000 Plus DNA Marker等购自南京诺唯赞生物科技有限公司。Anti–Duck IgG(H+L)–Peroxidase 抗体购自 KPL 公司。可溶型单组分TMB底物溶液购自天根生化科技(北京)有限公司。限制性内切酶和连接酶为赛默飞世尔科技(中国)有限公司产品。质粒提取试剂盒为爱思进生物技术(杭州)有限公司产品。细菌培养用酵母提取物、胰蛋白胨和氨苄青霉素为 Sigma-Aldrich产品。
按常规方法[13]制备LB液体和固体培养基。抗性选择培养基中氨苄青霉素的质量浓度为 100 mg/L。
1.2 菌株的分离鉴定
无菌采集病死鸭的心血、肝脏等病料,在麦康凯琼脂培养基上划线接种,将琼脂平板倒置于37 ℃恒温培养箱内培养过夜,次日取出进行菌落形态观察。挑取麦康凯平板上的典型菌落进行革兰染色和镜检,并将镜检结果为革兰阴性的细菌转接于葡萄糖、麦芽糖、乳糖、蔗糖、甘露醇、吲哚、MR、枸橼酸盐、VP、硫化氢等细菌生化微量鉴定管及三糖铁琼脂培养基,进行生化鉴定。参考已报道的针对大肠埃希菌16s RNA基因保守区的引物,对所分离的临床菌株进行PCR检测[14–15],引物序列见表1。PCR 反应体系:2×PCR Master Mix 12.5 μL,上下游引物各20 pmol,模板DNA 2 μL,加双蒸水至总体积 25 μL。PCR 反应条件:95 ℃预变性 4 min;95 ℃变性30 s,不同基因的相应退火温度下(表1)反应30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min。

表1 大肠埃希菌检测所用引物Table 1 Primers for detection of Escherichia coli
1.3 O血清型鉴定
将经过生化鉴定的大肠埃希菌接种于2 mL LB液体培养基中,37 ℃过夜振荡培养,次日,将细菌培养物于121 ℃、103.4 kPa下处理2 h后,离心弃上清,用400 μL 0.5%的苯酚溶液重悬菌体,制成浓稠悬液,作为大肠埃希菌菌体抗原,备用。取7 μL菌体抗原和2 μL大肠埃希菌O抗原血清置于玻板上混匀,出现凝集即可初步定型,再通过试管凝集试验进一步确定血清型[16]。
1.4 分群分析和毒力基因检测
参照文献[17–21]中序列,合成chuA、yiaA和DNA 片段TspE4.C2的扩增引物(表1)。依据CLERMONT等[17]建立的将大肠埃希菌分为A、B1、B2和D群的分群方法进行分群分析。参照已发表的毒力基因引物序列[17–21]合成检测引物(表1),制备模板DNA,分装后置于–20 ℃保存。按1.2中的方法进行PCR检测。取PCR反应产物5 μL,用1.5%琼脂糖凝胶电泳检测结果。
1.5 分离菌株的耐药性检测
参照美国国家临床实验室标准委员会(NCCLS)方法手册(2007年版)规定的标准,检测菌株的耐药性,检测的抗生素包括氨苄青霉素、庆大霉素、卡那霉素和四环素。依据检测结果选择合适抗性的原核表达载体,构建溶菌质粒。
1.6 溶菌质粒的构建
根据NCBI公布的φX174噬菌体裂解蛋白E的基因序列合成E基因,并连接至pUC57载体,命名为pUC57–E。用限制性内切酶EcoRI和SalI双酶切重组质粒pUC57–E和表达载体pBV221,利用T4DNA连接酶将E基因片段连接至载体pBV221,再将连接产物转化至 DH5α感受态细胞,在氨苄抗性平板上筛选阳性克隆并扩大培养,从菌液中提取质粒进行双酶切鉴定和测序鉴定,将构建成功的溶菌质粒命名为pBV221–E。
1.7 菌蜕的制备
参照文献[8],制备鸭致病性大肠埃希菌电转化感受态细胞,将pBV221–E和pBV221分别转化至分离菌株。用氨苄抗性平板筛选阳性克隆,通过鉴定的阳性克隆分别命名为 pBV221–E/D 和pBV221/D,并进行溶菌动力学试验。将pBV221–E/D和pBV221/D菌液于28 ℃振荡培养至A600nm约为0.5时,取pBV221–E/D菌液样品作为诱导前对照,然后将菌液等分为2瓶,一瓶置于42℃诱导表达,另一瓶还置于28 ℃,继续振荡培养,每隔30 min取样测定A600nm值,至pBV221–E/D菌液的A600nm值不继续下降,此时结束培养,收获菌蜕溶液,并取出少量pBV221–E/D菌液作为诱导后样品。将诱导前的 pBV221–E/D菌液用 0.9%NaCl溶液进行 10–4、10–5、10–6稀释,升温诱导后的菌液用 0.9%NaCl溶液进行 10–1、10–2、10–3稀释,每个稀释度涂3块无抗LB平板,37 ℃恒温培养12 h,选取合适稀释度的平板进行计数,取cfu平均值计算裂解率[22]。
1.8 透射电镜检测
用负染色方法[22]对42 ℃诱导表达2.5 h的大肠埃希菌pBV221–E/D和pBV221/D菌液样品进行染色;用Philips透射电子显微镜(Tecnai 12)观察菌体结构。
1.9 菌蜕免疫原性检测
按上述制备方法,制备大量大肠埃希菌菌蜕,并测算裂解率。菌蜕溶液中加入β–丙内酯至终浓度为0.025%,再将菌液置于42 ℃作用1 h,离心收集菌体,菌体沉淀用灭菌 PBS(磷酸盐缓冲溶液)清洗3遍后重悬,加入β–丙内酯至终浓度为0.05%,再置于42 ℃作用2 h,制成菌蜕疫苗,并取少量悬浊液进行无菌检验和菌体计数。选取体质量接近的 7日龄櫻桃谷鸭40只,随机分成2组,每组20只。分别在颈部皮下接种菌蜕疫苗(1×109cfu/只)和等体积(200 μL)无菌 PBS;2周后以相同剂量再免疫 1次。分别于首免和二免后2周采集血液,分离血清。用鸭致病性大肠埃希菌分离株全菌抗原(1×109cfu/mL)包被酶标板,将血清样品稀释500倍后,用间接ELISA法[22]检测血清抗体(IgG)效价。
2 结果与分析
2.1 供试菌株的分离鉴定结果
根据病鸭临床症状、细菌形态学观察、生化鉴定和16s RNA扩增测序的结果,确定分离菌株为大肠埃希菌。通过玻板凝集试验和试管凝集试验鉴定,该菌株血清型为O24。
2.2 供试菌株的分群分析和毒力基因检测结果
从图1可知,chuA和yiaA的检测结果均为阴性,TspE4.C2为阳性,据此确定该菌株为B1型。从图2可知,fimC、csgA和iroN这3个基因的检测结果为阳性,kpsM、papC、felA、tsh、irp–2、iutA、cvaC和iss这8个基因的检测结果为阴性,说明该菌株具有fimC、csgA和iroN这3个毒力基因。

图1 鸭致病性大肠埃希菌的chuA、yjaA和TSPE4.C2基因扩增产物Fig.1 The amplification products of chuA, yjaA and TSPE4.C2 of pathogenic Escherichia coli from duck

图2 鸭致病性大肠埃希菌的毒力基因扩增产物Fig.2 The amplification products of virulence gene of pathogenic Escherichia coli from duck
2.3 供试菌株的耐药性检测结果
分离株对四环素不敏感,对氨苄青霉素、庆大霉素及卡那霉素敏感;因此,选择对氨苄青霉素有抗性的pBV221载体进行溶菌质粒的构建。
2.4 供试菌株溶菌质粒的鉴定结果
用EcoRI和SalI双酶切重组质粒pBV221–E可获得目的基因E和线性化pBV221,条带大小与预测一致(图3)。重组质粒测序结果显示E基因片段序列正确。
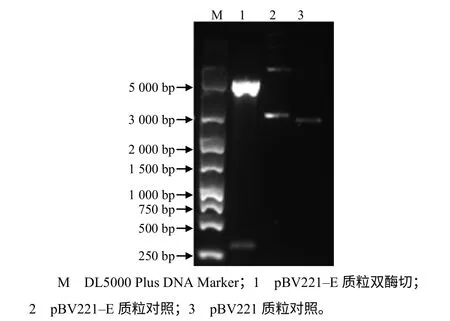
图3 pBV221–E质粒的EcoR I和Sal I双酶切鉴定结果Fig.3 The result of identification of recombinant plasmid pBV221-E digested by EcoR I and Sal I
2.5 供试菌蜕制备效率检测结果
如图4所示,在诱导30 min后pBV221–E/D菌液的A600nm开始下降,诱导120 min后A600nm值趋于稳定,约为 0.3;而诱导培养后的 pBV221/D和28 c培养的pBV221–E/D对照菌液的A600nm值一直保持上升趋势。pBV221–E/D裂解率为99.96%。

图4 鸭致病性大肠埃希菌诱导培养后的生长曲线Fig.4 Growth curve of pathogenic Escherichia coli from duck after inducing
2.6 供试菌的透射电镜检测结果
诱导培养2.5 h后的pBV221/D对照菌呈现完整的细菌结构(图5–a),电子密度较高且分布均匀;而诱导后的pBV221–E/D菌体电子密度降低且分布不均匀(图5–b),菌膜上有孔道形成,孔道宽度约为150 nm(图5–c箭头所指),细胞质通过孔道外泄,细胞膜有较为明显的皱缩变形;诱导前后菌体的鞭毛均清晰可见。

图5 鸭致病性大肠埃希菌的透射电镜检测结果Fig.5 The detection result of pathogenic Escherichia coli from duck by transmission electron micrographs
2.7 供试菌蜕的免疫原性
大量制备的大肠埃希菌菌蜕裂解率达99.99%;经β–丙内酯2次灭活处理后的菌蜕溶液涂布LB固体平板后未见菌落长出,说明菌蜕溶液中无活菌存在。如图6所示,菌蜕免疫组鸭的血清IgG水平在二免后上升,且显著高于PBS对照组的(P<0.05)。以 PBS对照组为阴性值(N),菌蜕免疫组为阳性值(P),求得一免后2周和二免后2周的P/N值分别为1.903(0.371/0.195)和 4.918(0.954/0.194),二免后 2周的P/N值大于2.1,判定为阳性血清。

图6 间接ELISA检测樱桃谷鸭的血清IgG水平Fig.6 The serum IgG levels of Cherry Valley duck detected by indirect ELISA
3 结论与讨论
胡林等[23]对华东部分地区 66株禽致病性大肠埃希菌系统进化分群的分析显示,A、B1、B2、D群菌株数分别占 33.4%、31.8%、13.6%、21.2%。张旭等[16]对 2015—2016年分离自江苏和山东部分地区的173株禽大肠埃希菌的血清型、致病性等流行病学特征进行调查,结果显示优势血清型有O78(21%)、O24(12%)和 O1(10%)。牛春玲[24]在华东地区分离的480株鸭源APEC菌株中,A、B2群分别占 56.25%、19.17%。董向磊[25]分离得到 240株APEC菌株,检测发现B2和D型占49.58%,认为在iutA、iss、tsh、iroN、irp–2、cvaC这6个基因中,如分离株的毒力基因数不小于 2个,即有89.74%的概率认定该分离株具有致病性。
本研究中,用于制备菌蜕的APEC菌株分离于江苏省某水禽场的病鸭;通过玻板凝集和试管凝集试验确定该菌株的血清型为 O24,是江苏地区APEC的优势血清型;对菌株进行分群分析和毒力基因检测后发现,该菌株属于B1群,并具有fimC、csgA和iroN这3个毒力基因,初步推测其具有致病性;在诱导30 min后pBV221–E/D菌液A600nm开始下降,诱导120 min后A600nm数值趋于稳定,说明重组菌株在诱导后30 min内E蛋白即开始表达,诱导120 min后细菌裂解完全。ZHU等[12]的研究显示,如菌液吸光度为0.6时开始诱导,诱导30 min后菌液吸光度下降至最低;如菌液吸光度为1.2时开始诱导,则需诱导120 min后菌液吸光度下降至最低。这些诱导时间上的差别可能是由于菌液起始浓度不同、菌株自身差异或E蛋白表达效率不同等原因引起的。本研究中,细菌裂解效率达99.9%以上,与文献[10–11]报道的结果一致;电镜观察结果显示,菌蜕上孔道的宽度约为150 nm,细菌内容物通过孔道溢出,菌体皱缩变形,电子密度降低,这与ZHU等[12]、TUNTUFYE等[26]和LANGEMANN等[27]的报道一致;细菌的鞭毛结构清晰完整,说明在菌蜕制备过程中菌体结构得到完整保存;在菌蜕疫苗制备中选择β–丙内酯作为灭活剂,与传统的甲醛灭活法[10–11,22]相比有可水解、无残留等优势;免疫原性检测结果显示,2次免疫后菌蜕可使雏鸭血清IgG水平显著提高,说明该菌蜕可以诱发机体产生体液免疫,与何亮[22]的研究结果一致。但对比发现,本试验中,一免后2周的血清IgG水平低于何亮的研究结果,可能是菌株来源不同造成了免疫原性的差异。
综上可知,通过将pBV221–E重组质粒转化至APEC分离株,调节细菌培养温度诱导E蛋白表达,成功获得鸭源APEC菌蜕,且该菌蜕可以诱发机体产生体液免疫。

