安化黑茶对载脂蛋白E敲除小鼠动脉粥样硬化的影响
张文将, 易 健, 贾 平, 陈博威, 韩鹏鹏, 徐 睿, 刘柏炎*
(1.湖南中医药大学 第一附属医院,湖南 长沙 410007;2.益阳医学高等专科学校,湖南 益阳 413000)
据中国心脑血管病报告统计显示,心脑血管疾病已经占据中国城乡居民死亡的首位,近年居高不下且呈现上升趋势[1]。动脉粥样硬化(atherosclerosis,AS)是导致各种心脑血管疾病形成的重要病理学基础[2],引起AS形成的具体机制目前尚不清楚,传统观念认为高脂血症、高血压和高血糖、抽烟及遗传因素的是诱发AS发生的危险因素,随着科学研究的逐步深入,越来越多的学者认为炎症与AS的发生密切相关[3-4],炎症反应几乎参与了AS发生发展的全过程[5],自从ROSS首先提出炎症学说以来,经过大量的临床和动物实验的验证,“炎症学说”目前已成为导致AS发生的主流学说之一。阿托伐他汀是临床上应用于治疗AS的常用药物,但是长期服用所带来的不良反应也限制了其的广泛应用。为此大量的科学家试图寻找一种能够降脂、抗炎、保护血管内皮细胞的药物或者药食同源的食物,以期从根本上抑制AS的发生发展。
中国茶文化源远流长,茶作为日常饮品,在人们的日常生活中具有举足轻重的作用。《本草拾遗》提出“茶为万病之药”的观点。绿茶富含茶多酚,茶多酚具有降脂、抗氧化、抗炎、改善血管内皮、增强一氧化氮产生的功能,从而起到较好的防治AS的作用[6-9]。但是绿茶性寒,并且富含鞣质、脾胃虚寒的患者、秋冬寒凉季节均不宜饮用。黑茶作为一种后发酵茶,不仅含有茶多酚,并且在长时间渥堆发酵的过程中有诸多微生物参与茶叶物质的转化,同时在这个发酵过程中也产生了茶色素等不同于其他茶叶的成分。茶色素具有较好的调节血脂代谢紊乱和显著的抗脂质过氧化、清除自由基及抗凝、促纤溶作用[10]。茯砖茶属于安化黑茶中的特色茶叶,在其发花过程所产生的优势真菌冠突散囊菌具备一定的自由基清除能力,同时其分泌的儿茶素衍生物等具备比茶多酚更强的抗氧化能力,是医学领域具有很大优势的微生物[11-13]。有研究发现冠突散囊菌液体发酵物的结构与降脂药物洛伐他汀相似[14]。课题组前期已有的实验证实安化黑茶中的茯砖茶对于高脂血症大鼠具有降脂、抗炎的作用,可降低大鼠主动脉肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素-6(interleukin-6,IL-6)的表达水平[15];抑制高脂血症大鼠主动脉核转录因子NF-κB(nuclear factor,NF-κB)蛋白质和基因的表达[16]。 茯砖茶中的成分具有抗炎、抗氧化、降脂和保护血管内皮细胞的作用,需要通过动物实验来进一步验证。
载脂蛋白E(APOE)参与血中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)的转运与清除,在脂蛋白的代谢中发挥着重要的作用[17]。载脂蛋白E基因敲除(APOE-/-)小鼠完全缺失APOE,导致血浆中的低密度脂蛋白胆固醇 (low density lipoprotein,LDL)、 (very low density lipoprotein,VLDL)、乳糜微粒等物质清除能力受损,引起血浆中的胆固醇水平的升高[18],为此APOE-/-小鼠是目前研究AS最为广泛的理想动物模型,作者采用APOE-/-小鼠复制AS模型,观察安化黑茶中的茯砖茶对于AS干预的效果,以期为深入研究安化黑茶抗AS的机制研究提供更多的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 8周龄APOE-/-雄性小鼠55只,体质量(25±5)g,SPF级,购自于南京大学生物模式中心,动物许可证号为SCXK(苏)2015-0001,品系名APOE Cas9-KO,品系编号T001458,配繁信息为-82bp/wt配B6J,遗传背景C57BL/6,基因型:(APOE)KO/KO;8 周龄 C57BL/6J野生型雄性小鼠10只,动物许可证号 SYXK(湘)2016-0002;本实验通过湖南中医药大学伦理委员会审查,动物伦理批准号为20171001,实验单位许可证编号SYXK(湘)2013-0005。
1.1.2 药物及试剂 天茯茶:湖南省白沙溪茶厂馈赠;阿托伐他汀(规格:10 mg,批号 110590):辉瑞制药有限公司产品。生理盐水、多聚甲醛(biosharp)、水合氯醛:天津市科密欧化学试剂有限公司产品;mouse氧化型低密度脂蛋白 (oxidized low-density lipoprotein,OX-LDL) ELISA Kit、mouse TNF-α ELISA Kit、mouse 白细胞介素-1β(interleukin1β,IL-1β) ELISA Kit、mouse 高敏感性 C-反应蛋白(high-sensitivity CRP,hs-CRP)ELISA Kit、mouse 单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)ELISA Kit试剂盒:武汉基因美生物科技有限公司产品;苏木素染色液:北京中杉金桥生物技术有限公司产品;伊红染色液:北京中杉金桥生物技术有限公司产品。
1.1.3 饲料配方 西方饮食饲料由北京华阜康生物科技股份有限公司提供,生产许可证号:SCXK(京)2014-0008,型号:H10141(脂肪 21%,0.15%胆固醇,具体配方:酪蛋白、蛋氨酸、玉米淀粉、麦芽糖糊精、纤维素、玉米油、无水奶油、矿物质混合物、碳酸钙、维生素混合物、胆固醇)。
1.1.4 主要仪器 体式显微镜、光学显微镜:日本奥林巴斯公司产品;超低温冰箱:海尔股份有限公司产品;全自动生化分析仪:贝克曼库尔特公司产品;高速冷冻离心机:德国Hermle公司产品;超纯水机:上海摩勒科学仪器有限公司产品;生物组织自动脱水机:亚光医用电子技术公司产品;石蜡包埋机:德国LEICA仪器公司产品;石蜡切片机:德国LEICA仪器公司产品;恒温干燥箱:福码实验设备有限公司产品;多功能酶标仪:perkinelmer公司产品;电热蒸汽灭菌器:美国ZEALWAY公司产品。
1.2 实验方法
1.2.1 药物制备 按照黑茶推荐成人饮用量干茶10 g/d的剂量来换算实验动物所需剂量 (以60 kg人的体质量和20 g小鼠体质量作为参考,查阅实验动物与人的体表面积比值表进行换算)。将白沙溪天茯茶用茶刀切取适量,带无菌手套将其掰成小块状称量,用无菌纱布包裹并放入烧杯中,将实验室所用III级水加入烧杯中浸泡30 min,随后将烧杯放石棉网上用实验电炉进行加热,武火煮沸之后改为文火煎煮30 min左右,将浓缩药液倒出,黑茶残渣加水继续煎熬,将两次药液浓缩所需体积,4 000r/min离心15 min后,取上清液无菌纱布过滤后冷却放入消毒磨口瓶,4℃冰箱保存备用。为防止药液变质,每次所浓缩的药量为1周左右。黑茶高剂量组用药2.16 g/kg、黑茶中剂量组用药1.44 g/kg、黑茶低剂量组用药0.72 g/kg。阿托伐他汀用量为10 mg/kg,每次将20 mg的药片放入研钵内用研杵碾碎,加入生理盐水溶解灌胃,现配现用。
1.2.2 小鼠饲养 实验小鼠饲养于湖南中医药大学SPF级实验动物中心独立通气笼盒(IVC)中,温度(24±0.5) ℃,相对湿度(50%~70%),压差 20 Pa,昼夜光照节律。空白对照组予以普通生长饲料(湖南斯莱克景达实验动物公司提供);模型组和药物组采用西方饮食辐照饲料,饲料低温保存;为保证小鼠进食的相对一致,每天定量予以饲料供应。饮水为III水,垫料更换次数为一周两次,在更换垫料的同时用84消毒浸泡笼具,自来水冲洗晾干备用,每日补充饲料及水。
1.2.3 动物分组、造模与给药 选取8周龄雄性APOE-/-小鼠55只,持续西方饮食喂养13周,同时选用8周龄的C57小鼠作为空白对照予以普通饲料喂养13周[19-21],13周后随机抽取5只行HE染色,确定造模成功后根据体质量分层,然后随机分为模型组、阿托伐他汀组和安化黑茶高、中、低剂量组。分组后的APOE-/-小鼠继续西方饮食喂养8周,同时每天上午9点左右予以相应的药物连续灌胃干预8周。阿托伐他汀组予以10 mg/(kg·d)药物灌胃给药、现配现用;黑茶高剂量组用药2.16 g/(kg·d)、黑茶中剂量组用药 1.44 g/(kg·d)、黑茶低剂量组用药 0.72 g/(kg·d);空白组和模型组予以等剂量的生理盐水灌胃。
1.2.4 标本收集与处理 各组小鼠于灌胃第8周末禁食不禁水12 h后,依次进行以下操作:(1)将小鼠麻醉后摘眼球取血,室温静止2小时后将血液置于无菌EP管中4℃12 000g离心15 min,分离血清,-80℃分装保存用于血脂和炎症指标的检测,血清避免反复冻融。(2)脱臼处死小鼠,将小鼠胸腹腔剪开,放到冰盒或者冰块上操作,迅速摘取小鼠肝脏进行称量,生理盐水清洗后滤纸拭干,切除小鼠同一部位肝脏组织放入多聚甲醛中以备苏木精-伊红染色;摘除脾脏,清除脂肪组织后称重;迅速抽取10 mL冰生理盐水配1 mL针头心尖部进行心脏灌注,完毕后将小鼠动脉组织转移到放有碎冰的培养皿中,体式显微镜工作台下操作,用眼科剪快速仔细的剔除动脉管壁上的脂肪组织,将心脏连同0.5~1.0 cm的主动脉弓部位眼科剪剪下后进行冲洗,转移到体积分数4%的多聚甲醛中,剩余动脉放入冻存管中液氮速冻,之后转移至-80℃冻存待测,最后分离腹部脂肪组织进行称质量。固定组织后在4℃冰箱内过夜,24小时后常规脱水、石蜡包埋并连续切片,切片厚度5 μm制作石蜡切片,HE常规染色后,于光学显微镜下观察主动脉病理形态的变化。
1.2.5 检测指标和方法
1)血脂四项检测 将100UL小鼠血清和双蒸水1∶1稀释混匀后送到益阳医专附属医院检验科,采用贝克曼库尔特AU680全自动生化分析仪进行检测。
2) 血清中 OX-LDL、MCP-1、TNF-α、hs-CRP、IL-1β水平的测定 采用酶联免疫分析法(ELISA)进行测定,测试样本前提前30 min打开酶标仪进行预热,用多功能酶标仪450nm光波下进行检测相关OD值,参照说明书中标准品的浓度绘制标准曲线,将OD值代入曲线方程中,计算出样品的浓度,对于所得浓度运用统计学软件进行数据分析。
1.2.6 统计学处理 将实验所得数据运用SPSS18.0统计学软件进行分析,采用单因素方差分析的统计学方法来比较多组间均数,针对组间两两比较齐者的数据进行LSD检测,P<0.05说明差异具有统计学意义。
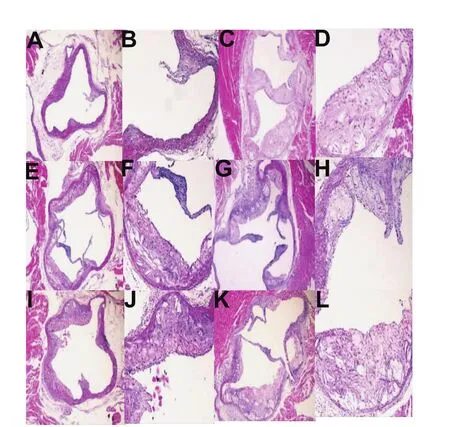
图1 小鼠主动脉瓣膜附近苏木精-伊红染色形态学图片Fig.1 Morphological pictures of hematoxylin-eosin staining near mouse aortic valve
2 结果与分析
2.1 HE染色结果
图1为HE染色结果。空白对照组(图A:40X;图B:100X):小鼠动脉管壁光滑完整,瓣膜及管壁附近无斑块附着,管腔中空,内、中、外膜结构完整,层次清晰;模型组(图 C:40X;图 D:100X):小鼠动脉管壁内膜及瓣膜明显增厚,管壁附着有大量的斑块,主要成分为大量的胆固醇结晶及泡沫细胞,中膜平滑肌受压变薄,管腔明显狭窄;阿托伐他汀组(图E:40X;图F:100X):小鼠动脉管壁附着有斑块,主要成分为胆固醇结晶及泡沫细胞,瓣膜无明显增厚现象,斑块附近的中膜平滑肌受压变薄,管腔狭窄程度小于模型组;黑茶高剂量组(图G:40X;图H:100X):小鼠动脉管壁有斑块附着,呈现偏心状分布,主要成分以泡沫细胞为主,瓣膜无明显增厚,管腔面积有所狭窄;黑茶中剂量组(图I:40X;图J:100X):动脉管壁周围的斑块呈现偏心状分布,管腔面积有所狭窄,斑块主要成分以泡沫细胞为主,瓣膜无明显增厚;黑茶低剂量组(图K:40X;图L:100X):动脉粥样斑块附着于主动脉管壁一侧,呈现偏心状分布,管腔面积减少,中膜平滑肌受压变薄,主要成分为大量的胆固醇结晶及泡沫细胞为主。
2.2 实验小鼠体质量、肝质量、腹部脂肪质量与肝指数的比较
表1显示:与模型组相比,空白组、黑茶高、中、低剂量组小鼠的体质量、肝质量、腹部脂肪质量、肝指数均降低(P<0.05)。
表1 小鼠体质量、肝质量、腹部脂肪质量、肝指数的比较(±SD,n=10)Table 1 The weights of body,liver,spleen,abdominal fat and the live index in mice
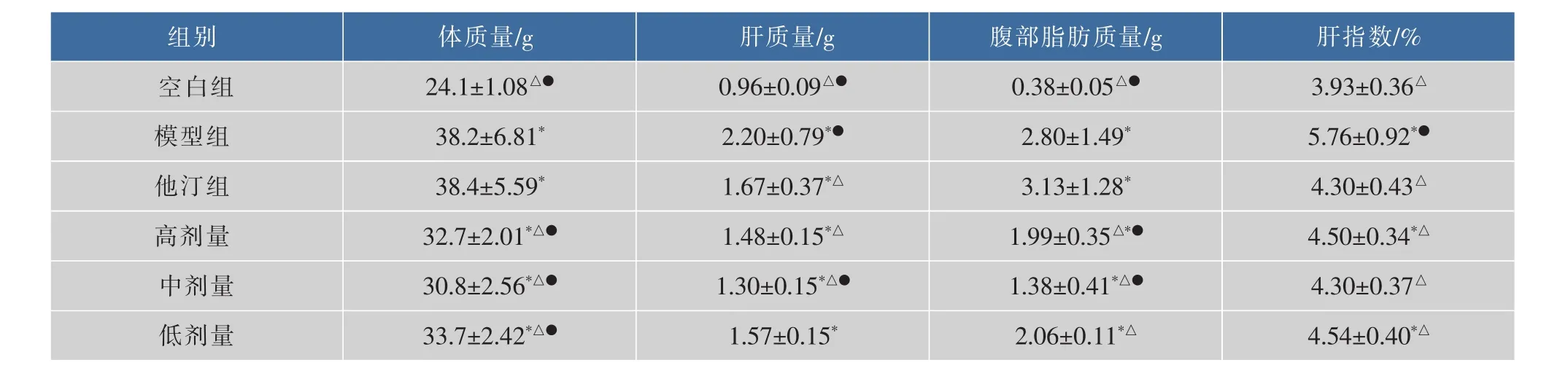
表1 小鼠体质量、肝质量、腹部脂肪质量、肝指数的比较(±SD,n=10)Table 1 The weights of body,liver,spleen,abdominal fat and the live index in mice
注:与空白组比较,*P<0.05;与模型组相比,△P<0.05;与阿托伐他汀相比,●P<0.05,下同
组别肝指数/%体质量/g 肝质量/g 腹部脂肪质量/g空白组0.9 6±0.0 9△●2 4.1±1.0 8△●0.3 8±0.0 5△●3.9 3±0.3 6△模型组2.8 0±1.4 9*3 8.2±6.8 1*2.2 0±0.7 9*●5.7 6±0.9 2*●他汀组3 8.4±5.5 9*1.6 7±0.3 7*△4.3 0±0.4 3△1.4 8±0.1 5*△3 2.7±2.0 1*△●1.9 9±0.3 5△*●4.5 0±0.3 4*△中剂量3 0.8±2.5 6*△●3.1 3±1.2 8*高剂量1.3 0±0.1 5*△●4.3 0±0.3 7△1.3 8±0.4 1*△●3 3.7±2.4 2*△●低剂量1.5 7±0.1 5*2.0 6±0.1 1*△4.5 4±0.4 0*△
2.3 实验小鼠血脂比较
表2显示:与空白组相比,模型组小鼠血清中TC、TG、 低密度脂蛋白胆固醇 (low density lipoprotein,LDL)、高密度脂蛋白胆固醇(high density lipoprotein,HDL)的浓度升高(P<0.05);与模型组相比,黑茶不同剂量组TG的浓度降低(P<0.05);与阿托伐他汀相比,黑茶高、中剂量组TG的浓度下降、HDL 的浓度升高(P<0.05)。
表2 小鼠血清中的 TC、TG、HDL、LDL 的比较(±SD,n=10)Table 2 The contents of TC,TG,HDL,LDL in the serum of mice

表2 小鼠血清中的 TC、TG、HDL、LDL 的比较(±SD,n=10)Table 2 The contents of TC,TG,HDL,LDL in the serum of mice
组别T C/(m m o l/L)T G/(m m o l/L)H D L/(m m o l/L)空白组2.7 3 ±0.2 6△●2.2 7±0.2 3△●0.9 7±0.3 3△●模型组5 0.5 ±4.7 5*●4.4 9±0.4 9*0.3 9±0.0 7△●1 2.1±0.5 9*●1 8.4±0.4 6*●他汀组3 5.8±5.1 4*△4.2 1±0.2 1*1 6.3±1.8 7*△1 0.0±1.0 3*△3.3 3±0.2 5*△●高剂量1 2.2±1.3 5*●4 9.5±1.4 4*●1 8.1±0.4 1*●低剂量中剂量3.1 7±0.2 6*△●1 2.3±1.2 8*●1 7.8±0.5 1*●3.9 5±0.2 7*△4 8.1±2.6 7*●4 9.6± 2.3 1*●1 1.3±1.3 7*●L D L/(m m o l/L)1 8.1±0.2 8*●
2.4 血清中 OX-LDL、MCP-1、TNF-α、hs-CRP、IL-1β的质量浓度
表3-7显示:与空白组相比,模型组小鼠血清中 OX-LDL、MCP-1、TNF-α、hs-CRP、IL-1β 质量浓度升高(P<0.05);与模型组相比,阿托伐他汀和黑茶不同剂量组小鼠血清中 OX-LDL、MCP-1、TNF-α、hs-CRP、IL-1β 的质量浓度下降(P<0.05)。
表3 小鼠血清中OX-LDL质量浓度的比较(±SD,n=10)Table 3 The content of OX-LDL in the serum of mice
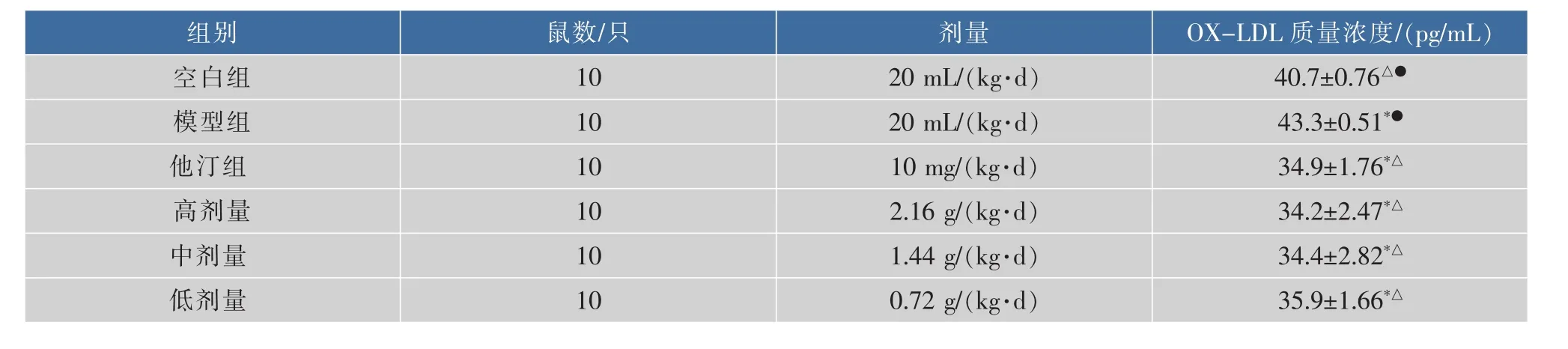
表3 小鼠血清中OX-LDL质量浓度的比较(±SD,n=10)Table 3 The content of OX-LDL in the serum of mice
组别O X-L D L 质量浓度/(p g/m L)剂量鼠数/只空白组4 0.7±0.7 6△●2 0 m L/(k g·d)模型组1 0 1 0 2 0 m L/(k g·d)4 3.3±0.5 1*●他汀组1 0 m g/(k g·d)1 0 3 4.9±1.7 6*△高剂量1 0 3 4.2±2.4 7*△中剂量2.1 6 g/(k g·d)3 4.4±2.8 2*△1 0 1 0 1.4 4 g/(k g·d)低剂量0.7 2 g/(k g·d)3 5.9±1.6 6*△
表4 小鼠血清中MCP-1质量浓度的比较(±SD,n=10)Table 4 The content of MCP-1 in the serum of mice
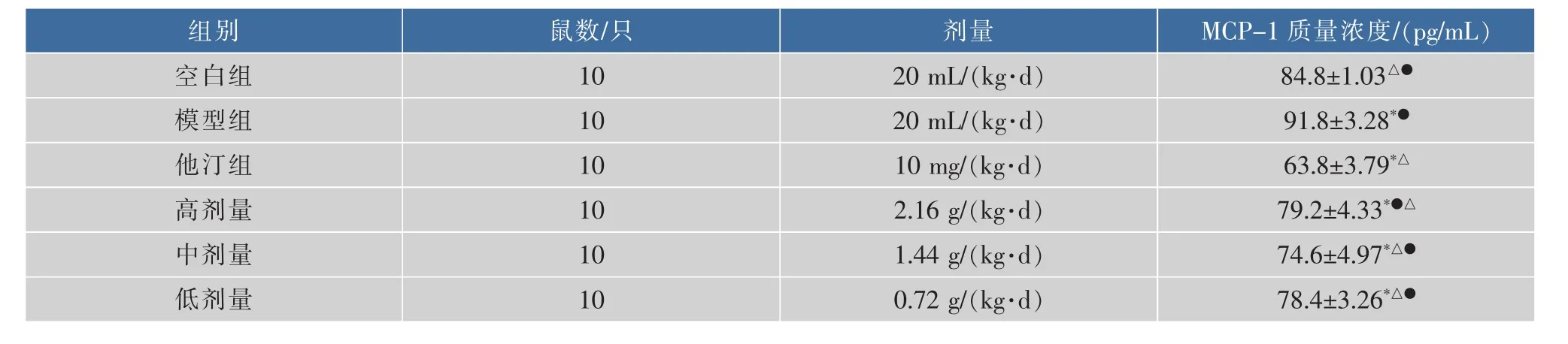
表4 小鼠血清中MCP-1质量浓度的比较(±SD,n=10)Table 4 The content of MCP-1 in the serum of mice
组别鼠数/只剂量M C P-1 质量浓度/(p g/m L)空白组1 0 8 4.8±1.0 3△●模型组1 0 2 0 m L/(k g·d)9 1.8±3.2 8*●他汀组1 0 6 3.8±3.7 9*△1 0 m g/(k g·d)高剂量1 0 2 0 m L/(k g·d)7 9.2±4.3 3*●△1 0中剂量1.4 4 g/(k g·d)7 4.6±4.9 7*△●2.1 6 g/(k g·d)低剂量1 0 0.7 2 g/(k g·d)7 8.4±3.2 6*△●
表5 小鼠血清中TNF-α质量浓度的比较(±SD,n=10)Table 5 The content of TNF-α in the serum of mice
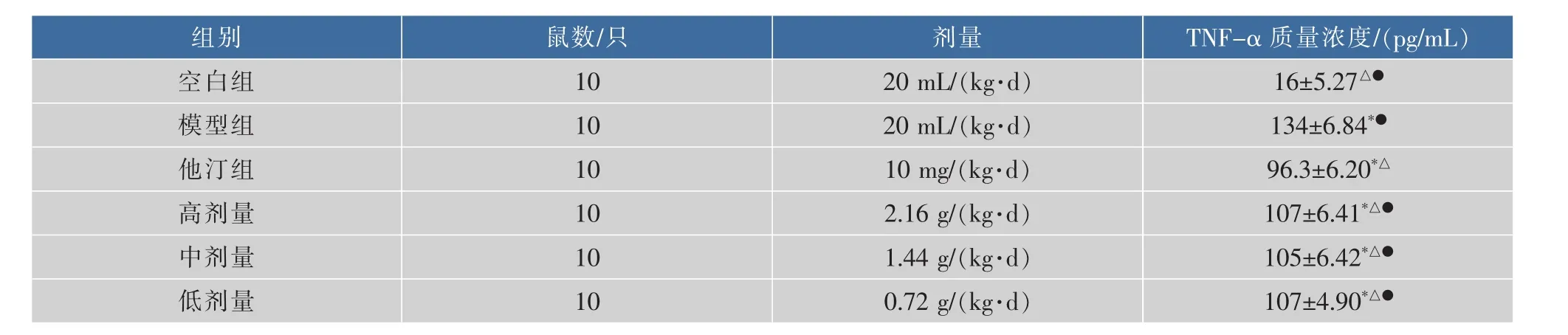
表5 小鼠血清中TNF-α质量浓度的比较(±SD,n=10)Table 5 The content of TNF-α in the serum of mice
组别T N F-α 质量浓度/(p g/m L)鼠数/只空白组1 0 1 6±5.2 7△●2 0 m L/(k g·d)模型组1 0剂量2 0 m L/(k g·d)1 3 4±6.8 4*●他汀组1 0 1 0 m g/(k g·d)9 6.3±6.2 0*△高剂量1 0 2.1 6 g/(k g·d)1 0 7±6.4 1*△●中剂量1 0 1.4 4 g/(k g·d)1 0 5±6.4 2*△●低剂量1 0 0.7 2 g/(k g·d)1 0 7±4.9 0*△●
表6 小鼠血清中hs-CRP质量浓度的比较(±SD,n=10)Table 6 The content of hs-CRP in the serum of mice

表6 小鼠血清中hs-CRP质量浓度的比较(±SD,n=10)Table 6 The content of hs-CRP in the serum of mice
组别h s-C R P 质量浓度/(p g/m L)鼠数/只剂量空白组1 0 2 0 m L/(k g·d)5 5 3±1 2.4△●模型组1 0 2 0 m L/(k g·d)6 2 4±2 8.7*●1 0他汀组1 0 m g/(k g·d)5 8 7±1 6.8*△高剂量2.1 6 g/(k g·d)1 0 5 0 9±3 3.2*●△中剂量1.4 4 g/(k g·d)1 0 5 3 5±2 5.4△●低剂量1 0 0.7 2 g/(k g·d)5 8 7±1 6.2*△
表7 小鼠血清中IL-1β质量浓度的比较(±SD,n=10)Table 7 The content of IL-1β in the serum of mice
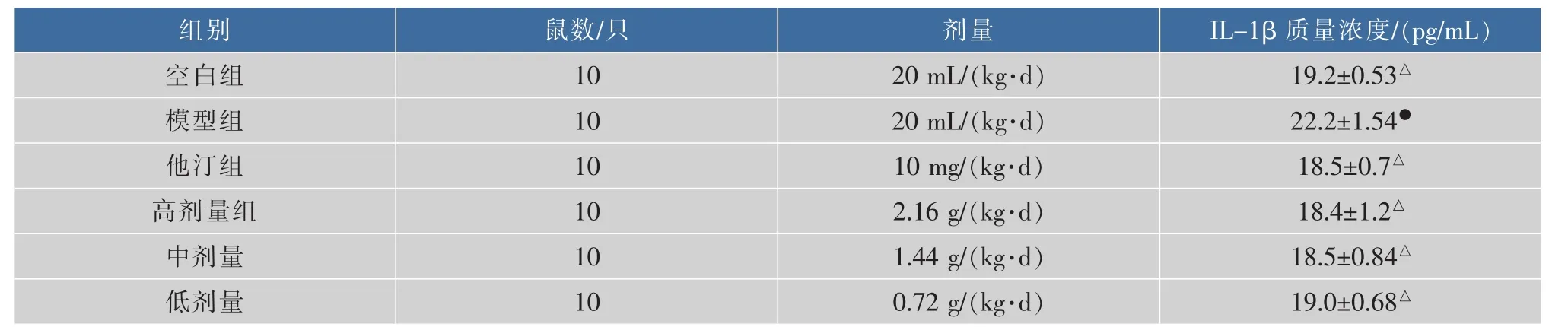
表7 小鼠血清中IL-1β质量浓度的比较(±SD,n=10)Table 7 The content of IL-1β in the serum of mice
组别鼠数/只空白组1 0 2 0 m L/(k g·d)1 0 1 9.2±0.5 3△模型组他汀组I L-1 β 质量浓度/(p g/m L)剂量2 0 m L/(k g·d)1 0 1 8.5±0.7△1 0 m g/(k g·d)高剂量组1 0 2.1 6 g/(k g·d)1 8.4±1.2△中剂量1 0 1 8.5±0.8 4△1.4 4 g/(k g·d)1 0低剂量0.7 2 g/(k g·d)2 2.2±1.5 4●1 9.0±0.6 8△
3 讨 论
病理学HE染色结果显示,除空白组之外,其他各组均有不同程度的AS,其中以模型组最为严重,模型组主要表现为动脉内膜及瓣膜明显增厚,斑块内胆固醇结晶丰富,血管管腔严重狭窄,提示模型制备成功。阿托伐他汀和黑茶不同剂量组小鼠动脉斑块明显低于模型组,说明阿托伐他汀和黑茶对AS的发生发展均有抑制作用。从镜下观的成分来看,模型组、阿托伐他汀组、黑茶低剂量组主要成分为胆固醇结晶和泡沫细胞为主,而黑茶高、中剂量组主要成分以泡沫细胞为主。AS按照病理学分为脂纹脂斑期(泡沫细胞为主)、纤维斑块期(纤维帽、脂类成分、泡沫细胞为主)、粥样斑块期(纤维帽、胆固醇结晶和泡沫细胞为主)以及继发性病变。那么可见模型组、阿托伐他汀组、黑茶低剂量组已经发展为AS的中晚期,而黑茶高、中剂量组小鼠为AS的早期,由此得知安化黑茶高、中剂量用药治疗可以延缓AS的发生发展。
过度肥胖引起脂肪组织中的巨噬细胞比例增多,而且炎症表型发生变化,浸润性增强,巨噬细胞与脂肪组织中的脂肪细胞交互作用,加速了AS的发展进程[22],为此抑制肥胖可以起到延缓AS发展的效果。实验结果显示安化黑茶不同剂量组小鼠肝脏重量和肝指数显著低于模型组及阿托伐他汀组,提示安化黑茶可以起到很好的抑制体质量增长和减少腹部脂肪组织合成的效果;还可以减少脂类物质在肝脏的沉积。这可能是安化黑茶延缓AS发展的原因之一。
高脂血症是引起AS发生的最主要的危险因素,从血脂四项检测结果来看,安化黑茶可以有效降低TG含量,但是对于TC、LDL、HDL方面并没有明显的改善,可见安化黑茶在降低TG方面有明显的优势,并且效果优于阿托伐他汀。过多的脂类物质在动脉管壁的长期沉积加速AS的发生发展,而黑茶不同剂量组均可以通过抑制TG的合成来延缓AS的发生发展,这可能是黑茶延缓AS发展的原因之一。而阿托伐他汀在降低TG含量上具有明显的优势。为此推荐高脂血症患者在日常生活中可以适当饮用黑茶来抑制甘油三酯的产生。而对于混合性高脂血症等症患者我们建议在服用他汀类药物降低胆固醇的同时,可以配合常规摄入黑茶的方式来降低体内的甘油三酯的含量,从而抑制脂类物质在动脉管壁的沉积来延缓AS的发生发展。
OX-LDL主要是由于体内的活性氧簇(reactive oxygen species,ROS)生成增多并且发生氧化修饰所产生的,OX-LDL具有细胞毒性,可以通过多种途径造成内皮细胞的损伤,并且对于血液中的单核细胞具有很强的趋化作用,从而促进泡沫细胞的形成和中膜平滑肌的迁移,是诊断AS的最佳指标[23-25],故降低血液循环中的OX-LDL水平是预防AS形成的重要途径。在内皮损伤的过程中,巨噬细胞释放出IL-1β、TNF-α、MCP-1等炎症因子, 炎症反应过程中促使肝细胞产生大量的hs-CRP急性时相反应物,为此,作者通过检测血清中OX-LDL、IL-β、TNF-α、MCP-1、hs-CRP 5个指标来进一步探索安化黑茶对于AS的干预机制。
“氧化应激学说”是比较公认的引起AS的学说之一,本次实验显示阿托伐他汀和黑茶不同剂量中OX-LDL含量明显低于模型组,说明阿托伐他汀和黑茶用药治疗均可以起到抗氧化的作用,从而减少了LDL的氧化修饰对于机体所造成的损伤。
AS属于慢性炎性疾病,炎症反应伴随着AS发生发展的始终,抗炎治疗被认为是治疗AS的有效措施。MCP-1作为作用很强的单核细胞趋化因子,具有调节单核细胞粘附和进入动脉管壁的双重功能,其在单核细胞进入动脉内膜的过程中发挥着重要的作用,在AS发生的后期,对于促进斑块的不稳定性也起着重要的作用[26]。阿托伐他汀和黑茶不同剂量组均可以有效抑制MCP-1的产生,从而起到了抑制泡沫细胞合成分泌的作用,延缓了AS的发生发展。
TNF-α是一种具有介导免疫反应和炎症反应的重要的前炎症因子,可以刺激白细胞介素-1(interleukin-1,IL-1),白细胞介素-6(interleukin-6,IL-6)和细胞粘附分子的表达,参与炎症反应的级联过程中,从而发挥促炎作用,其容易聚集到内皮细胞处造成内皮的损伤,为AS的形成创造条件[27-28]。从实验数据来看,阿托伐他汀和黑茶不同剂量组灌胃用药均可以通过抑制TNF-α的产生来达到抗炎的作用。
hs-CRP作为一种重要的炎性反应标志物,其水平的变化可直接反映AS斑块的炎性反应程度[29]。临床诸多实验验证C反应蛋白与AS的发生密切相关,是引发心血管疾病的独立危险因素[30]。有研究证实hs-CRP可以起到调节单核细胞的作用,可激活补体和刺激组织因子的产生,从而导致血管内膜的损伤,使得脂类物质易于在血管内皮聚集,为AS的产生创造了条件[31]。本实验可观察到安化黑茶高、中剂量用药可以有效的抑制hs-CRP的分泌,那么我们推测安化黑茶可以减少补体的产生,从而抑制炎症反应对血管内皮细胞的损害,防止脂类物质在内皮表面的附着。
IL-1β作为白介素中重要的基因编码,主要起着促炎作用,动物实验已经验证拮抗IL-1β信号通路可以起到很好的抑制AS发生的作用[32]。本实验结果显示阿托伐他汀和黑茶不同剂量组小鼠血清中IL-1β的含量有所下降,那么既然IL-1β作为重要的促炎因子,它的减少便可以有效的抑制TNF-α、hs-CRP等诸多因子的产生,可以说抑制IL-1β的产生对于抑制整个炎症反应其中至关重要的作用。由此可见黑茶和阿托伐他汀均可以通过拮抗IL-1β信号通路而起到抗炎的作用。
从以上数据分析,安化黑茶延缓AS的发生可能与以下因素有关:1)安化黑茶通过抑制脂类物质在肝脏和动脉管壁的沉积来延缓AS的发展;2)安化黑茶可以通过抑制 IL-1β、TNF-α、hs-CRP等重要的促炎因子从而达到抑制炎症反应的作用;3)安化黑茶可以通过抑制MCP-1和OX-LDL等重要的单核细胞趋化因子来防止过多的泡沫细胞在内皮细胞表面的沉积;4.安化黑茶具有抗氧化作用,可以减少LDL的氧化修饰,从而有效的抑制泡沫细胞的形成和减缓内皮细胞的损伤。
但是AS的发病机制尚不清楚,作者只是通过其降脂、抗炎、抗氧化、保护血管内皮细胞方面来分析其抗AS的可能机制。在后期的实验过程中,我们会从其他方面来进一步的验证,以期全方位、多角度的进一步分析其抗AS发生发展的机制。

