有机化学反应机理梳理及其教学新方法构建
吴红梅, 郭 宇, 张志华, 陈强强
(辽宁工业大学化学与环境工程学院,辽宁锦州121001)
0 引 言
有机化学课程是医药、应用化工、化工、林学、食品和环境等众多专业的学科技术基础必修课程,其重要性是不言而喻的。传统的教学主线为化合物的结构—命名—制备—物理性质—化学性质,学生孤立地接受着每个章节的知识,虽然教师也在尽力穿插着不同化合物的关联性,但是初学者却构建不起繁多反应之间的关系,对知识的理解和应用能力差,为了通过考试死记硬背的学生多,考完随着大脑的格式化就忘得一干二净,没有真正发挥到基础、支柱性课程的作用[1-4]。
当前,社会对人才的需求更加要求学生具备对知识的灵活应用能力,如制药和染料等行业的研发岗位,学生如果不明晰反应过程,何谈新产品、新工艺和新技术的升级、开发!在重新审视教学过程中发现了一个很关键的问题,授课过程中光顾面面俱到的讲授基本知识和原理是不够的,如何捋顺知识脉络、抓住有机化学的主线才是关键。有机反应机理(反应历程)是化学反应从原料到产物经历的实际过程,它是有机化学课程的主线和纲,若能紧紧抓住课程主线、围绕反应规律进行讲解,能显著提高教学效果和质量[5-8],学生便会熟练驾驭有机化学的知识,游刃有余地运用反应规律解释大量事实、分析和解决实际生产问题,同时也消除了学生在学习过程中存在的“学习兴趣差、理解少、记忆多、应用差”的问题。2015年诺贝尔医学生理奖获得者屠呦呦,获奖原因是发现了最有效的抗疟疾药物之一“青蒿素”,它可以从黄花蒿中提取,但是黄花蒿中“青蒿素”含量非常少,因此,人工化学合成是解决上述问题的主要途径。若能够掌握有机反应机理,指导性地进行有机合成便可以利用化学方法获得自然界中的化合物,这也是有机反应机理的重要性和魅力所在。然而“反应机理”是有机化学课程的重点和难点问题,学生难理解、抓不住实质性的问题,如何能够突破这一难题就显得尤为重要。本文通过教学实践总结出了学习“反应机理”的关键点和切入口,并按照以下顺序和框架教授有机化学反应机理:有机物结构(基础)→电子效应(切入点)→中间体稳定性(反应取向和规律),希望与同行共勉,便于学生理解与应用。
1 夯实基础,强化基础知识的学习和训练
反应机理贯穿于整个有机化学,既是重点又是难点,学生之所以难理解的原因之一为对基础知识理解深度不够,应用知识分析问题的能力差,因此在讲解反应机理前要注重以下知识的学习与运用。
(1)有机化合物的成键方式和结构。化合物结构决定性质、性质又反映结构,每种有机化合物之所以规律性地进行特定反应与化合物的结构密切相关,而结构中最基础的就是成键方式。因此,只有通过有效掌握有机化合物共价键(σ键和π键)的成键过程,才能深入了解化合物的结构,从而为学习和应用反应机理做铺垫。
以烯烃(乙烯,CH2=CH2)为例,碳原子的电子构型为1s22s22p2,按照杂化轨道理论,在形成烯烃过程中首先碳原子的2s轨道的一个电子被激发到2p轨道上,然后碳原子的1个2s轨道与2个2p轨道“杂化”组成3个能量等同的sp2杂化轨道,分别形成2个C—Hσ键和1个C—Cσ键,相互之间的键角接近120°形成平面型结构,其中没有参与杂化的p轨道对称轴垂直于该平面,彼此之间侧面交叠形成π键(见图1)。从成键方式很容易看出σ键和π键之间分布的电子云不同,σ键的电子云集中在2个碳原子核之间,不容易受到外界试剂进攻,π键电子云裸露在乙烯平面的上方和下方,电子云密度大、受原子核的束缚小、流动性强,因而具有供电性能,容易受缺电子试剂(亲电试剂)的进攻,发生经典化学反应为亲电加成反应。同理,其他化合物发生的化学反应也能从成键方式及结构推出,有利于学生建立化合物与各类反应的关系、理解有机化学反应规律。
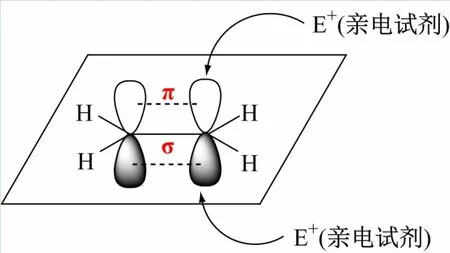
图1 乙烯分子的成键方式及结构
(2)有机化学中的取代基效应。初学者往往对取代基效应的基本意义含糊不清,导致在后续有机化学课程学习中不能够正确分析反应的过程和机理。因此,明晰取代基效应是学好有机化学的关键部分。取代基效应是不同取代基对有机反应的影响,主要包括电子效应和空间位阻(立体效应)效应[9],如图2所示。其中,电子效应是由于取代基供—吸(推—拉)电子性质,引起化合物某部分的电子云密度升高或下降,使化合物在反应的某个阶段带有负电荷或正电荷的效应。
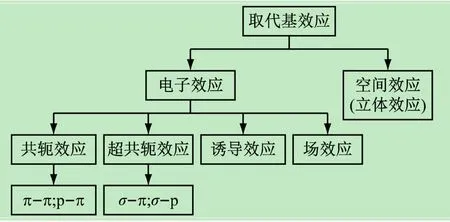
图2 有机化学反应中的取代基效应
电子效应是反应机理的核心问题,也是教学过程的关键点和切入点。因此,只有正确认识电子效应,才能真正开启反应机理的大门。电子效应根据其作用和传递方式不同,可分为诱导效应、共轭效应和场效应。事实上,学生要深入理解的实质性问题可归纳为:①诱导效应具有累加性,通过σ键传递,并且随着距离的增加而减弱,一般不超过3个碳原子。②场效应和诱导效应都是电子效应,但它不通过碳链(σ键)传递,二者传递方式不同。③“共轭”具有“平均分担”之意,因此共轭的分子比非共轭分子稳定;超共轭效应比共轭效应弱;共轭链中π电子转移时正负电荷交替出现。
只要学生透过概念充分理解每种电子效应实质,才能够应用电子效应处理如下问题:①判断有机分子整体或局部电子云分布;②判断反应物或中间体总体电子云密度减少或增多的情况;③判断有机反应中间体的稳定性;④判断有机物酸碱性强弱。学生根据上述原理,便能够判断化合物发生反应的类型、影响因素,甚至可以设计新的化合物和反应,对有机化学及其相关学科学习十分有益。
与电子效应截然不同的是空间位阻效应,它是由于分子中某些基团(或原子)占据一定的空间位置,影响反应产物的取向和反应活性的效应,是物理的相互作用。因此,当有机反应机理大门打开后,反应到达终极目标前还会受到电子效应、空间效应和溶剂效应的协同影响,学生需要根据具体情况做出有效判定。
2 以电子效应为切入点开启反应机理大门
要灵活掌握各类反应及其机理,关键要引导学生分析化合物的结构和电子云的分布情况,得出化合物是富电子体系还是缺电子体系,找出反应的“入口”,从而判断化合物能够发生的反应类型(亲电类反应、亲核类反应和自由基反应等)和反应规律。在有机化学反应中,由于反应物电子云分布不均匀使共价键发生异裂而发生离子型反应,以亲电或亲核机理进行。正是电子云分布不均匀的结果,给外界试剂提供了进攻的机会,决定着反应以何种机理进行。
以化合物乙烯、苯、卤代烃和醛(或酮)来说明反应机理的切入过程,如图3所示。
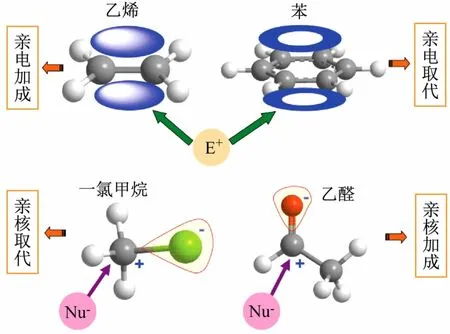
图3 以电子效应为切入点判断不同有机化合物反应机理的示意图
乙烯的π电子云处于所在平面的上方和下方,电子云分布均匀,是富电子体系,易受缺电子的亲电试剂(E+)进攻,导致π键断裂完成亲电加成反应。苯(芳烃)π电子云平均化,完全离域到整个环形轨道上构成闭合形状,处于苯环所在平面的上方和下方,是富电子体系,易受亲电试剂(E+)进攻,但由于π电子云的高度离域使6个C-C键键长完全相等,既不是一般的单键,也不是一般的双键,形成异常稳定的分子结构(具有芳香性),亲电试剂进攻后不容易破坏它的共轭大Π键,因此主要发生的是亲电取代反应。卤代烃(R—X),如一氯甲烷,由于碳原子的电负性比卤素小得多,因此C—X键是极性共价键,容易断裂;另外,由于卤素的电负性大,电子云偏向卤素(—X),使裸露的α—C带部分正电荷(缺电子),易受亲核试剂(Nu-)进攻,发生亲核取代反应(卤素被取代)。醛(或酮)的官能团碳-氧双键(—C=O),与烯烃碳-碳双键(—C=C—)的共性是都由一个σ键和一个π键组成,具有平面型结构,然而由于碳的电负性小于氧,因而电子云偏向氧原子,使羰基碳原子带部分正电荷(缺电子),易受亲核试剂(Nu-)进攻发生亲核加成反应。从以上几类典型化合物的分析,得出以化合物结构为基础,以电子效应为切入点便可预测反应的类型,为进一步优化反应奠定基础。
3 运用取代基效应分析反应中间体的稳定性,明析反应活性和反应规律
反应“入门”后,要经历“中转站”(中间体)而到达终点。化合物中间体是在反应过程中暂时生成且瞬间存在的物种,它较难分离、非常活泼。因此,在确定反应类型的基础上,明晰不同中间体的稳定性,才能确定反应的取向、活性和反应速率等规律,有效地调控反应[10-12]。根据共价键的断裂方式,可分碳正离子(R3C+)、碳负离子(ClCH-2)和自由基(R3C·)3 种中间体,不同反应经历的中间体也不同,如图4所示。
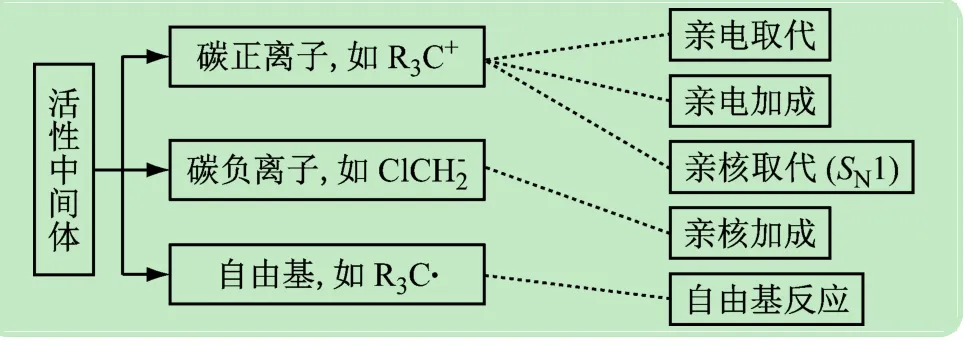
图4 反应中活性中间体的组成及其参与的反应类型
以烯烃亲电加成(中间体为碳正离子)为例,具体说明如何通过分析中间体的特性深入学习和理解有机反应的过程,如图5所示。
烯烃(A—CH=CH2)的反应活性取决于取代基A的特性。若A为供电子基团则增大了烯烃的电子云密度,使其进行亲电加成反应的活性增加,反之,若A为吸电子基团则降低了烯烃的电子云密度,进行亲电加成反应的活性降低。当烯烃(A—CH=CH2)被亲电试剂E+(如H+)进攻后,首先生成中间体碳正离子(A—C+H—CH3和A—CH2—C+H2),主产物的取向与碳正离子的稳定性有关。A的性质直接影响反应的过程。①当A为供电子基团时,与中间体正电中心直接相连的A基团和—CH3的供电子诱导作用分散了碳正离子的正电荷,因此A—C+H—CH3的稳定性高于A—CH2—C+H2,碳正离子越稳定、反应越容易进行,继而得到Markownikoff规则主产物。②当A为吸电子基团时,与正电中心直接相连,A基团的吸电子诱导作用会使碳正离子的正电荷更集中,稳定性下降,使A—C+H—CH3的稳定性低于A—CH2—C+H2,所以主产物是反Markownikoff规则产物。
除此之外,对于不对称烯烃(如3-甲基-1-戊烯)而言,在反应过程中通过氢或者甲基迁移等途径,重排为更稳定的碳正离子,得到重排产物(主产物),见图6。由此可见,中间体稳定性的导向作用决定着反应的方向、活性和速率等因素,学会综合运用这些效应分析化合物的结构、中间体和反应的影响因素,使学生能够游刃有余地解决各类有机反应问题。
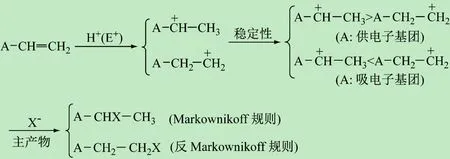
图5 烯烃A—CH=CH2亲电加成反应规律
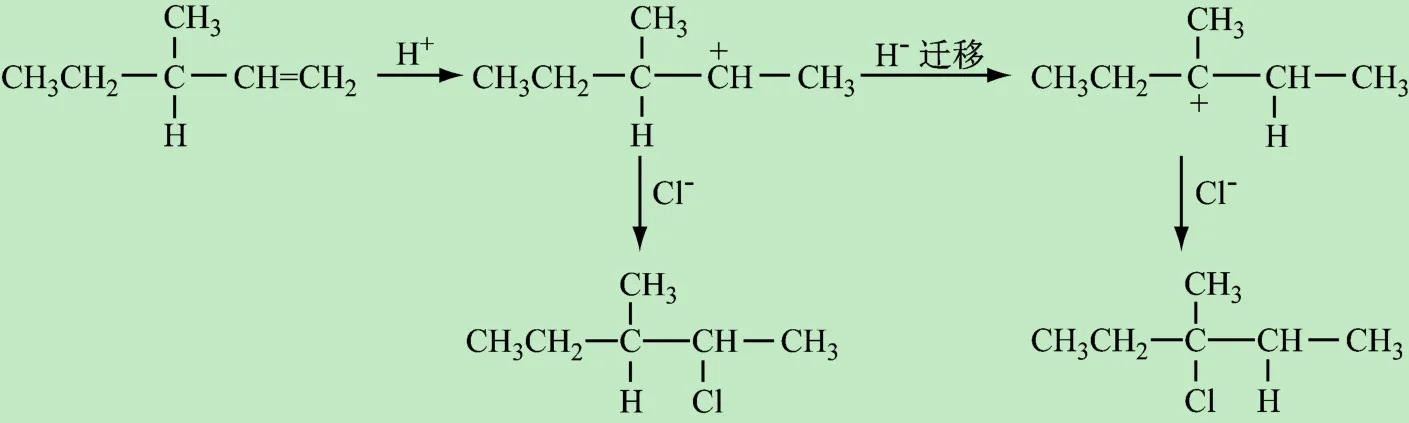
图6 3-甲基-1-戊烯亲电加成重排机理
4 思维导图构建有机化合物与反应机理的关联
通常,基础有机化学的教材主要是按照官能团来分章节编写的,如何将不同化合物与反应机理相关联是授课的难点和重点。为解决上述问题,笔者在授课过程中以课程主线—反应机理来授课,并利用思维导图来逐步构建不同化合物、不同类型有机化学反应的关联、整体把握知识脉络,这样可以极大地提高大脑的记忆、运行速率,提高对知识的储存、分析、管理和应用拓展能力[13-15]。
图7所示是根据不同的反应机理,构建的思维导图。以“反应机理”为核心问题(中心),不同类型的反应机理为主要节点展开,将有机化学教材中的反应过程囊括在三大分支(离子型反应、自由基反应、协同反应)上。根据该思维导图,学习反应机理与不同化合物的关联性可分为3个阶段。
(1)由中心“反应机理”发散出来的3个节点是并列关系。如,经过活性中间体碳正离子或碳负离子进行的离子型反应、经过自由基中间体的自由基反应、无中间体一步完成的协同反应。
(2)大方向确定后,根据反应条件及反应过程中化学键的断裂和形成方式发散出更为细化的机理类型。离子型反应进一步引申出亲电加成、亲电取代、亲核加成、亲核取代、消除反应;自由基反应(光照或过氧化物催化)引申出自由基加成反应和自由基取代反应。
(3)将具体的化学反应对号入座,以化合物结构为基础、电子效应为切入口、经中间体的导向作用建立反应与机理间清晰的关联网络。如烯烃、二烯烃和炔烃都是富电子体系(π电子云),易受亲电试剂进攻,π键断裂形成碳正离子中间体,再加成得到饱和σ键,最终完成亲电加成反应。这里需要注意的是炔烃虽然电子云密度比烯烃高,但亲电加成反应的活性低于烯烃,并且在催化剂(如HgSO4等)存在下也易于进行亲核加成反应。这是因为炔烃sp杂化轨道的电负性大于烯烃双键sp2杂化,易受到亲核试剂进攻,催化剂先与炔烃形成π络合物,使π电子向金属的空轨道转移,在一定程度上降低炔烃的电子云密度,从而有利于亲核试剂进攻,进行亲核加成反应。
该思维导图对有机化学琐碎的反应信息进行了分类整理,每个分支都是按照逻辑层次展开,归类分明、层次细化,以反应机理为主线向学生展示了整个教材的框架,使学生能够在短时间内总揽知识、把握脉络,有利于发散思维的形成,提高学生的学习兴趣和学习效率。
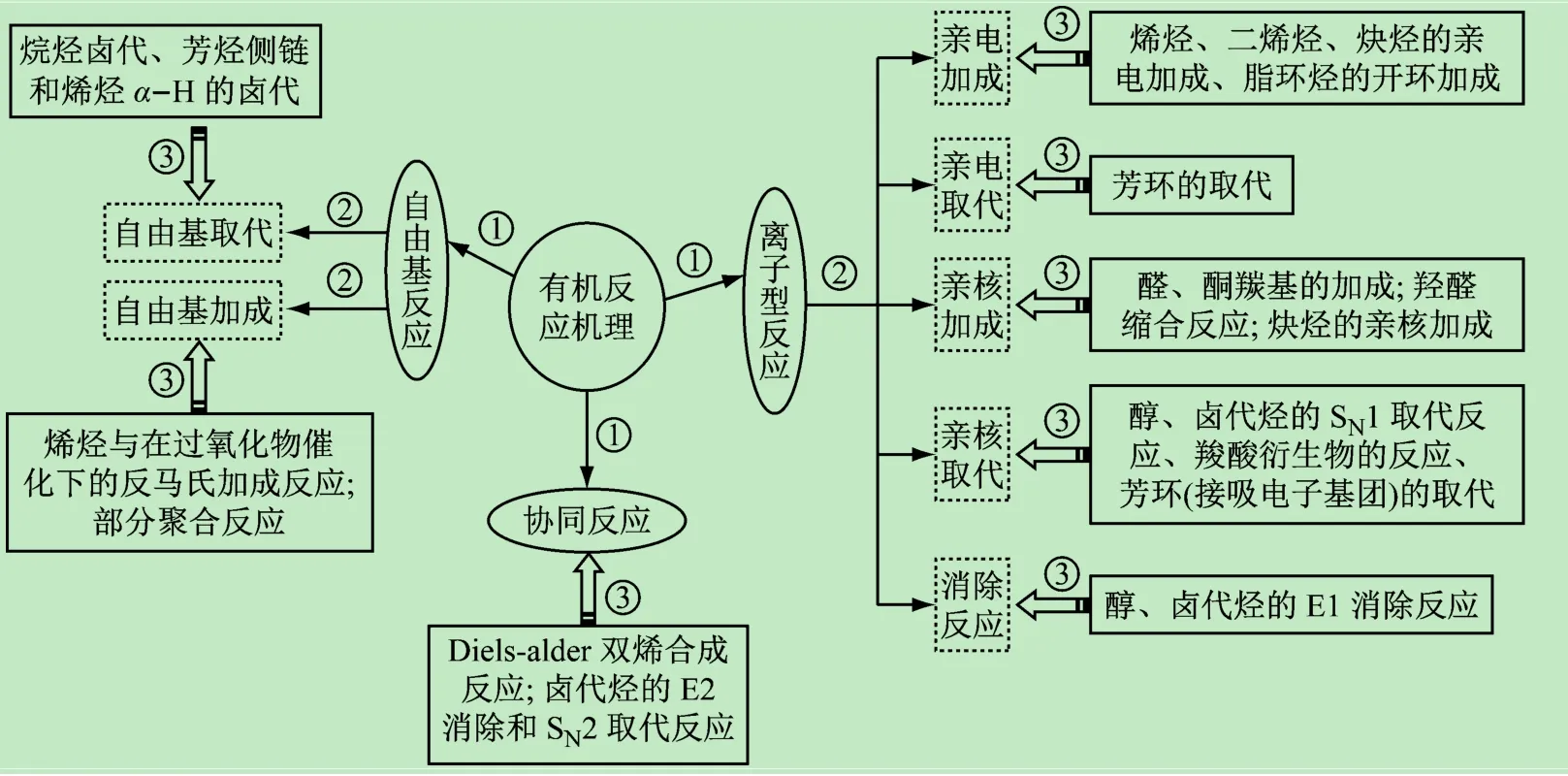
图7 有机化合物反应机理思维导图
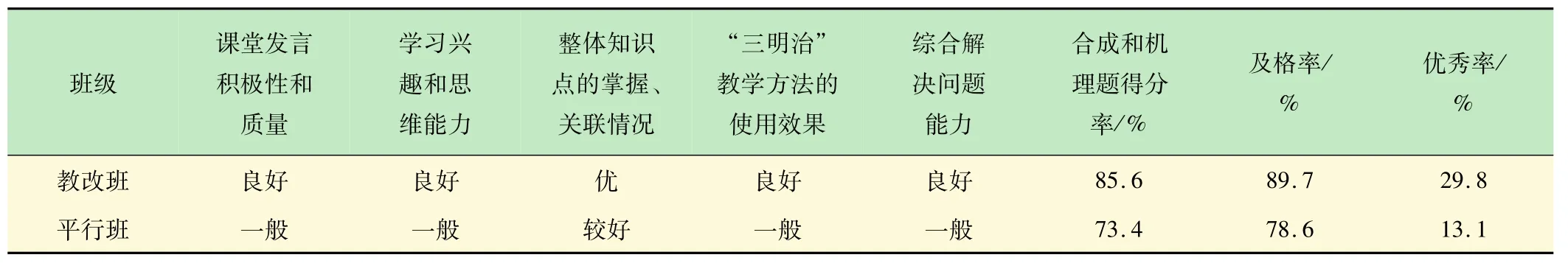
表1 教改班与平行班教学成效分析结果
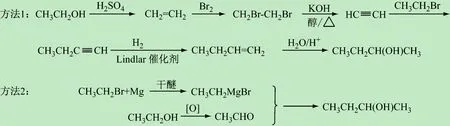
图8 2-丁醇的合成路线
5 成效分析
通过对教改班(化工161班,反应机理主线授课)和平行班(化工162班和163班,按照官能团分章授课)教学效果进行对比分析(见表1),得出如下结果:①教改班课堂教学效果好,同学们能够循序渐进地跟进教师的步伐,思路清晰、积极发言,正确率高;对整体知识的把控较好,能够根据思维导图建立清晰的脉络,举一反三能力、思维判断及推理能力、综合分析和解决问题能力较高;在期末考试中合成和机理题得分率为85.6%、及格率为89.7%、优秀率高达29.8%;②平行班学生在授课前期效果较好,到了后期部分学生力不从心,觉得知识繁多记不住,无法构建众多化合物和反应及机理间的关联,教学效果和综合解决问题能力一般,因此合成和机理题得分率、及格率和优秀率都比教改班低;③“有机反应机理”主线式授课思路易于与新教学方法相融合、并促进新教学方法的高效实行和推广。笔者在前期教学改革工作中,将“三明治”教学方法[16]应用于有机化学课程,取得了一些成效。结果表明,教改班对有机化学课程内容掌握效果较好。这主要是由于该班以反应机理为主线授课,思路清晰、关联性较强,学生只要能够听懂一到二个机理的推演过程,便能够闻一知十地理解其他反应机理,对化合物的反应和机理理解较为深入,尤其在团队合作处理新问题方面显得更为突出。如,教改班的学生提出了两种“以乙醇为原料合成2-丁醇(中间产物)”的方法(见图8)。第1种方法应用了消除反应、亲电加成和催化加氢等反应机理;第2种方法应用了氧化反应和亲核加成的反应机理。这充分体现了他们勇于探索、分析和解决问题能力较强,使新的教学方法得到了升华。由此可见,有机反应机理授课主线和思路的应用对教师授课、学生听课和新教学方法的推行极为有利,将来有望在MOOC教学中取得更好的效果。
6 结 语
为了更有效地发挥有机化学课程基础性和支柱性的作用,理清教学主线是十分必要的,通过反应机理这一主线进行教学能够使学习者明晰有机化合物性质、运用反应规律分析和解决实际问题,是教学过程的重中之重。通过多年的教学实践,得出反应机理的教学过程要分层次、分步骤、循序渐渐地进行:首先以化学键的形成为突破口掌握不同化合物的结构和电子云分布;然后以电子云的分布为切入点分析反应进行的机理(反应类型);再综合利用取代基效应和溶剂效应等因素分析反应过程中活性中间体的稳定性,进而判断反应的取向和反应规律。从中可以看出电子效应在反应机理的教学和学习过程中起着至关重要的作用,应用电子效应可以找到反应的切入口,分析反应中间体的稳定性,因此在教学过程中要着重对其进行讲解和灵活运用。从成效分析可以看出,以反应机理为主线的授课思路和方式不仅能够提高学生的学习兴趣、提升教学效果和成绩的及格率和优秀率,而且有利于深化教学改革。

