比较综合治疗与化疗在KRAS基因突变型转移性结直肠癌患者中的疗效
郭志鹏,闫 欢,刘铁娥,戴广海
解放军总医院第一医学中心 肿瘤内科,北京 100853
在我国,结直肠癌发病率居高不下,处于恶性肿瘤发病率的第4位,死亡率占各种恶性肿瘤死亡率的第5位[1]。表皮生长因子受体(epidermal growth factor receptor,EGFR)和血管内皮生长因子与肿瘤细胞的生长、存活、增殖和转移有关。KRAS蛋白是EGFR信号通路下游的小分子G蛋白,为EGFR信号通路的重要组成部分之一。KRAS发生突变后会导致相关产物的持续活化,进而持续激活MAPK和PI3K-ALK-mTOR信号通路,且不受上游EGFR信号的调控,造成异常的细胞增殖和存活,促进肿瘤的发生发展[2]。有研究发现,相较于KRAS基因野生型患者,KRAS基因突变的患者对表皮生长因子抑制剂耐药,其预后和疗效也较差[3-5]。因此对于KRAS突变的患者需要寻求更有效的治疗手段。在过去的几十年中,手术治疗、化学治疗、靶向治疗以及免疫治疗等不同的治疗手段发展迅速,极大改善了晚期结直肠癌患者的生存质量,并有效延长了其生存时间。近年来研究发现,局部治疗联合化疗在临床中展现出其良好的效果[6]。本研究回顾性分析KRAS基因突变患者的治疗现状,同时探讨局部治疗的价值。
资料与方法
1 资料 收集2012年1月- 2019年8月于我中心住院治疗的明确为KRAS基因突变的135例转移性结直肠癌患者。纳入标准:病理组织学明确为结直肠腺癌;经临床影像学明确有远处器官转移;经基因检测KRAS基因为突变型;体力状况良好,能耐受手术及化疗;符合上述全部条件者入选。排除标准:BRAF或NRAS突变;未行基因检测或检测结果不明;合并其他肿瘤。根据上述标准本研究共选取KRAS基因突变型转移性结直肠癌患者135例。按治疗方式分为综合治疗组(化疗联合局部病灶处理)和化疗组(未经局部处理,仅行化学治疗,联合或不联合血管靶向药物)。
2 治疗方法 化疗组:贝伐珠单抗联合以奥沙利铂或伊利替康为基础的方案(所有化疗均大于2个治疗周期,并经影像学检查评价)。综合治疗组:确诊为转移性结直肠癌后,首先行局部病灶处理以缓解肿瘤负荷,解除局部症状(如肠梗阻等),随后进行化疗;或确诊为转移性结直肠癌后,首先行化疗,评估病灶得到控制,行局部病灶或原发灶处理后,再次行原方案治疗。局部病灶处理包括手术切除、局部放疗以及栓塞、射频消融等介入疗法。所有化疗均大于2个治疗周期,并经影像学检查评价。
3 观察及评价标准 参照实体瘤疗效评价标准(RECIST 1.1)对患者进行疗效评价,期间每2 ~ 3个化疗周期或两个月进行一次影像学评价。疗效评价结果分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。总体客观缓解率(objective response rate,ORR)为 CR+PR。疾病控制率(disease control rate,DCR)为CR+PR+SD。通过电子病历查阅和电话随访的方式对患者进行随访,随访截止日期为2019年8月1日,记录患者无进展生存期(progression-free survival,PFS),定义为一线化疗方案治疗开始至肿瘤进展或患者死亡的时间。
4 统计学方法 采用SPSS22.0统计软件对数据进行分析。计数资料以例数(百分比)表示,ORR和DCR的比较采用χ2检验,若有理论频数<5,则采用校正χ2检验,若有理论频数<1,则采用Fisher确切检验。计量资料(偏态)以中位数Md(IQR)描述,组间比较采用秩和检验。生存资料分析模型为Kaplan-Meier乘积生存模型,组、层间比较为log-rank检验。P<0.05为差异有统计学意义。
结 果
1 两组一般资料比较 综合治疗组78例,中位发病年龄55(95% CI:33 ~ 76)岁,男性48例,女性30例,原发灶位于左半结肠59例,位于右半结肠19例;化疗组57例,中位发病年龄52(28 ~ 76)岁,男性38例,女性19例,原发灶位于左半结肠的有38例,位于右半结肠的有19例。两组性别、年龄等一般资料差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较Tab. 1 Clinical characteristics of 135 patients included in this study (n, %)
2 疗效评价 疾病缓解率:综合治疗组中有21例达到疾病缓解,缓解率为26.9%,内科治疗组有20例达到疾病缓解,缓解率为35.1%(P=0.308),两组差异无统计学意义。疾病控制率:综合治疗组,74例达到DCR,疾病控制率为94.9%;内科治疗组46例达到DCR,疾病控制率为80.7%(P=0.013),两组差异无统计学意义。见表2。
3 两组无进展生存期比较 Kaplan-Meier生存模型分析显示:化疗组中位无进展生存期为6.1(95%CI:4.1 ~ 8.1)个月,综合治疗组中位无进展生存期为11.1(95% CI:9.5 ~ 12.8)个月,两组差异有统计学意义(P=0.000)。见表2。
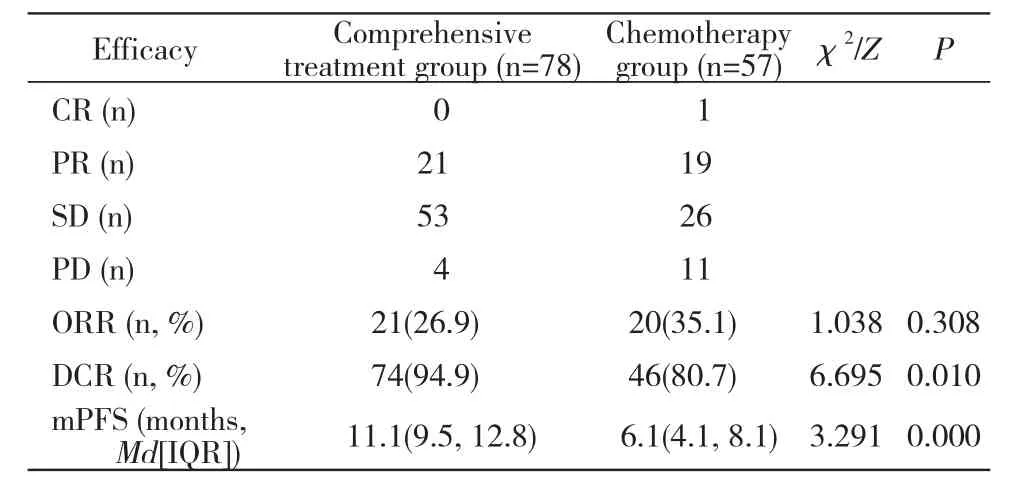
表2 两组患者疗效比较Tab. 2 Comparison of eff i cacy between the two groups
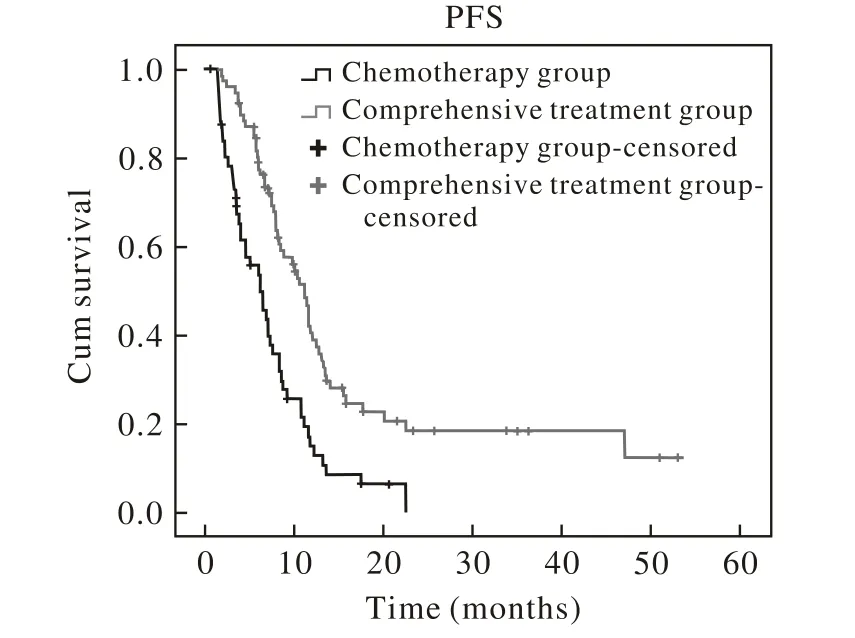
图 1 两组患者无进展生存期曲线Fig. 1 PFS of patients in the two groups
讨 论
结直肠癌作为消化道最常见的肿瘤之一,其发病率和死亡率在世界上许多国家及地区均居高不下。国外研究结果显示,KRAS基因在结直肠癌中的突变率为35% ~ 45%[3-5]。中国结直肠癌患者KRAS基因突变率为30% ~ 45%[7-8]。靶向血管内皮生长因子药物贝伐珠单抗和靶向表皮生长因子受体药物西妥昔单抗因对晚期结直肠癌的良好效果,被推荐作为联合化疗药物用于晚期转移性结直肠癌的一线治疗[9-10]。有文献表明,KRAS突变的结直肠癌患者对EGFR抑制剂西妥昔单抗耐药,其预后也较KRAS野生型患者差[3-5]。KRAS突变型的结直肠癌患者无法从抗EGFR药物中获益已经成为共识,并被写入各大临床指南[9-10],但KRAS基因突变对于晚期结直肠癌患者的预测价值一直存在争议。1998年Andreyev等[11]研究了3 439例不同阶段的结直肠癌患者资料,结果显示,存在KRAS基因突变的结直肠癌患者相对于野生型患者有更高的复发率(P=0.007)和病死率(P=0.004)。之后,Hurwitz等[12]的研究也发现,KRAS基因突变的患者具有更短的PFS和总生存期(overall survival,OS)。相反的,Price等[13]于2011年研究了KRAS状态对使用贝伐珠单抗联合化疗的晚期结直肠癌患者的预后作用,结果显示,KRAS基因状态对于此类病人的PFS、OS并无影响。之后关于KRAS对于结直肠癌患者预后价值的研究不断增多和深入,多个团队研究证实,无论是化疗还是化疗联合血管靶向药物,KRAS基因突变均对患者的生存及预后具有负性预测作用。虽然现在对于KRAS基因状态作为结直肠癌患者的预后预测因素没有达成一致共识,但越来越多的数据显示出其对于预后的负性预测因子作用[14-16]。在本研究中,患者总体的中位PFS为8.3个月,客观反应率为30.37%,略低于Garcia等[16]研究中数据(mPFS:9.4个月,ORR:39%),这可能与本研究中靶向药物使用率有关,本研究中贝伐珠单抗的使用率仅为45%,远远低于上述研究中靶向药物使用率(100%)。
在继往研究中,有学者发现,对于KRAS突变的转移性结直肠癌患者进行更为强烈的内科治疗方案(贝伐珠单抗联合FOLFOXIRI)可以有效地改善其预后,其PFS可以达到12.0个月,OS可以达到27.3个月[17]。这提示我们,对于KRAS基因突变的患者,可能更加适合积极的治疗方式。对于转移性结直肠癌患者而言,针对转移灶进行放射治疗、动脉栓塞治疗以及射频消融治疗等局部治疗手段是安全有效的,已经被各大指南推荐用于适合强烈治疗的晚期转移性结直肠癌患者的姑息治疗。Korkmaza等[18]于2018年在Surgical Oncology发表了其团队的研究成果,研究纳入了341例晚期结直肠癌患者,210例患者原发灶切除后行贝伐联合化疗方案,另外131例患者仅行贝伐联合化疗的化疗方案,结果显示,对于晚期不能行根治术的结直肠癌患者,行原发灶切除可以有效改善患者的PFS(10.4个月vs 7.6个月,P=0.000)。
CLOCC(40004)研究对比了单纯化疗与化疗联合射频消融治疗不可切除的结直肠癌肝转移癌,结果显示联合组与单纯化疗组的PFS分别为16.8个月与9.9个月,OS分别为45.3个月和40.5个月,证实了射频消融对结直肠癌肝转移患者的疗效[19]。对于结直肠癌肝转移的患者而言,肝射频消融、微波消融和立体定向体部放射治疗均可有效改善预后[6]。但由于KRAS突变患者的预后要劣于全野生型患者,因此局部治疗对于KRAS基因突变患者的预后影响尚不明确。
本研究对比化疗与综合治疗两种治疗手段后发现,在疾病控制率和无进展生存期方面,综合治疗组较化疗组具有明显优势,其DCR分别为95%和81%,中位PFS分别为11.1个月和6.1个月,差异均有统计学意义。提示局部病灶处理较化疗可以延长KRAS突变患者生存期。
本研究尚存在一定的不足。首先,本研究中两组患者的初始肿瘤负荷因资料不足,未能充分评估,有可能会影响后续治疗方案,导致预后差异。其次因随访时间不足,中位OS尚未达到,有待进一步观察分析。
综上所述,对于KRAS基因突变的转移性结直肠癌患者,在内科治疗治疗稳定的基础上,及时进行局部病灶的处理可以有效控制疾病,提高患者的无进展生存期。

