γ干扰素基因多态性在子痫前期患者中的表达及对妊娠结局的影响
高 星,孙伟红
承德市中心医院 妇产科 (承德市 067000)
子痫前期是妊娠20周后首次出现的血压升高、蛋白尿,临床多表现为恶心呕吐、上腹部不适、眼花头痛等,严重者可引起抽搐、昏迷等[1]。子痫前期病因复杂,好发于初产妇,能引起较为严重的母儿并发症,影响患者健康生活[2]。既往研究[3]表明,子痫前期的发生是一个多因素过程,常伴有遗传、环境因素的共同参与,具有较为明显的家族遗传性倾向,但临床上对于其发病机制尚未明确。γ干扰素(IFN-γ)基因是子痫前期患者中重要的基因编码,能产生较为重要的IFN-γ炎症因子,直接参与机体细胞免疫调节[4-5]。国内学者研究[6]表明,IFN-γ基因多态性中,rs2430561位点发生突变能增加子痫前期发生率,但是对妊娠结局的影响研究较少。本研究以子痫前期患者和健康孕检的妊娠者作为研究对象,探讨IFN-γ基因多态性在子痫前期患者中的表达及其对妊娠结局的影响,现报道如下。
1 资料与方法
1.1 临床资料
选择2017年6月至2018年10月承德市中心医院子痫前期患者71例为试验组,年龄23~38(27.63±3.41)岁;病程1~4(2.41±0.39)月;体重指数(BMI)23~29(25.62±3.23) kg/m2。患者中,初产妇45例,经产妇26例。纳入标准:1)均符合《妇产科学》第8版中子痫前期诊断标准[7],患者妊娠20周后收缩压≥140 mm Hg,舒张压≥90 mm Hg,部分患者可伴有24 h尿蛋白定量≥0.3 g;2)意识清楚,能与医生进行沟通、交流。选择同期健康孕检的妊娠患者69例为对照组,年龄22~39(28.11±3.43)岁;BMI 22~30(25.77±3.29) kg/m2。其中,初产妇36例,经产妇33例。
1.2 方法
1.2.1 IFN-γ基因多态性测定 1)DNA基因提取。试验组入院后首次取外周空腹静脉血3 mL,对照组正常孕检当天取外周空腹静脉血3 mL,3 500 r/min,离心半径50 cm,离心35 min,血清分离后,加入三羟甲基氨基甲烷缓冲液、乙二胺四乙酸二钠(EDTA)、蛋白酶K等进行过夜孵育,温度设定为37 ℃;向获得的溶液中加入苯酚和Tris缓冲液,离心后获得沉淀物,并向沉淀物中加入乙酸钠、乙醇等,完成DNA基因提取,放置在-70 ℃冰箱中,备用。2)IFN-γ基因SNP位点测定。查阅美国生物技术信息中心数据库,初步确定rs2069705、rs1861493、rs2193050、rs2430561及rs2069718部位的位点,并借助专用软件完成相关引物设计(引物设计均由上海生工生物工程股份有限公司合成)(表1)。设置PCR参数:95 ℃ 预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共进行40个循环,最后72 ℃终延伸5 min。采用单碱基延伸法PCR扩增IFN-γ基因SNP位点[8-9]。

表1 引物设计与合成
1.2.2 SNP位点的基因型测定 利用单碱基延伸法分析IFN-γ基因5个SNP位点的基因型,将IFN-γ基因中rs2430561位点的AT+TT/AA定义为显性模型,TT/AT+AA基因定义为隐性模型,凸显遗传的变化规律[10]。
1.2.3 不同血清标本中IFN-γ水平测定 取上述分离的血清标本,采用酶联免疫吸附试验测定两组不同基因型下IFN-γ水平,利用3550型酶标仪在450 nm下完成吸光度值测定,绘制标准曲线,完成不同血清标本中IFN-γ水平测定[11]。
1.2.4 妊娠结局 记录两组胎死宫内、新生儿窒息、新生儿透明膜病、肝功能损害、急性心衰及弥散性血管内溶血(DIC)发生率。
1.3 统计学方法
采用SPSS 18.0软件处理,定性资料采用例数(%)表示,行2检验,定量资料采用表示,行t检验,检验水准α除特殊说明外均设定为0.05。
2 结果
2.1 两组IFN-γ基因中基因型比较
试验组子痫前期患者SNP基因位点rs2069705、rs1861493、rs2193050及rs2069718基因频率比较,差异无统计学意义(P>0.05);试验组子痫前期患者SNP基因位点rs2430561中AA、AT基因频率低于对照组(P<0.05),TT基因频率高于对照组(P<0.05)(表2)。
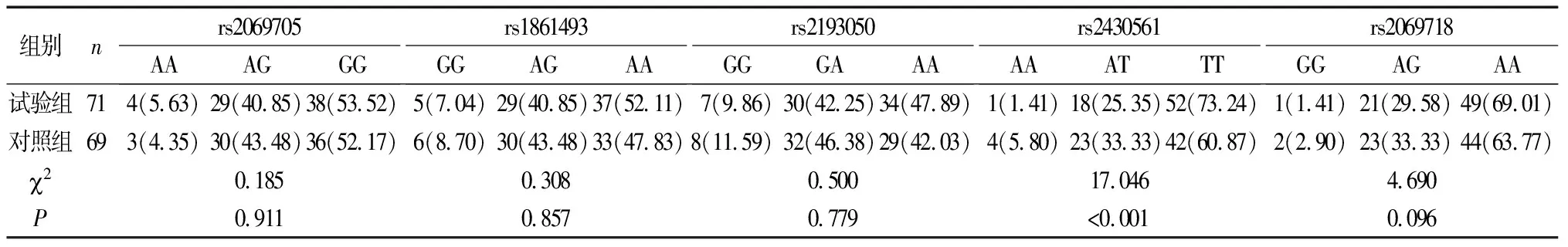
表2 两组IFN-γ基因中基因型比较[n(%)]
2.2 两组IFN-γ基因中等位基因频率比较
试验组子痫前期患者rs2069705中A、G基因频率和rs1861493、rs2193050、rs2069718中G、A基因频率与对照组比较,差异无统计学意义(P>0.05);试验组rs2430561中A等位基因频率低于对照组(P<0.05),T等位基因高于对照组(P<0.05)(表3)。
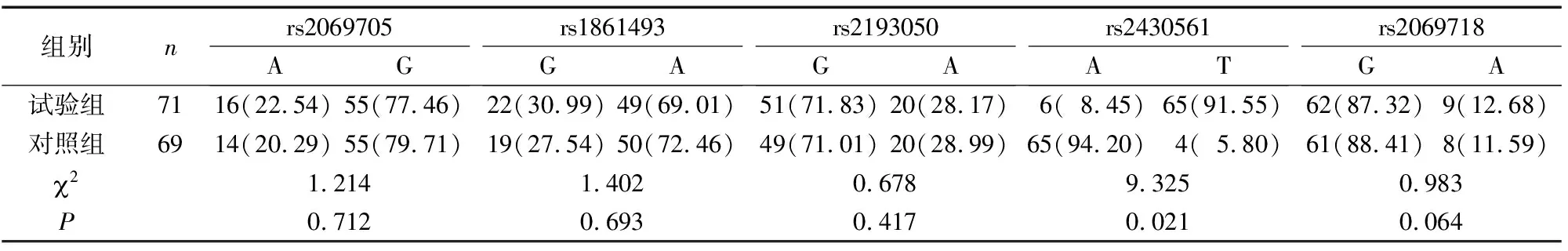
表3 两组IFN-γ基因中等位基因频率比较[n(%)]
2.3 两组不同基因型下IFN-γ水平比较
试验组与对照组AA基因位点下IFN-γ水平差异无统计学意义(P>0.05);试验组TT、AT、AT+AA基因位点下IFN-γ水平高于对照组(P<0.05)(表4)。
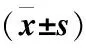
表4 两组不同基因型下IFN-γ水平比较
2.4 两组妊娠结局比较
试验组子痫前期患者胎死宫内、新生儿窒息、新生儿透明膜病、肝功能损害、急性心衰及DIC发生率高于对照组(P<0.05)(表5)。
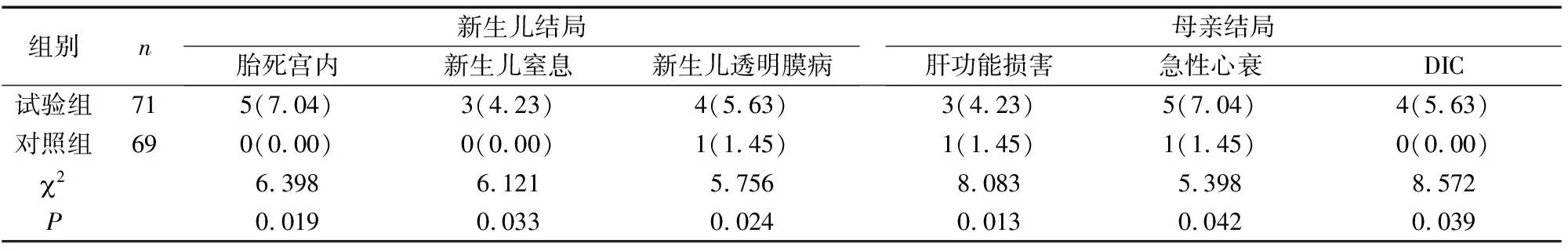
表5 两组妊娠结局比较[n(%)]
3 讨论
子痫前期是妊娠期特有的疾病,临床对于其发病机制尚未明确,普遍认为与高血压、蛋白尿等有关,且随着患者病情的不断发展,将会引起身体器官功能障碍。国外学者[12]以重度子痫前期患者116例、正常孕妇107例及未孕女性56例作为对象,完成IFN-γ基因位点测定,结果表明,IFN-γ基因在重度子痫前期患者中基因频率较高。本研究中,试验组子痫前期患者SNP基因位点rs2069705、rs1861493、rs2193050及rs2069718基因频率比较差异无统计学意义(P>0.05);试验组子痫前期患者SNP基因位点rs2430561中AA、AT基因频率低于对照组(P<0.05),TT基因频率高于对照组(P<0.05);试验组rs2430561中,A等位基因频率低于对照组(P<0.05),T等位基因频率高于对照组(P<0.05),说明IFN-γ基因中rs2430561位点在子痫前期患者中基因频率较高,可能直接参与子痫前期的发生、发展。国内学者[13]研究表明,子痫前期病因复杂,发生时常伴有母体免疫缺陷、体液免疫增强,导致Th1/Th2发生免疫失衡,且子痫前期患者免疫应答以Th1型细胞因子为主,持续的Th1表达异常将会引起Th1/Th2发生免疫失衡,影响滋养细胞增殖与细胞浸润障碍,引起血管内皮细胞受损,延缓胎盘生长发育,影响妊娠结局。IFN-γ基因主要定位于染色体12q15中,能在人体内产生相对重要的免疫调节蛋白IFN-γ。国内研究[14]表明,IFN-γ由Th1细胞分泌产生,且在子痫前期患者多呈高表达,能抑制Th2细胞分化,促进细胞活性、增殖,从而进一步损害胎盘组织,影响母婴结局。本研究中,试验组与对照组AA基因位点下IFN-γ水平差异无统计学意义(P>0.05),试验组TT、AT、AT+AA基因位点下IFN-γ水平高于对照组(P<0.05),说明IFN-γ基因中不同基因位点下IFN-γ水平存在明显的差异性,能直接参与疾病的发生、发展。国内学者[15]进行了一次动物实验,给予小鼠注射过量的IFN-γ后,大大增加流产概率,部分大鼠宫内发展迟缓。同时,IFN-γ能与肿瘤坏死因子-α相互作用,促进细胞活化、增殖,损害胎盘组织,抑制小鼠胚胎生长、发育。本研究中,试验组子痫前期患者胎死宫内、新生儿窒息、新生儿透明膜病、肝功能损害、急性心衰及DIC发生率均高于对照组(P<0.05),说明IFN-γ基因多态性能影响子痫前期母婴结局,对伴有IFN-γ基因多态性的子痫前期患者可能会增加母婴不良结局发生率,影响母婴健康;因此,临床上对于确诊的子痫前期患者应加强IFN-γ基因多态性测定,预测母婴结局,对于高风险、高危患者,可尽早终止妊娠。
综上所述,IFN-γ基因中rs2430561位点是子痫前期的易感基因位点,并且不同基因型下患者血清IFN-γ均呈高表达,能影响患者妊娠结局。

