移植前输注间充质干细胞对脑死亡供鼠移植肾炎症细胞浸润及TNF-α和IL-1β表达的影响*
李 萍,王 静,戴成祥,朱 华
1.上海市脐带血造血干细胞库 (上海 201210);2.上海赛比曼生物科技有限公司 (上海 201210);3.上海交通大学医学院附属上海儿童医学中心 (上海 200127)
当前,移植手术需要的器官来源主要依靠公民死亡后的捐赠,移植分为两种,即尸体和活体器官,尸体器官占我国目前可进行器官移植手术的绝大部分[1-2]。肾脏移植是临床各科室中成功率较高的器官移植,但移植排斥是导致移植失败的主要难题[3-4]。当移植肾由高炎症状态的脑死亡者提供时,进行临床肾移植后易导致临床免疫排斥反应加重,恢复时间长,从而使移植肾不能持久存活或功能不全[5]。
有研究[6]发现,间充质干细胞(mesenchymal stemcells,MSC)能够缓和坏死组织、发挥免疫调节作用,成为肾移植过程中的主要参与者。国际ISCT指导方针表明,MCS由具有贴壁生长的细胞群体组成,有超过95%细胞都可表达CDl55及CD73等,MCS多存在骨髓和脂肪组织内。MSC在移植器官中发挥重要作用,有效改善器官移植时出现的免疫排斥反应,挽救边缘捐赠器官,并可减少机体自身免疫应激导致的组织纤维化过程。有研究[7]对大鼠进行移植肾时发现,使用MSC对肾脏进行输注,90 d后肾小管和肾小球功能恢复正常,肾纤维化解除,说明MSC在肾移植过程中具有改善作用。肿瘤坏死因子(TNF-a)具有炎性的细胞因子[8],有研究[9]表明,当机体出现炎症时,TNF-a表达升高,IL-1β是最早被人们发现的白介素炎症因子,在众多疾病中都发挥作用,但在肾移植中的研究还比较少见,因此,本研究于移植前静脉输注MSC处理脑死亡供鼠,旨在探讨其对移植肾炎症细胞浸润及TNF-α和IL-1β表达的影响。
1 材料及方法
1.1 材料
1.1.1 实验对象 雄性、雌性大鼠各半,体重(0.2±0.012)kg,移植肾的供者为无特殊病原体(specificpathogen free,SPF)级F344大鼠,移植肾的受者为SPF级Lewis大鼠,均购自美国Charles River,此次研究符合动物伦理学标准。
1.1.2 主要实验试剂 DMEM/F12培养基(上海,Qiyi Biotechnology),IL-1β(上海,Research Biotechnology),TNF-α(北京, Luyuan Bird Biotechnology),二氨基联苯胺试剂盒(上海,Crystal anti-effective company),新山地明(德国,Scherer GmbH),自动生化分析仪(日本日立),Masson'sTrichrome试剂盒(上海韵涵),一抗、LIJ羊抗小鼠二抗、LIJ羊抗兔二抗(江苏碧云天生物技术研究所),actin抗体、PVDF膜(北京索莱宝科技有限公司),BCA蛋白定量试剂盒(美国Pierce公司),免疫荧光试剂盒(北京华夏远洋生物商城),电泳仪(美国Bio-Rad公司)。
1.2 实施方法
1.2.1 收集骨髓MSC 麻醉F344大鼠后,将股骨和胫骨放在L-DMEM培养基内,反复冲洗,收集冲洗液,以离心半径60 mm,转速4 000 r/min, 离心15 min,弃上清液,加胎牛血清,细胞培养,收集骨髓MSC,加入胰酶后30 min采用磷酸盐缓冲洗3次。加入FITC标记的小鼠抗人抗体,37.5 ℃孵育30 min, 保存到-80 ℃中备用。
1.2.2 分组处理 分为活体供肾移植组、脑死亡供肾移植组、MSC输注组(脑死亡供肾移植)3组,每组各5例F344大鼠和5例Lewis大鼠。1)活体供肾移植组: F344大鼠仰卧固定,85%乙醇消毒,腹部切口,游离肾脏,同时剪断输尿管。再在左侧肾动脉处开口,供肾置人4 ℃生理盐水,肝素灌注左肾动脉,将供肾原位植入已切除左肾的Lewis大鼠体内。两定点法端端吻合肾动静脉和输尿管。开放血流后,移植肾情况良好。2)脑死亡供肾移植组:给予F344大鼠腹腔内注射10%水合氯醛麻醉,在动脉处安置血压监测管,气管插管,接动物呼吸机。将3F Fogarty管垂直插人大鼠颅内,增大导管气囊,大鼠脑死亡后,6 h后取左侧肾脏,移植到Lewis大鼠体内。3)MSC输注组:F344大鼠脑死亡后,静脉输注异体F344大鼠的MSC 5×106个,6 h后摘除左侧肾脏,移植到Lewis大鼠。
1.2.3 生命体征及肾血流动力检测 建模后,观察3组大鼠AMP及HR变化,并采用多普勒血流显像仪检测大鼠PSV、EDV、及MN等水平。
1.2.4 组织提取 手术当天起,给予所有受者新山地明(0.15 mg/100 g,1次/d,肌注,10 d,切除其右肾。术后35 d获取移植肾标本,作病理学检测。
1.2.5 3组大鼠血清中的生化指标 建模成功及注射MSC 14 d后,取大鼠静脉血2 mL,自动生化分析仪监测,观察3组大鼠不同时间点的血清肌酐水平。
1.2.6 Masson′s Trichrome 检测3组大鼠肾组织病理分析,提取3组大鼠肾组织切片,用8%甲醛在低温下进行48 h处理,用无水乙醇进行脱水,DMB透明处理,石蜡包埋2 μm,24 h后清水洗净,并自然风干,采用Masson′sTrichrome试剂盒染色,步骤按照说明书进行,光学显微镜下观察肾组织变化。
1.2.7 TUNEL 检测 取3组大鼠肾组织冰冻切片,2 μm的5张,4%多聚甲醛溶液固定,滴加阻断剂后室温孵育2 min,后进行TUNEL染色,棕色为凋亡的上皮细胞,具体步骤按照说明书进行,反复PBS洗片,甘油PBS溶液封片后,每只大鼠切片分别随机观察30个不同视野计数TUNEL阳性细胞数目,采用Lasersharp 2000软件进行摄像,计算出平均值。
1.2.8 蛋白质印迹法检测TNF-α蛋白表达 在6孔板中加入100 μg的胰蛋白酶提取液,并注入2 mL的培养基停止消化,再将细胞提取液放入EP管中,并与胰蛋白酶提取液按照1∶100进行混合,再放入冰箱中冷冻10 min使细胞完全裂变,成为E溶液;在EP管中放入肾组织并按照1∶100比例加入胰蛋白酶提取液2 mL,使细胞完全裂变,成为F溶液;再把E和F溶液以80∶1的体积进行摇匀,配制成工作液,放入37.5 ℃的保温箱中20 min,冷却后计算TNF-α蛋白浓度。
1.2.9 免疫荧光检测IL-1β 免疫荧光石蜡切片脱蜡水化,水去除非特异性干扰(30%双氧水),采用5%多聚甲醛固定,20 min后,进行PBS冲洗,再用Triton 处理10 min,采用3%BSA密封1 h,培育24 h, 将羊抗小IgG Alexa Flour488加入,在避光下培育1 h,用PBS洗涤3次,加入4,6-diacetyl-2-phenyl decanoate,在37.5 ℃下避光染色15 min,放置荧光显微镜下观察。
1.3 统计学方法
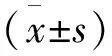
2 结果
2.1 3组大鼠肾脏移植后的生命体征及肾血流动力变化
3组大鼠移植后生命体征(AMP、HR)在加压前、中后差异均无统计学意义(P>0.05),肾血流动力学差异有统计学意义(P<0.05)(表1~2)。
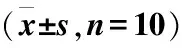
表1 3组大鼠肾脏移植后的生命体征比较
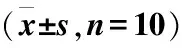
表2 3组大鼠肾血流动力的变化
注:与活体供肾移植组比较,*P<0.05;与脑死亡供肾移植组比较,#P<0.05
2.2 术后血清肌酐值比较
术后各时间点,与脑死亡供肾移植组相比,活体供肾移植组和MSC输注组的血清肌酐均较低(P<0.001),术后第21天,MSC输注组的血清肌酐值高于活体供肾移植组((P<0.05)(表3)。
2.3 观察3组大鼠肾组织病变程度
活体供肾移植组肾组织排列整齐,脑死亡肾移植组上皮细胞出现肿胀,中性粒细胞浸润严重,MSC输注组仍然可见轻度肾小球肥大,但与脑死亡肾移植组比较,肾小球体积变小,肾小管水肿减轻,有少量中性粒细胞炎性浸润(图1)。
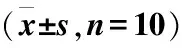
表3 术后血清肌酐值比较
注:F值、P值为3组组建整体比较;t1、P1为脑死亡供肾移植组与活体供肾移植组比较;t2、P2为MSC输注组与活体供肾移植组比较,t3、P3为MSC输注组与脑死亡供肾移植组比较
2.4 3组大鼠肾上皮细胞凋亡情况比较
棕色表示凋亡的上皮细胞,活体供肾移植组平均凋亡率为19.5%,脑死亡供肾移植组肾上皮细胞平均凋亡率最高(43.0%),与脑死亡供肾移植组相比,MSC输注组上皮细胞有所好转,凋亡率为29.4%(图2~3)。
注:与活体供肾移植组比较,*P<0.05;与脑死亡供肾移植组比较,#P<0.05
2.5 3组大鼠免疫荧光检测IL-1β
脑死亡供肾移植组IL-1β阳性表达明显高于活体供肾移植组,MSC输注组IL-1β阳性表达稍多于脑死亡供肾移植组(图4)。
2.6 3组大鼠肾组织中TNF-α蛋白表达
脑死亡供肾移植组大鼠肾组织中TNF-α蛋白表达(14.89±2.17)明显最高于活体供肾移植组(5.13±1.62),TNF-α蛋白在MSC输注组的表达少于脑死亡供肾移植组(7.42±1.08)(图5~6)。
注:与活体供肾移植组比较,*P<0.05;与脑死亡供肾移植组比较,#P<0.05
3 讨论
近年来,关于MSC治疗慢性肾病的研究逐渐增多,龚正媛[9]研究发现,采用MSC对肾病大鼠具有改善肾毛细血管及减轻肾小球纤维化的作用。王萍[10]研究表明,在大鼠肾脏纤维化过程中,MSC能减少纤维化病变程度,减少周围毛细血管的丢失,但对大鼠的存活率无意义。MSC能够减少炎症浸润[11],这与本文病理研究结果一致,说明MSC在改善大鼠肾病的同时,能够局部改善肾纤维化的过程,缓解肾组织纤维化。
当移植肾由高炎症状态的脑死亡者提供时,产生和释放大量炎症介质,诱导机体出现严重临床排斥反应,导致移植肾脏后器官恢复减慢,功能衰退。若移植前可减轻脑死亡供肾的“炎症”程度,改善供肾情况,可使其功能和长期存活能力加强。MSC具有高度自我更新和代谢及免疫调节能力,可促进细胞因子大量分泌,直接与免疫细胞接触发挥作用。本研究分为活体供肾移植组、脑死亡供肾移植组、MSC输注组3组,于移植前静脉输注MSC处理脑死亡供鼠,旨在探讨其对移植肾炎症细胞浸润及TNF-α和IL-1β表达的影响。
本研究发现,血清肌酐水平在脑死亡供肾移植组表达最高,在MSC输注组高于活体供肾移植组。机体内血清肌酐水平越高对机体的伤害越大,会减弱肾小球的过滤功能,加重组织纤维化,导致肾功能下降。MSC输注组肾功能的损害程度较弱。脑死亡供肾移植组中性粒细胞炎症浸润严重,MSC输注组可见轻度炎性浸润,相比脑死亡供肾移植组上皮细胞肿胀减轻,在活体供肾移植组肾组织无异常表现[12]。MSC可通过调节免疫细胞发挥其免疫调节作用,抵抗巨噬细胞和NK细胞的增殖和分化,改善受损的肾组织,降低移植肾炎症水平,改善移植肾质量和功能,增强其长期存活能力[13]。杨军等[14]通过大鼠缺血再灌注实验发现,在肾动脉中输注MSC可减少中性粒细胞表达,说明MSC可在肾组织中快速迁移并做功,促进上皮细胞生长繁殖,有利于肾组织的好转。
脑死亡供肾移植组凋亡程度最高,MSC输注组凋亡程度减弱,活体供肾移植组最轻。MSC可抑制大鼠肾纤维化转化,减少上皮细胞凋亡,这可能与抑制TNF-α和IL-1β有关[15]。TNF-α和IL-1β是机体发生炎症反应的代表因子之一,通过多种有害细胞活化表达,如NK细胞、中性粒细胞等。陈纬纬等[16]研究发现,通过使用间充质干细胞可抑制脑死亡肾移植TNF-α和IL-1β的活性表达,马华林等[17]将MSC用于肾移植24 h后发现,TNF-α和IL-1β的表达明显减少,能够降低炎性因子的释放,改善病情。段淑芳等[18]发现,MSC在肾移植过程中可发挥明显抗炎作用,阻碍巨噬细胞活化,从而抑制NF-α和IL-1β释放,减少肾移植过程中受到的损伤[19-20],与本研究结果一致。上述结果提示,可能是MSC的免疫原性较低,因此能够改善移植肾质量和功能,增强长期存活能力。
综上所述,移植前输注MSC能够减少脑死亡大鼠肾炎性浸润状态,抑制肾上皮细胞凋亡,高含量的MSC能够减少TNF-α和IL-1β表达,减少肾排除现象发生。

