Ficoll分离法富集脐带血自然杀伤细胞的实验条件分析*
曹 倩,冉凤萍,孙 海,蒙 露,陈 巧,段 曦,郑武燕,刘佳慧,李 华,邹 强△
1.成都医学院 基础医学院(成都 610500); 2.成都医学院 科研实验中心(成都 610500); 3.成都医学院第一附属医院 产科(成都 610500);4.西安海棠职业学院(西安 710038); 5.成都中医药大学 基础医学院(成都 610075); 6.西部战区总医院 肿瘤科(成都 610083)
自然杀伤细胞(natural killer cell,NK)不受主要组织相容性复合体(major histocompatibility complex,MHC)限制,能直接杀伤肿瘤细胞,具有高效快速的抗肿瘤作用,因此已成为肿瘤免疫细胞治疗研发中一种重要的细胞药物。基于异体NK治疗各类血液肿瘤和实体瘤的临床试验正在展开,已有结果[1-4]表明,NK具有一定的抗肿瘤临床疗效。而且在异体NK移植给人类白细胞抗原(human leukocyte antigen,HLA)Ⅰ类杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR)配体缺失受者的HLA半相合造血干细胞移植(hematopoietic stem cell transplantation,HSCT)试验中还发现,同种反应性NK不仅具有抗白血病细胞效应,而且对移植物抗宿主病(graft-versus-host disease,GVHD)具有保护作用,临床上可减少复发,延长急性髓细胞性白血病(acute myeloid leukemia,AML)患者生存时间[5-6]。特别是将嵌合抗原受体(chimeric antigen receptor,CAR)分子表达于NK上的CAR-NK抗肿瘤研究[7-11]被认为有望突破CAR-T治疗实体瘤的瓶颈,仅在美国clinicaltrials网站(https://clinicaltrials.gov)注册的CAR-NK临床试验就已有10项。
NK可通过NK株、骨髓造血干细胞、外周血和脐血中分离获得。鉴于NK株的潜在致瘤性[12]、EB病毒易感性[13]以及骨髓来源NK的体外扩增培养技术难度[14-15],使得目前临床试验多采用外周血作为NK来源。但研究[16-21]表明,脐带血(umbilical cord blood,UCB)似乎是更理想的NK采集源:1)UCB中NK比例(30%)远高于外周血(10%);2)CD56brightNK比例更高;3)含有更多的祖细胞;4)表达更高水平的骨髓归巢受体CXCR4,骨髓归巢潜能更强;5)IL-15活化的UCB NK具有更强迁移和克隆形成能力;6)更强的杀伤肿瘤细胞能力。近年来已有越来越多的UCB NK用于临床研究[11]。
从全血中采集NK一般采用Ficoll常规分离法。然而,UCB是胎儿娩出、脐带结扎并离断后,残留在胎盘和脐带中的血液,与外周血相比,因其取血量及保存条件等不可控实验因素较多,如何从UCB中高效采集理想的NK是UCB NK临床应用的先要问题。本研究对实际工作中常见实验条件进行逐一探讨,观察不同实验条件变化下,Ficoll法富集NK的效果是否具有明显差异,摸索最佳UCB处理条件,为UCB NK临床应用提供技术保障。
1 资料与方法
1.1 临床资料
22~35岁健康足月正常分娩产妇的UCB由四川省成都市新都区成都医学院附属医院产科提供,孕妇和家属签署知情同意书。UCB纳入标准:1)产妇年龄22~35周岁;2)妊娠37~42周;3)产妇营养正常;4)无HIV、HBV、梅毒等传染性疾病;5)无恶性肿瘤及遗传性疾病;6)无乙型、甲型肝炎;7)无妊娠并发症。UCB排除标准: 1)产妇年龄<22周岁及>35周岁;2)产妇营养不足、胎儿发育异常;3)产妇有传染性疾病及严重遗传性疾病。
1.2 主要材料
淋巴细胞分离液Lymphoprep TM[密度:(1.077±0.002)kg/L]购自挪威Axis-shield公司;复方泛影葡胺(密度:1.412 kg/L)购自上海旭东海普药业有限公司;RPM1640购自美国Hyclone公司;荧光标记的鼠抗人CD56-PE、CD3-BV711、7-AAD购于BioLegend公司;一次性塑料采血袋购自四川南格尔医学生物有限公司。
1.3 仪器
低速离心机JW-1024购自安徽嘉文公司;流式细胞仪Novosampler Q购自比利时ACEA公司;生物安全柜购自美国Thermo公司。
1.4 方法
1.4.1 UCB保存与NK富集 含预留抗凝剂的一次性200 mL采血袋无菌采集的同1份新鲜UCB分成3组,分别存放于冷藏(4 ℃)、室温(25 ℃)和孵育温度(37 ℃)。考虑到实际UCB分离操作距临床UCB采集时间多为以下4种情况:临床UCB无菌采集后立即分离处理,约为3 h;或产妇生产结束后再回实验室分离处理,约为7 h;或UCB保存过夜,次日早上分离,约为19 h;或次日下午分离UCB,约为26 h,因此摸索的保存时间定为3、7、19、26 h。采用常规Ficoll密度梯度离心法分离,操作步骤按照Axis-shield密度梯度分离液说明书进行。
1.4.2 UCB复温 将4 ℃保存的同1份UCB分为复温37 ℃组和4 ℃对照组,分别于0、1、2、3、4 h按常规Ficoll密度梯度离心法分离单核细胞。
1.4.3 不同密度淋巴细胞分离液富集NK 常规Ficoll淋巴分离液产品密度为1.077 kg/L,按比例加入不同体积的复方泛影葡胺(密度1.412 kg/L)配置不同密度的淋巴细胞混合分离液。混合液密度=(复方泛影葡胺密度×体积+Ficoll淋巴分离液密度×体积)/(复方泛影葡胺体积+Ficoll淋巴分离液体积)。将同1份UCB分别采用不同密度淋巴细胞分离液进行梯度离心分离单核细胞,检测富集的NK(表1)。
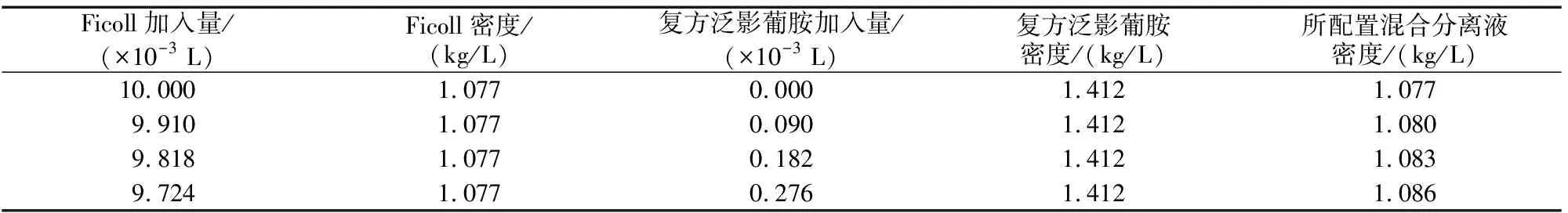
表1 不同密度淋巴细胞分离液10 mL体系的配制
1.4.4 NK存活率检测 鼠抗人CD56-PE、鼠抗人CD3-BV711和7-AAD各0.5 μL与8.5 μL 磷酸盐缓冲液(phosphate buffered saline,PBS)混合,配制10 μL荧光标记物混合液,加入20 μL待测单细胞悬液中混匀,室温避光染色15 min,流式细胞仪检测[22]。CD3-CD56+细胞为NK,7-AAD+细胞为死细胞,7-AAD-细胞为活细胞。流式检测CD3-CD56+7-AAD-细胞,计数,即为NK活细胞。存活率=检测时刻的NK活细胞数/新鲜采集UCB(0 h)的NK活细胞数×100%。
1.4.5 NK回收率检测 流式细胞仪检测Ficoll分离法富集前后的UCB NK绝对数,计算回收率。计算公式:NK回收率=(富集后NK密度×富集后体积/未富集UCB中的NK密度×未富集UCB体积)×100%。
1.4.6 粒细胞残留比例检测 根据粒细胞大小在流式前向角散射(forward scatter,FSC)和侧向角散射(side scatter, SSC)散点图中的分布特点,设门,粒细胞计数,计算粒细胞残留比例。粒细胞残留比例=粒细胞数量/总细胞数量。
1.5 统计学方法
2 结果
2.1 复温对UCB NK富集的影响
UCB 4 ℃冷藏保存19、26 h后,分别复温至37 ℃,1 h,再进行Ficoll法分离单核细胞。流式检测富集后细胞悬液中UCB NK回收率:4 ℃保存19 h UCB的复温组(97.5±2.3)%高于未复温组(85±3.5)%;保存26 h UCB的复温组(98.8±2.7)%高于未复温组(72.2±3.3)%。粒细胞残留率在19 h和26 h的复温组与未复温组差异无统计学意义(P>0.05)。结果提示:复温37 ℃、1 h能够明显提高4 ℃冷藏保存的UCB NK回收率,且不会增加粒细胞残留比例(图1)。
注:A:复温时间对NK回收率的影响;B:复温时间对富集后细胞悬液中粒细胞残留的影响;C:复温对富集后细胞悬液中残留粒细胞比例的影响;与复温组比较,*P<0.05,**P<0.01
2.2 不同UCB保存温度对NK存活及富集的影响
检测不同时刻、不同保存温度下NK存活率,结果显示:NK活细胞数量在4 ℃条件下,可持续保存26 h无明显变化;25、37 ℃保存至7 h无明显变化,但随后NK活细胞数随时间延长而减少,26 h时,25、37 ℃的NK存活率分别减少至3 h的(59.0±4.3)%和(42.5±3.7)%,说明对NK活性无影响的较好长时间保存温度是4 ℃。检测不同时刻、不同保存温度下,Ficoll法分离的单个核细胞悬液中NK回收率,结果显示:4 ℃保存条件下,3、7 h的NK回收率为100%,但19、26 h的回收率呈下降趋势,26 h的回收率下降至(72.2±3.3)%,说明4 ℃的长时间保存温度对获得理想NK回收率不利。25 ℃和37 ℃保存条件下,3、7、19、26 h的NK回收率无明显变化,接近100%,说明25 ℃和37 ℃温度保存对NK富集无影响。但UCB超过7 h保存,无论哪种保存温度,其Ficoll分离法富集后的细胞悬液中粒细胞残留比例随着保存时间延长而逐渐增加。因此,综合NK存活率、回收率,UCB只要在7 h以内Ficoll分离,这3种保存温度差异无统计学意义(P>0.05)(图2)。
注:A:不同保存温度对脐血NK细胞存活率的影响;B:不同保存温度对NK回收率的影响;C:不同保存温度对Ficoll法分离后的粒细胞残留率影响;D:流式检测Ficoll法分离后粒细胞残留比例
2.3 复温时间的优化
为进一步探究4 ℃冷藏的UCB复温至37 ℃多长时间更有利于NK富集,分别检测了37 ℃复温0、1、2、3、4 h NK存活率以及常规Ficoll法富集NK回收率和粒细胞残留比例情况,结果显示:37 ℃复温0~4 h各组的UCB NK活细胞数差异无统计学意义(P>0.05),说明37 ℃复温4 h操作对UCB中NK活性不影响。复温1 h可将NK细胞回收率由0 h的(65.0±3.5)%提高到(96.0±4.1)%,差异有统计学意义(P<0.001)。但2、3、4 h回收率与1 h回收率差异无统计学意义(P>0.05),说明37 ℃复温1 h已达回收率最高限。各时刻富集的细胞悬液中粒细胞残留比例随着复温时间延长而增加,4 h可达38.15%。结果表明:对4 ℃保存的UCB放置37 ℃的最佳复温时长为1 h(图3)。
注:A:复温时间对NK细胞存活率的影响;B:复温时间对NK细胞回收率的影响;C:复温时间对Ficoll分离法所获得的细胞悬液中粒细胞残留比例的影响;D:流式检测不同复温时间分离的单个核细胞悬液中粒细胞残留比例;与复温0 h比较,***P<0.001
2.4 Ficoll密度对4 ℃保存的UCB NK富集的影响
为探讨提高分离液密度是否有助于低温保存UCB的NK富集,检测了不同密度分离液分离4 ℃保存19、26 h UCB的富集效果,结果显示:19 h和26 h的两组UCB NK回收率均随分离液密度升高而提高,但分离后细胞悬液中的粒细胞残留量也随分离液密度升高而有所增加。结果表明:提高分离液密度可提高低温保存UCB NK回收率,但粒细胞残留比例也随之增加(图4)。
注:A:不同密度分离液分离UCB获得的NK回收率;B:不同密度分离液分离UCB后粒细胞残留比例;C:流式检测不同密度分离液分离UCB后粒细胞比例
2.5 抗凝剂含量对UCB NK存活及富集的影响
临床常规使用一次性无菌采血袋规格为200 mL,内含预留抗凝剂28 mL,因此,抗凝剂/UCB为0.14。而UCB临床实际采集量通常为50~100 mL,抗凝剂与血量比例往往高于0.14理想比例。为探究高比例抗凝剂是否对NK活性及富集的影响,本实验将同1份UCB分别与不同体积的抗凝剂混合,以抗凝剂/UCB为0.14记1×,抗凝剂/UCB为0.65记4×,分别将此两组UCB于4 ℃保存26 h。结果显示:1×组NK存活率与4×组差异无统计学意义(P>0.05),1×组NK回收率高于4×组(P<0.05)。两组的粒细胞残留在分选前分别为(64.7±5.3 )%和(67.1±4.7) %,分选后为(29.7±3.3 )%和(25.1±4.5) %,分选前后差异无统计学意义(P>0.05)。结果表明:抗凝剂比例变大虽然不影响NK存活率,但会降低Ficoll分离的NK回收率,对粒细胞清除效果无影响(图5)。
注:A:抗凝剂比例对细胞存活率影响;B:抗凝剂比例对细胞回收率影响;C:抗凝剂比例对NK分离过程粒细胞去除效果的影响;D:抗凝剂比例对NK分离过程粒细胞去除效果影响的流式结果;与1×组比较,*P<0.05;与分选前比较,**P<0.001
3 讨论
UCB NK因其具有肿瘤杀伤能力强、免疫源性低、体外扩增速度快等优点,被广泛用于肿瘤细胞治疗研究。无论从临床新鲜采集UCB进行研究,还是UCB库的建立,都面临如何从UCB中有效富集更多NK活细胞这一技术问题。Ficoll密度梯度离心分离法是分离全血单个核细胞的常规方法。Ficoll液去除红细胞和粒细胞,达到富集淋巴细胞目的。与外周血采集不同,UCB采集时间、采集量、处理时间等诸多实验因素不可控,这些波动因素对NK富集的影响未知,因此分析实际工作中遇到的这些波动因素对Ficoll富集NK的影响以及探索优化方案显得尤为重要。本研究着重探究了保存温度、保存时间、分离液密度以及抗凝剂比例对NK存活与Ficoll分离的影响,并探索了解决问题的优化方案。
临床采集的UCB可选择冷藏(4 ℃)、室温保存(25 ℃)或者接近体温的37 ℃保存。同时根据实际工作流程的时间安排方面,UCB分离距采集时间多为3、7、19、26 h,因此同时也摸索了这4个保存时间对UCB分离的影响。本研究发现,冷藏会降低NK的Ficoll分离回收率,而室温和37 ℃保存的样品能更好确保NK回收率。但是,冷藏能够更好保持NK细胞活力,即使保存26 h,UCB中存活的NK活细胞数未见明显减少;而在室温25 ℃和37 ℃保存条件下,UCB保存7 h后其NK活细胞数开始逐渐减少,保存26 h后活细胞数减少至保存前50%。因此,如何提高4 ℃保存UCB的NK回收率尤为重要。在分离前,将4 ℃保存的UCB复温至37 ℃,能够有效增加NK回收率。缩短复温时间的处理不仅可提高回收率,而且能确保低比例粒细胞的残留。此外,温度可能导致分离体系密度的变化,也可以通过提高Ficoll密度得到矫正,向标准密度1.077 kg/L的Ficoll液中添加泛影葡胺以提高分离液密度,可有效提高NK回收率。
此外,由于通常临床采用200 mL规格含抗凝剂的血袋采集UCB,但临床采集UCB血量随采集方法、医生采血习惯及产妇差异而不同,统计数据[12]显示,临床平均采血量为75 mL。因此,200 mL规格血袋采集的UCB往往含过量抗凝剂。为探索高比例抗凝剂是否影响NK存活与富集,对比了4倍比例与正常比例的两组数据,结果显示:高于正常4倍的抗凝剂含量虽不影响NK存活,但会明显降低Ficoll法富集NK的回收率。提示,在实际工作中,在较少采血量的情况下,应注意选择小规格采血袋或适当减小采血袋中预留的抗凝剂量,才能有效提高后续Ficoll法富集NK的回收率。
源于临床的UCB样品存在诸多变量,其中就包括UCB保存条件、保存时间以及抗凝剂与UCB体积比例等,探究这些变量对UCB NK获取的影响,有利于实际工作中获得理想的NK回收率,为后续研究及应用提供足够研究材料。

