细叶百合LpNAC13基因的克隆及其表达1)
王营 关春景 崔颖 刘彬 张彦妮
(东北林业大学,哈尔滨,150040)
细叶百合(Liliumpumilum)是百合属中分布区域最广,分布纬度偏北的种之一,其适应范围广,极耐寒,耐干旱与盐碱,是百合抗性育种的重要亲本[1]。其花瓣反卷鲜红色,鳞茎可食,是一种兼具食用、药用和观赏价值的植物[2-3]。
植物在生长发育的过程中,经常会受到如高温、干旱、寒冷和高盐等非生物胁迫,而植物通过调节一系列功能基因和调控基因的表达来抵御外界的各种非生物胁迫[4]。AP2/EREBP,WRKY,bZIP,MYB和NAC等类型的转录因子(TF)作为重要的调控基因通过参与信号转导或调节下游基因的表达来参与植物逆境胁迫反应调控[5-6]。其中,NAC转录因子作为近10年新发现的最大的一类植物特有的转录因子,其调控方式包括转录调控、转录后调控和翻译后调控[7-12]。根据生物信息学对全基因转录组分析,预测有20%~25%的NAC基因对至少一种或几种胁迫有响应[13-14]。大量关于NAC基因参与非生物胁迫应答的研究相继被报道,如通过对中国白菜(Brassicarapapekinensis)基因组分析,部分BrNACs基因响应低温、ABA、GA和PEG等非生物胁迫,基因表达为上调[15];从柚(Citrusmaxima)、枳(Poncirustrifoliata)和柠檬(C.limon)分离出的CmNAC83、PtNAC83和ClNAC83基因响应ABA、干旱、低温和高盐胁迫,且在不同的柑橘种类中存在表达差异[16];从紫花苜蓿(Medicagosativa)中克隆的MsNAC1和MsNAC2基因响应盐、寒冷和干旱等非生物胁迫[17-18];从小麦(Triticumaestivum)中克隆的的TaNAC4基因响应高盐和低温胁迫[19];从大豆中鉴定出了第一个类似ATAF1的NAC转录因子GmNAC2,作为负调控因子在烟草中过量表达能够降低非生物胁迫的耐受性[20];胡杨(Populuseuphratica)中PeNAC1基因强烈响应干旱和盐胁迫,脱落酸(ABA)处理只是轻微诱导PeNAC1基因的表达[21];从盐生植物辽宁碱蓬(Suaedaliaotungensis)克隆的SlNAC1基因在拟南芥中过量表达能够提高抗旱、抗寒和耐盐的能力[22];从鹰嘴豆(Cicerarietinum)中克隆的CarNAC4基因在拟南芥中过量表达提高抗旱和耐盐能力,同时提高了胁迫应答基因的表达如RD29A、ERD10、COR15A、COR47、KIN1和DREB2A的表达量[23];从大麦(Hordeumvulgare)和高粱(Sorghumbicolor)的克隆的HvSNAC1和SbSNAC1基因均有提高转基因植物抗旱性的能力[24-25]。随着更多的NAC转录因子被发现及被证明参与植物非生物胁迫应答,将有助于更深入的揭示植物非生物应答的分子机制,也有助于培育更多具有较强抗性的新品种。
本研究从细叶百合cDNA文库[26]筛选出NAC转录因子家族中表达量高,开放阅读框完整且具有保守结构域的基因进行克隆,得到1个新的NAC家族基因LpNAC13,通过对其进行生物信息学分析,并使用实时定量PCR技术对其在低温、高盐、干旱逆境胁迫和ABA处理下的时空表达模式做出初步分析,以期为细叶百合抗逆分子育种提供候选基因资源和理论依据。
1 材料与方法
1.1 材料及处理
选自东北林业大学苗圃单头没有害虫或疾病的细叶百合鳞茎,用多菌灵处理约30 min,经洗涤和干燥后,以蒸汽灭菌的湿珍珠岩作为储存介质,放入4 ℃的冰箱中解除休眠后,进行总RNA提取。利用细叶百合鳞茎在诱导培养基(MS+6-BA1.5 mg·L-1+NAA0.5 mg·L-1)培养30 d获得再生芽后,转移到继代培养基(MS+6-BA1.0 mg·L-1+NAA0.2 mg·L-1)上继续培养,培养条件(16 h光照,8 h黑暗;75%~80%相对湿度;25 ℃)。当苗高达5 cm左右时,采用水培的方式预培养7 d,然后分别移到200 mM NaCl(盐胁迫),20% PEG 6000(干旱胁迫),150 μM ABA和2 ℃(低温胁迫)溶液中,均以室温(25 ℃)不加处理的液体培养细叶百合幼苗作对照,分别在处理后0、1、3、6、12、24和48 h取其根、鳞茎和叶片,液氮速冻,置于-80 ℃超低温冰箱储存备用。每3株细叶百合幼苗为一组,每组进行3次生物学重复。
1.2 cDNA合成
根据PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书(TaKaRa)将解除休眠的细叶百合鳞茎总RNA反转录成第一条链cDNA,用于基因克隆试验;根据Rever Tra Ace qPCR RT Kit Realtime说明书(TOYOBO)将细叶百合各胁迫处理的3个组织部位的总RNA反转录为cDNA。
1.3 LpNAC13基因克隆
根据细叶百合转录组数据集中LpNAC13的cDNA序列用Premier 5设计特异性上下游引物(表1)。以反转录得到的cDNA为模板进行PCR扩增,扩增程序如下:94 ℃预变性2 min,94 ℃变性30 s,65~55 ℃退火30 s,68 ℃延伸1 min,循环35次,72 ℃最终延伸10 min,4 ℃保存。对反应产物1%琼脂糖凝胶电泳后回收目的片段,与pMD-18T载体过夜连接[27],并将连接产物转化大肠杆菌DH5α,并挑取单菌落PCR验证后过夜摇菌,将检测到含有目的基因的菌液送测序。

表1 克隆及定量分析引物
1.4 LpNAC13基因的生物信息学分析
利用NCBI、ExPASy、Protscale、TMPred、WOLFPSORT、SignalP、SOPMA2.0、SWISS-MODEL、NetGlycate1.0、PlantTFDB等生物信息网站,以及DNAMAN、MEGA6.0等生物信息软件对获得的细叶百合LpNAC13基因的全长cDNA序列及所编码的氨基酸序列进行分子特征、理化性质、同源性和系统进化等一系列分析预测。
1.5 细叶百合LpNAC13时空表达特性
以百合LilyActin基因[28](GenBank登录号:JX826390)为内参基因,在线引物设计软件premier3input设计特异性引物(表1),以提取细叶百合幼苗叶片、鳞茎和根总RNA反转录的cDNA为模板,实时荧光定量PCR分析ABA、干旱、低温和盐胁迫下LpNAC13基因在不同组织中的表达情况。反应体系为:2×SYBR Green Real-Time PCR master Mix 10 μL,cDNA 1 μL,Primer-F 0.5 μL,Primer-R 0.5 μL,ddH2O 8 μL,共20 μL。采用SYBR Green在Poche Light Cycler96进行行如下反应程序:初始变性:95 ℃、30 s;3步法:95 ℃、5 s,58 ℃、15 s,72 ℃、10 s共45个循环;溶解:95 ℃、10 s,60 ℃、60 s,97 ℃、1 s;冷却:37 ℃、60 s。每处理样品设3个生物学重复。利用2-ΔΔCt方法进行数据分析,计算相对表达量[26]。
1.6 数据处理
试验数据采用SPSS19.0进行方差分析,利用SigmaPlot 12.5进行绘图处理。
2 结果与分析
2.1 细叶百合LpNAC13基因的克隆
以细叶百合鳞茎cDNA为模板进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,检测得到单一、特异的扩增带,片段大小约为600 bp(图1)。经过胶回收纯化连接pMD-18T载体,转化涂板,挑取单菌落进行菌液PCR检测,得到阳性克隆菌(图2)。测序结果显示LpNAC13开放阅读框长是627 bp,可以编码208个氨基酸,与转录组数据对比完全符合。
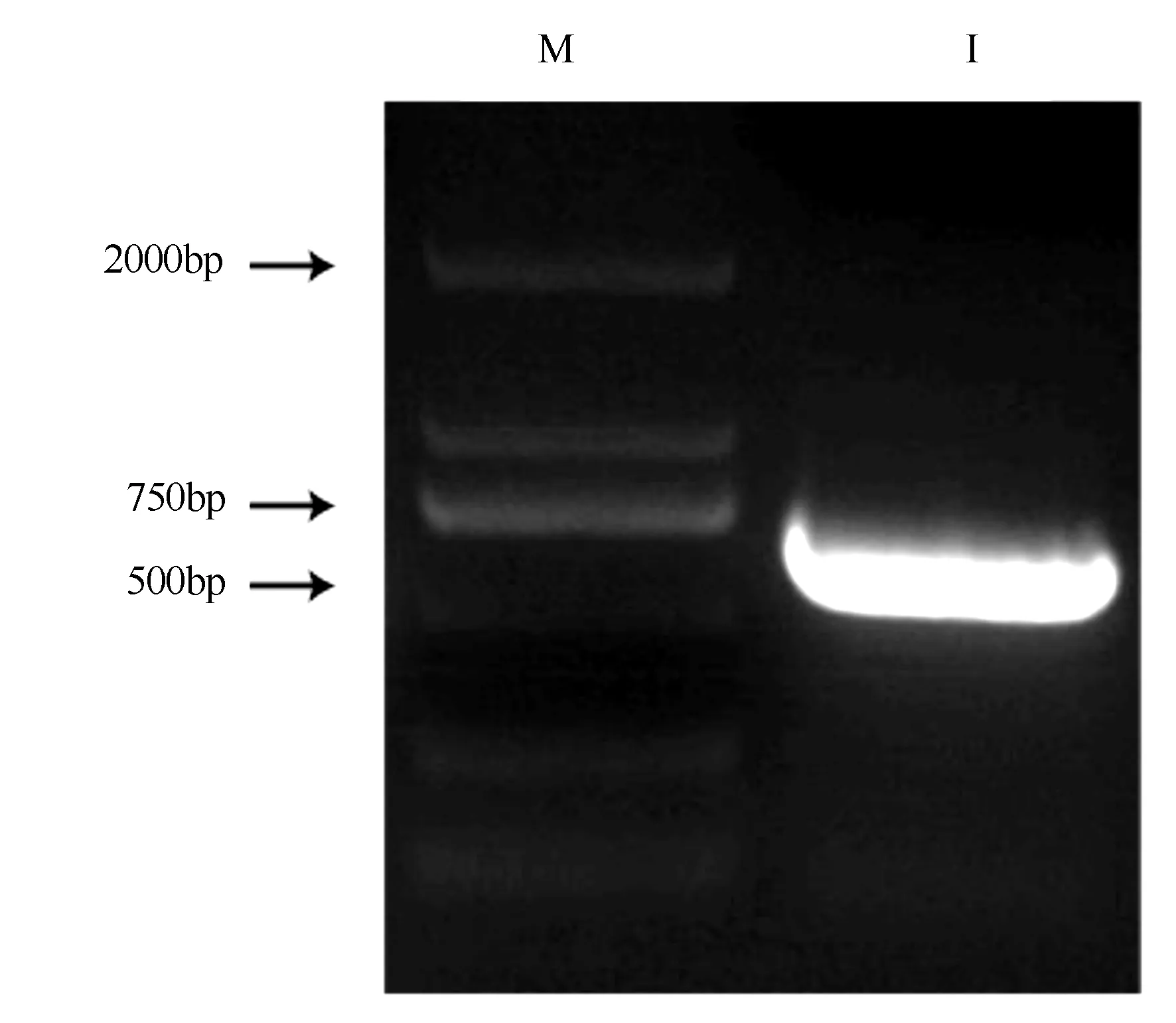
M为DL2000;1为LpNAC13基因扩增产物。
2.2 细叶百合LpNAC13基因序列生物信息学分析
测序结果显示LpNAC13基因大小为627 bp,提交GenBank得到登录号为MF398204。利用NCBI中ORF Finder进行分析,结果表明627 bp序列均为完整的ORF,推测编码208个氨基酸。Conserved Domains保守区预测结果表明LpNAC13基因在16~127氨基酸处存在一个高度保守的NAM域,属于NAC基因家族(图3)。
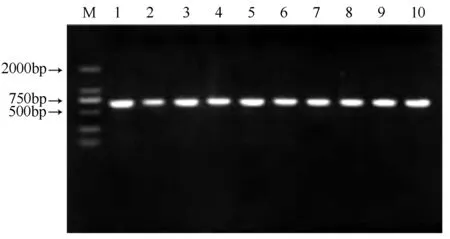
M为DL 2000;1-10为LpNAC13菌落PCR产物。
利用Protparam生物信息学工具对LpNAC13基因编码氨基酸序列进行理化性质分析,结果显示:LpNAC13基因编码208个氨基酸,分子量23.425 kDa,理论等电点为9.58,分子式为C1022H1641N309O305S9,不稳定系数45.55,该蛋白为不稳定蛋白(不稳定系数<40时,预测蛋白质为稳定蛋白,反之不稳定);脂肪簇氨基酸指数76.92;亲水性平均系数为-0.523,推测该基因所编码的蛋白为亲水性蛋白(亲水指数正值代表疏水,负值代表亲水);正负电荷残基总数分别为34和24,表示其在中性环境中带正电荷,其中精氨酸含量最高,占10.6%,其次为丝氨酸9.1%和亮胺酸8.2%。

图3 LpNAC13的保守结构域预测
利用Protscale预测LpNAC13基因编码蛋白亲/疏水性(图4),显示其在第134位氨基酸残基处具有最强亲水性,最低值为-2.533,在46位氨基酸残基处具有最强疏水性,最高值为1.667,位于亲水区的蛋白占绝大多数,表明LpNAC13蛋白为亲水蛋白,与其预测为亲水蛋白相吻合。
利用TMPred对LpNAC13编码蛋白的跨膜结构进行预测分析,该蛋白肽链位于膜外,推测其可能没有跨膜结构域,属于非跨膜蛋白。利用WOLF PSORT对LpNAC13编码蛋白亚细胞定位预测分析,预测显示LpNAC13位于细胞核可能性为28.57%,位于线粒体可能性为28.57%,叶绿体21.43%,液泡14.29%,推测LpNAC13蛋白可能定位在细胞核或线粒体中,具体位置有待后续试验进一步证明。利用SignalP预测LpNAC13蛋白不含有信号肽,为非分泌性蛋白。
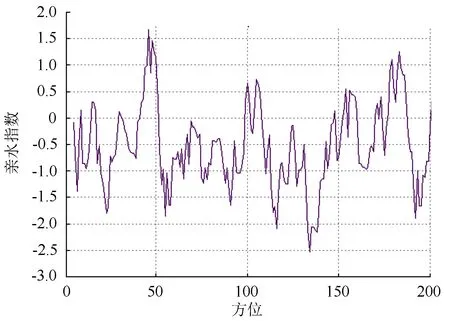
图4 LpNAC13亲/疏水性预测
利用SOPMA2.0对LpNAC13蛋白质的二级结构进行预测,结果表明(图5),LpNAC13蛋白由29.81%的α螺旋、16.83%的延伸链、6.25%的β转角以及47.12%的无规则卷曲等二级结构构成。
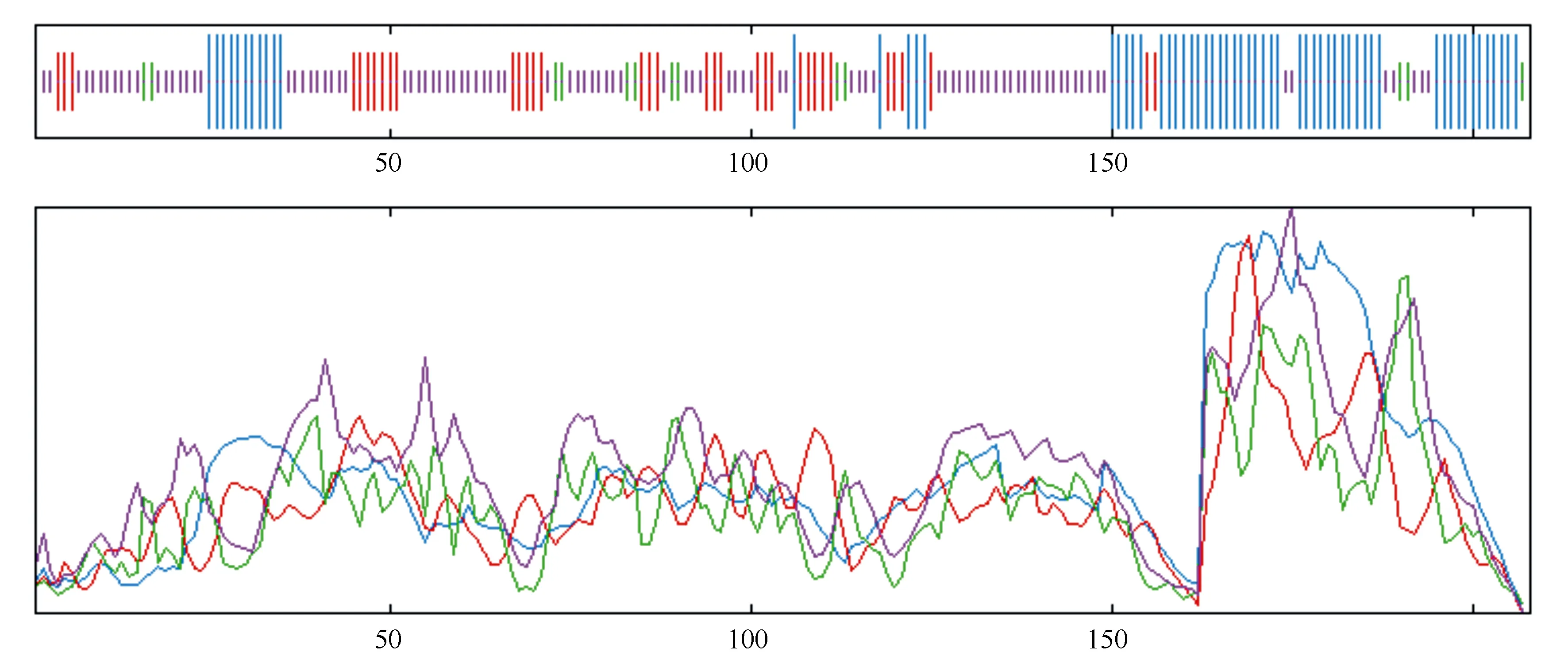
蓝色为α-螺旋;红色为延伸链;绿色为β-转角;紫色为无规则卷曲。
蛋白质的三级结构是在二级结构基础上进一步缠绕和折叠,三级结构与蛋白质功能密切相关。利用SWISS-MODEL在线同源建模法对预测的LpNAC13蛋白进行三维同源建模分析,预测以同型二聚体形式存在(图6)。
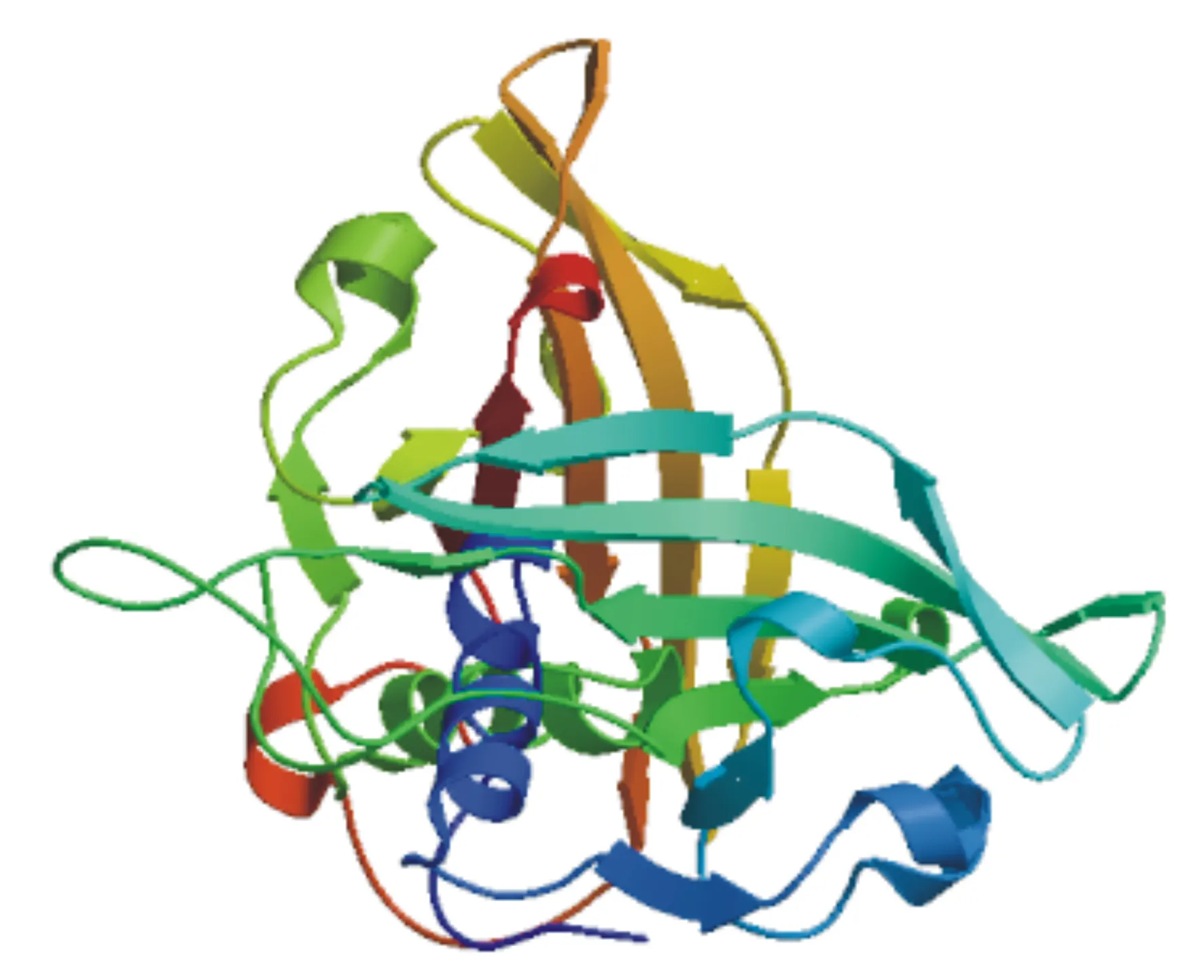
图6 LpNAC13蛋白三维结构预测模型
利用NetGlycate1.0和NetPhos2.0预测LpNAC13蛋白的糖基化位点和磷酸化位点,结果显示LpNAC13有5个糖基化位点,分别位于36、40、88、106和142氨基酸残基处,预测磷酸化位点共有18个,包括丝氨酸位点11个,苏氨酸位点6个和酪氨酸位点1个。
利用PlantTFDB数据库进一步预测LpNAC13转录因子的功能,结果显示LpNAC13的最佳匹配基因是拟南芥ANAC083,也称为ANAC083/VNI2[29],在发育中参与盐胁迫响应、脱落酸响应、木质部发育、叶片衰老、抗病毒、转录负调控,DNA模板化等进程,预测LpNAC13可能在细叶百合生长发育中参与上述活动进程。
在NCBI上通过BLASTp对LpNAC13编码蛋白与其它已知植物中NAC结构域蛋白进行同源性分析,发现LpNAC13序列与海枣(Phoenixdactylifera)的NAC蛋白具有最高同源性,同源性达到56.32%,与油棕(Elaeisguineensis)、石榴(Punicagranatum)、软枣猕猴桃(Actinidiaarguta)、川桑(Morusnotabilis)、亚洲棉(Gossypiumarboreum)、葡萄(Vitisvinifera)、荷花(Nelumbonucifera)NAC蛋白也具有较高的同源性,分别达到55.81%、53.53%、53.22%、53.18%、52.91%、52.63%和52.57%,并将LpNAC13推测的氨基酸序列与这些物种的NAC蛋白进行多序列比对,一致性达到53.43%(图7)。证明克隆出的1个基因属于植物NAC转录因子家族。
为了进一步揭示细叶百合LpNAC13蛋白的进化关系,利用MEGA6软件的邻接法将LpNAC13蛋白质序列与从拟南芥基因组TAIR中下载的15个拟南芥NAC蛋白质序列一起进行系统发育分析,结果表明LpNAC13与NAC083在同一枝进化树上(图8);参照Ooka等[30]对NAC类转录因子的分类方法将这些基因分为ANAC011、NAM、SENU5、ANAC001、ONAC003等5个亚族,分析结果显示LpNAC13与拟南芥NAC083在同一枝进化树上,亲缘关系较近,可能属于SENU5亚族。
2.3 在非生物胁迫下LpNAC13基因表达
对细叶百合幼苗进行ABA、干旱、低温和盐胁迫处理,实时荧光定量PCR分析LpNAC13基因在根、鳞茎和叶片组织中不同时间的表达水平,结果表明(表2~表5),在150 μMol ABA、20% PEG 6000、2 ℃低温与200 mM NaCl逆境胁迫诱导下,LpNAC13在根、茎和叶中均有表达。
ABA诱导下(表2):在根中,LpNAC13的相对表达量在前6 h急剧上升且在6 h达到最大值,为对照的12.21倍,可见ABA可以诱导LpNAC13在根中迅速表达,12 h后,LpNAC13的相对表达量均低于对照组,整体变化幅度很大,整体呈先急剧升高后快速下降的趋势;鳞茎中:LpNAC13的相对表达量在前12 h均低于对照组,而从24 h开始高于对照且在48 h时上升达到最大值,为对照的11.70倍,LpNAC13表达量变化幅度较大,可见ABA诱导LpNAC13在鳞茎中的大量表达需要一定的时间;在叶片中,LpNAC13表达量在48 h内均高于对照,整体呈上调趋势,24 h时,表达量急剧上升达到最大值,为对照的8.85倍。

XP_008813225.1为海枣,XP_010907664.1为油棕,OWM89804.1为石榴,AID55351.1为软枣猕猴桃,XP_010090688.1为川桑,XP_017612730.1为亚洲棉,RVW31991.1为葡萄,XP_010249131.1为荷花。A、B、C、D、E下划线部分分别代表NAC结构域中5个保守的亚结构域。
图7 细叶百合LpNAC13基因编码的氨基酸序列与其他物种氨基酸序列多重比对
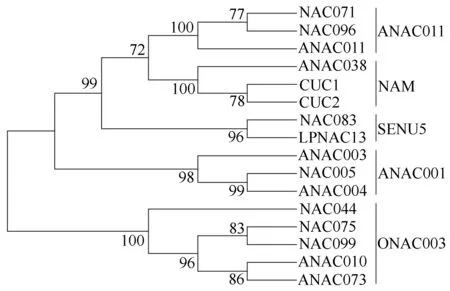
NAC075为AT4G29230.1,NAC099为AT5G56620.1,ANAC010为AT1G28470.1,ANAC073为AT4G28500.1,NAC044为AT3G01600.1,NAC005为AT1G02250.1,ANAC003为AT1G02220.1,ANAC004为AT1G02230.1,NAC083为AT5G13180.1,NAC071为AT4G17980.1,CUC1为AT3G15170.1,CUC2为AT5G53950.1,NAC096为AT5G46590.1,ANAC011为AT1G32510.1,ANAC038为AT2G24430.1。
图8 细叶百合LpNAC13蛋白氨基酸序列与拟南芥氨基酸序列的系统进化树分析
表2 ABA胁迫处理下细叶百合LpNAC13在其根、鳞茎和叶片中的相对表达水平
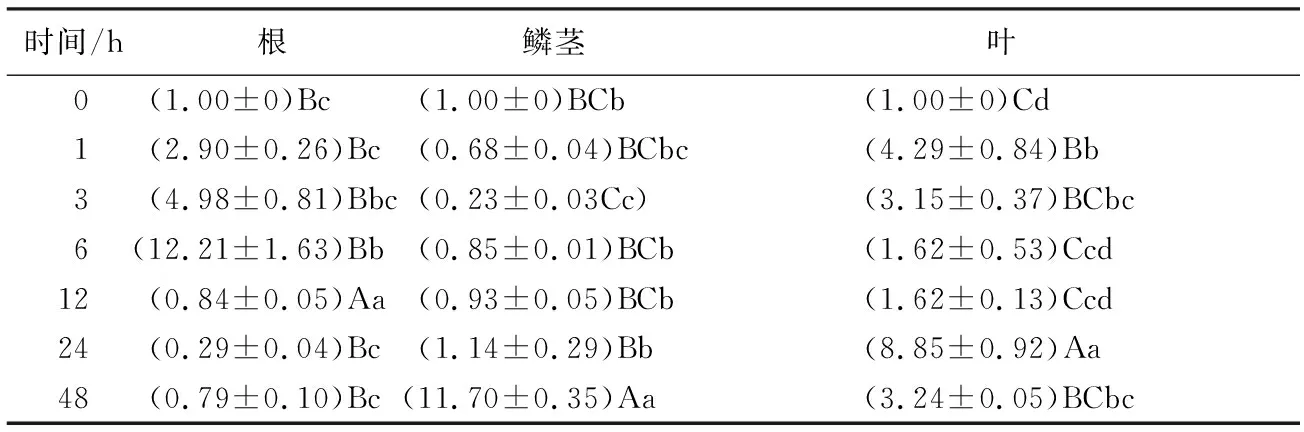
时间/h根鳞茎叶0(1.00±0)Bc (1.00±0)BCb (1.00±0)Cd 1(2.90±0.26)Bc(0.68±0.04)BCbc(4.29±0.84)Bb3(4.98±0.81)Bbc(0.23±0.03Cc)(3.15±0.37)BCbc6(12.21±1.63)Bb(0.85±0.01)BCb(1.62±0.53)Ccd12(0.84±0.05)Aa(0.93±0.05)BCb(1.62±0.13)Ccd24(0.29±0.04)Bc(1.14±0.29)Bb(8.85±0.92)Aa48(0.79±0.10)Bc(11.70±0.35)Aa(3.24±0.05)BCbc
注:表中数据为平均值±标准差;同列不同小写字母表示不同处理在P<0.05水平上差异显著;同列不同大写字母表示不同处理在P<0.01水平上差异极显著。
PEG诱导下(表3):在根中,LpNAC13的相对表达量在3 h到最大值,为对照的1.13倍,6 h后,LpNAC13的相对表达量均低于对照组,表达量变化幅度相对平稳;鳞茎中:LpNAC13表达量在48 h内均高于对照,整体呈上调趋势,且在3 h时表达量急剧上升达到最大值,为对照的44.69倍,可见,在鳞茎中LpNAC13对干旱胁迫非常敏感,可诱导LpNAC13的大量表达;在叶片中:LpNAC13表达量在前24 h内均高于对照,在48 h趋于对照,整体呈上调趋势,且在1 h时表达量急剧上升达到最大值,为对照的5.56倍,可见PEG可以诱导LpNAC13在叶片中迅速表达。
2 ℃低温诱导下(表4):根中,LpNAC13的相对表达量在前6 h均高于对照组,且在6 h时上升达到最大值,为对照的12.27倍,从12 h开始,表达量开始迅速下降,均低于对照组,整体变化幅度很大;鳞茎和叶片中:LpNAC13相对表达量在48 h内均低于对照,整体呈下调趋势,可以看出,LpNAC13对冷胁迫不太敏感。
表3 PEG胁迫处理下细叶百合LpNAC13在其根、鳞茎和叶片中的相对表达水平

时间/h根鳞茎叶0(1.00±0)Aa (1.00±0)Cc (1.00±0)Bc 1(1.10±0.17)Aa(10.37±2.36)BCbc(5.56±0.63)Aa3(1.13±0.13)Aa(44.69±4.96)Aa(2.88±0.50)ABbc6(0.82±0.09)Aa(7.10±1.20)BCc(1.05±0.15)Bc12(0.82±0.09)Aa(11.02±2.10)BCbc(1.57±0.29)Bbc24(0.36±0.06)Aa(26.16±1.68)ABb(3.42±0.76)ABb48(0.43±0.19)Aa(17.01±3.58)BCbc(0.99±0.16)Bc
注:表中数据为平均值±标准差;同列不同小写字母表示不同处理在P<0.05水平上差异显著;同列不同大写字母表示不同处理在P<0.01水平上差异极显著。
表4 低温胁迫处理下细叶百合LpNAC13在其根、鳞茎和叶片中的相对表达水平

时间/h根鳞茎叶0(1.00±0)Bbc (1.00±0)Aa (1.00±0)Aa 1(1.55±0.13)Bbc(0.48±0.02)Bb(0.05±0.01)CDd3(3.10±1.22)Bb(0.32±0.08)BCDcd(0.16±0.02)Bb6(12.27±1.87)Aa(0.25±0.05)CDd(0.09±0.02)Cc12(0.07±0.01)Bc(0.33±0.02)BCDcd(0.02±0.01)Dd24(0.06±0.01)Bc(0.20±0.04)Dd(0.04±0.01)Dd48(0.29±0.02)Bc(0.44±0.05)BCbc(0.03±0)Dd
注:表中数据为平均值±标准差;同列不同小写字母表示不同处理在P<0.05水平上差异显著;同列不同大写字母表示不同处理在P<0.01水平上差异极显著。
NaCl诱导下:根中,LpNAC13相对表达量在48 h内均高于对照,整体呈上调趋势,且在6 h时达到最大值,为对照的15.78倍;鳞茎中:LpNAC13相对表达量在前3 h缓慢上升,6 h开始迅速下降,24 h又开始迅速上升,且在48 h达到最大值,为对照组的25.69倍,整体变化幅度非常大,对盐胁迫极其敏感;在叶片中,LpNAC13相对表达量在48 h内均高于对照,整体呈上调趋势,且在在48 h时达到最大值,为对照组的7.06倍。
表5 NaCl胁迫处理下细叶百合LpNAC13在其根、鳞茎和叶片中的相对表达水平
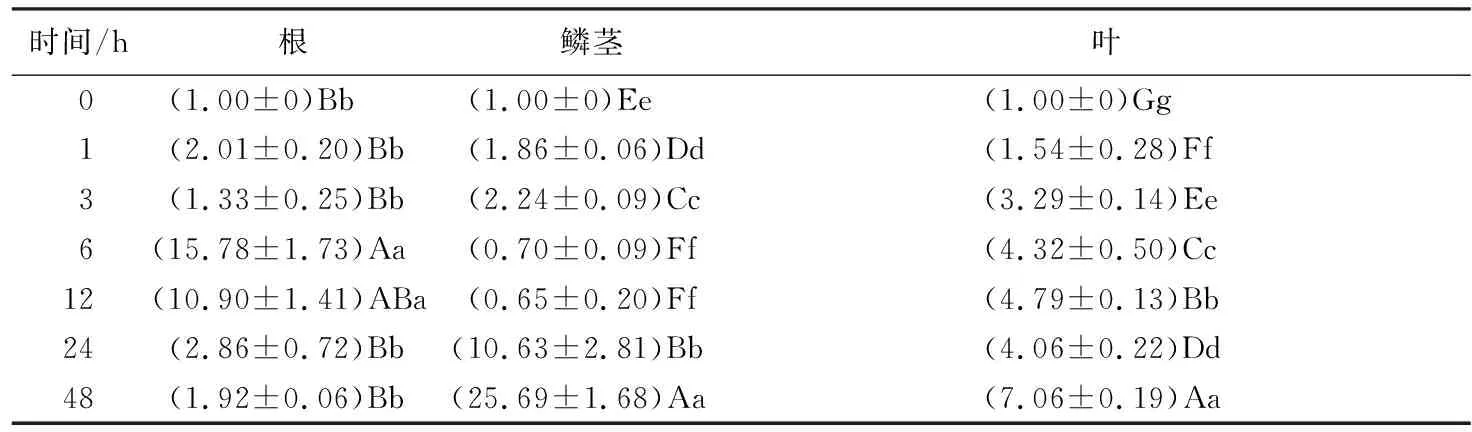
时间/h根鳞茎叶0(1.00±0)Bb (1.00±0)Ee (1.00±0)Gg 1(2.01±0.20)Bb(1.86±0.06)Dd(1.54±0.28)Ff3(1.33±0.25)Bb(2.24±0.09)Cc(3.29±0.14)Ee6(15.78±1.73)Aa(0.70±0.09)Ff(4.32±0.50)Cc12(10.90±1.41)ABa(0.65±0.20)Ff(4.79±0.13)Bb24(2.86±0.72)Bb(10.63±2.81)Bb(4.06±0.22)Dd48(1.92±0.06)Bb(25.69±1.68)Aa(7.06±0.19)Aa
注:表中数据为平均值±标准差;同列不同小写字母表示不同处理在P<0.05水平上差异显著;同列不同大写字母表示不同处理在P<0.01水平上差异极显著。
总之,经ABA、干旱、低温和高盐处理后,LpNAC13表达量在根,鳞茎,叶片均发生改变,初步证实LpNAC13是可被逆境胁迫诱导表达的转录因子,且在不同植物组织发育过程中所起作用存在一定差异。
3 讨论与结论
NAC蛋白作为植物特有的一类转录因子,其N末端是由约150个氨基酸残基组成的保守DNA结合结构域,被分为5个亚结构域(A~E)[31],而其C末端是转录激活区域,可以决定NAC蛋白的不同功能[32]。本研究从细叶百合克隆得到1个新的基因LpNAC13,其N末端存在一个高度保守的NAM域,由此推断LpNAC13属于NAC转录因子家族的新成员。
已有研究表明同一亚类基因大都具有功能相似的特点,从系统进化树可以看出细叶百合LpNAC13转录因子与拟南芥NAC083在同一枝进化树上,亲缘关系较近,可能属于SENU5亚类,而SENU5亚类中的大多数NAC基因都与植物响应环境胁迫有关[32];相关研究表明,NAC083作为ABA应答转录因子通过调控COR/RD基因以延缓叶片衰老来提高耐盐性。而COR15A/B和RD29A/B基因作为公认的参与非生物胁迫反应的标记基因,其启动子中具有如对干旱、高盐和渗透胁迫等多种应激信号反应的顺式作用元件,可以被NAC083转录因子通过直接结合其启动子来调节[29,33-35]。因此,推测LpNAC13很可能参与细叶百合中高盐等逆境胁迫调控。为了进一步证明上述推测,对细叶百合进行非生物胁迫处理,通过实时定量PCR技术分析发现LpNAC13在ABA、PEG、2 ℃低温与NaCl胁迫诱导下,其表达模式不尽相同且具有时空和组织表达特异性,表明LpNAC13具有参与调控细叶百合应答上述四种非生物胁迫的作用,且在细叶百合的根、鳞茎和叶片中的应答胁迫分子机制可能存在差异。这类似于其他抗逆境胁迫相关NAC基因在逆境胁迫中的表达模式不尽相同且具有时空和组织表达特异性。如,甜橙(Citrussinensis)CsNAC1能响应低温、高盐和ABA胁迫,其中,在ABA诱导时,CsNAC1表达量变化趋势没有明显规律,而在低温、高盐胁迫时表达量整体呈逐渐上升趋势且在叶中较为优先表达[36];茄子(Solanummelongena)SmNAC1在受到低温和高盐诱导后表达上调,且在根中优先表达[37];毛白杨(Populustrichocarpa)PtoNAC157在受到低温、高盐、干旱和ABA胁迫后,在幼根、茎和叶中均有表达,且在茎中的表达量最高[38];紫花苜蓿MsNAC2在ABA、干旱、低温和高盐胁迫诱导下显著升高,并且MsNAC2在根中的表达量要明显高于在叶中的表达量[18];小黑杨(Populussimonii×P.nigra)NAC7在盐胁迫诱导下主要在根中表达,而在茎和叶中的表达却很少[39]。由此表明LpNAC13可能同上述逆境响应调控基因一样,参与逆境响应,为后续深入研究细叶百合分子育种提供有效的依据。

