心耳起源的房性心动过速性心肌病相关病例分析
刘文秀 苏畅 齐书英 李洁
心动过速性心肌病(tachycardia-induced cardiomyopathy,TIC)为各种长期心动过速或反复发作的快速型心律失常引起心脏扩大,进而导致心力衰竭的一类特殊类型的心肌病。TIC可以由病理性的室上性或室性心律失常所致,也可见于生理性的快速性心律失常,恢复窦性心律或者控制心室率后心衰可完全或部分逆转。TIC可以继发于房性心动过速(房速),而左心耳和右心耳起源的局灶性房速少见,仅占所有局灶房速的3%和0.6%~8%[1]。本文报道4例心耳房速引起的心动过速性心肌病病例。
病例1:患者男,20岁,因心悸1年入院。既往无特殊病史,抗心律失常药物效果不佳。门诊心电图提示房性心动过速(图1),查动态心电图示全天为房速心律,最快心率158次/min,最慢81次/min,平均118次/min。心脏超声提示左房前后径37 mm,左室舒张末期前后径61 mm,右房左右径35 mm,左室射血分数44%。体格检查:脉搏120次/min,呼吸22次/min,心界向左下扩大,心音低钝,余查体未见明显异常。于2014年1月9日在CARTO 三维标测系统指导下行心内电生理检查,三维标测显示房速起源于左心耳尖部前缘,以Lasso电极支撑左心耳、冷盐水灌注消融导管消融(40~50 W,43~45 ℃),消融中房速终止。此后患者未诉心悸。5个月后复查心脏超声示左房前后径34 mm,左室舒张末期前后径62 mm,右房左右径33 mm,左室射血分数61%。2014年11月患者再次出现心悸,性质同前,心电图仍示房速。心脏超声示左房前后径36 mm,左室舒张末期前后径66 mm,右房左右径33 mm,左室射血分数53%。再次在CARTO指导下行电生理检查,显示房速起源点仍为左心耳尖部,以30~70 W滴定式放电,消融中房速终止。此后患者未诉心悸,术后6个月复查心脏超声示左房前后径32 mm,左室舒张末期前后径56 mm,右房左右径31 mm,左室射血分数63%。电话随访至今,患者未有不适。
病例2:患者男,30岁,因心悸3年入院,既往无特殊病史。入院前1个月心悸加重,伴胸闷气短、咳嗽、水肿,夜间不能平卧。体格检查:端坐位,喘息貌,脉搏112次/min,呼吸24次/min,心界向左下扩大,律齐,P2亢进,可闻及S3奔马律,肝肋下可触及,双下肢中度水肿,余查体未见明显异常。心电图示房速(图1);胸片示心影增大;心脏超声示左房前后径48 mm,左室舒张末期前后径76 mm,右房左右径45 mm,左室射血分数23%,二尖瓣相对关闭不全,少量心包积液。诊断为心肌病、房速。给予纠正心衰等治疗后症状缓解。动态心电图示全天房速,最大心室率192次/min,平均124次/min,不排除心动过速性心肌病。于2012年4月9日在CARTO三维标测系统指导下行心内电生理检查,三维标测提示房速起源于右心耳根部,以压力盐水灌注消融导管在靶点反复多次消融房速不能终止,S1S1快速刺激亦不能终止,故建议患者择期行外科右心耳切除术。外科考虑因患者心功能差,麻醉风险大不宜手术,故给予药物治疗后出院。房速终止时间不详。术后6个月随访心电图为窦律。心脏超声左房前后径32 mm,左室舒张末期前后径55 mm,右房左右径36 mm,左室射血分数59%。2013年3月再次因心悸入院,心电图示房速,考虑为复发。心脏超声示左房前后径32 mm,左室舒张末期前后径50 mm,右房左右径39 mm,左室射血分数60%。于2013年3月9日再次行射频消融术,靶点仍为右心耳根部,消融中房速终止。术后3个月心脏超声正常。但患者于2013年11月体检时再次发现心电图异常;心脏超声提示左房前后径33 mm,左室舒张末期前后径49 mm,右房左右径37 mm,左室射血分数63%。于2013年11月17日再次行心内电生理检查,示心动过速为房速2 ∶1下传,标测靶点仍为右心耳根部,给予反复片状消融,房速不能终止;电复律转复窦律难以维持,遂终止手术。给予口服药物治疗并出院。出院后患者未再诉心悸,2015年5月复查心脏超声提示左房前后径37 mm,左室舒张末期前后径53 mm,右房左右径36 mm,左室射血分数54%。电话随访至今未有不适。
病例3:患者女,29岁,因心悸2年,加重伴气短2周入院。入院2年前发作1次心动过速,数小时自行终止;入院前2周心悸再发,症状持续,并出现胸闷、气短。既往体健。试管婴儿成功怀孕11周。体格检查:喘息貌,心率167次/min,律齐,余查体未见明显异常。心电图示房速150次/min(图1);心脏超声示左房前后径42 mm,左室舒张末期前后径55 mm,左室射血分数48%。N-端脑利钠肽前体(NT-proBNP)4285 pg/mL。在CartoSound三维标测系统指导下行房间隔穿刺和心内电生理检查,标测提示起源于左心耳尖部,以压力盐水灌注消融导管进行消融,放电过程中房速终止,实现零射线消融。术后1个月、3个月复查心电图均为窦律。2016年9月20日剖宫产一健康男婴,术中及术后患者均为窦律,心率70~80次/min。术后6个月动态心电图示窦律,全天房早37次,短阵房速5阵(占全天心搏数的0.06%);查心脏超声示左房前后径31 mm,左室舒张末期前后径44 mm,左室射血分数58%。未再出现心悸症状。
病例4:患者女,18岁,因间断心悸4年,再发1 d入院。4年前发作心悸,外院查心脏超声示左房前后径22 mm,左室舒张末期前后径43 mm,右房左右径27 mm,左室射血分数62%。动态心电图示全天房速,具体治疗不详。入院前1 d再发心悸,外院心电图示房速1 ∶1下传,心室率176次/min(图1),药物治疗后心室率减慢,但房速不能终止,给予电复律转窦律。入科心电图提示房速文氏下传,心室率约84次/min。心脏超声提示左房前后径30 mm,左室舒张末期前后径45 mm,右房左右径30 mm,左室射血分数56%。药物转复失败,于2019年1月22日在CARTO三维标测系统指导下行心内电生理检查,显示房速起源于右心耳前壁,以压力盐水灌注消融导管进行消融,放电过程中房速终止,转为窦律。术后6个月随访心电图为窦律。心脏超声示左房前后径23 mm,左室舒张末期前后径41 mm,右房左右径26 mm,左室射血分数64%。2019年10月患者再次发作心悸,查心电图仍示房速,心室率约100次/min。心脏超声左室射血分数55%。2019年10月31日于我院心外科行小切口右心耳切除术。切除右心耳即刻心动过速终止。术后病理提示局灶性心肌纤维退化(图2)。术后7 d复查动态心电图全天为窦律,平均心率69次/min。电话随访至今无不适。
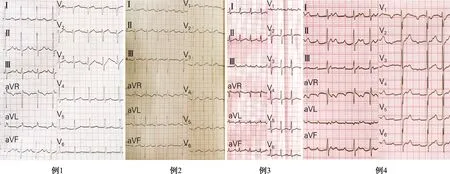
图1 4例患者的心电图
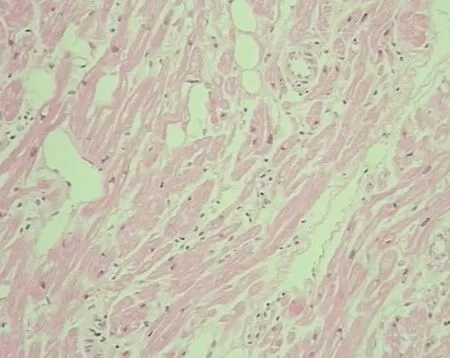
图2 病例4的手术标本病理切片
讨论房速是起源于心房的一种快速性心律失常,包括局灶性房速和大折返性房速,长期发作可引起TIC,它是引起TIC的常见病因之一。约8%~28%的房速可引起心动过速性心肌病[2]。心耳房速较少见[1,3-4],目前仅见病例报道。
心耳为胚胎时期原始心房退化而来,近期研究显示药物治疗抵抗的房颤患者,其左心耳有4种解剖结构:“鸡翅”形最常见(48%),“仙人掌”形(30%),“风向标”形(19%)和“菜花”形(3%)。其中“菜花”形与栓塞事件相关性最高,内部结构复杂,小叶数量多且径轴短,窦道开口形状变异大且缺乏主小叶。右心耳结构相对保守,多为三角形。心耳房速的起源部位多为心耳基底部[5],也包括左心耳中部和远端[3,6]、右心耳尖部[4,7]。还有1例报道起源于左心耳动脉瘤[8]。
心耳房速心电图一般具有特征性P波形态。右心耳房速P波在V1导联主要为负向波,部分有切迹,V2~V6导联逐渐移行为正向;下壁导联多为低振幅正向波;Ⅰ导联可为正向、等电位线;aVR导联可为负向、等电位线;aVL导联P波形态各异[9]。P波形态易受心脏变形、转位等影响,因此,若存在心脏移位或变形时,根据P波判断右心耳房速存在局限性[10]。另外,由于右心耳在解剖上临近三尖瓣上缘及界嵴上部,根据P波形态不足以区分射频消融术中的靶点[9]。
左心耳房速P波在V1导联主要为正向波,部分为正负双向,V2~V6导联P波为等电位线或低振幅正向;下壁导联多为正向波;Ⅰ、aVL导联多为负向波[11]。
起源于右心耳的房速患者多较年轻,可表现为阵发性或持续性心慌、胸闷、呼吸困难等症状。其中约75%倾向于无休止性发作。因为其更倾向于无休止发作[12],约50%左右引发心动过速性心肌病[7]。起源于更为少见的左心耳房速,也有类似的临床特点[5-6]。本文中4例患者均有无休止性发作的特点,前3例患者已形成心动过速性心肌病。第4例患者复发时间虽短,但与4年前的心脏超声比较有心脏扩大的趋势。
TIC的诊断是排除性、回顾性诊断。如果房速频繁发作或者发作呈无休止,同时存在心脏扩大、心衰,当房速得到治疗后,心脏功能恢复,那么支持TIC诊断。
此类患者心动过速易发展成心动过速性心肌病,且有心源性休克和猝死的风险[13],而心衰常随心律失常节律或频率控制而好转[14],因此对这类心律失常患者一旦确诊,应及早干预。应积极根治心律失常,不能根治的,应积极进行频率控制。
通常认为自律性增高是这类心动过速最可能的发生机制[15]。但也有病例报道房速的机制为触发活动和微折返。分子水平的机制可能与持续的心动过速带来的钙稳态失衡、机制重建、纤维化(如本文例4)和神经激素激活有关。在组织学水平上,Mueller等[16]对189例新发的严重心衰患者进行了组织切片检查,其中19例诊断为TIC,发现TIC患者中存在以巨噬细胞主导的心肌炎症反应,心肌细胞和线粒体形态发生了变化。
治疗包括药物治疗和非药物治疗。药物治疗包括β受体阻滞剂、Ⅰc类抗心律失常药(普罗帕酮)、非二氢吡啶类钙拮抗剂、胺碘酮等。非药物治疗包括外科手术和消融手术。通常情况下认为心耳房速需行外科手术切除[17]。因心耳解剖的特殊性,介入行心内膜导管射频消融并发症风险大,成功率低。但新的标测技术的应用更有利于寻找房内最早激动点[6]和折返路径,确定有效靶点,虽仍有复发风险,但大大提高了导管消融治疗心耳房速的成功率。心腔内超声技术(intracardiac echocardiography,ICE)的使用可进一步降低导管操作的风险,提高安全性[18]。马坚教授团队报道的42例心耳房速病例中,30例患者行射频消融术治疗成功,12例患者行外科心耳切除微创手术[1]。介入行心内膜消融术,尤其是行左心耳消融时的并发症包括心脏穿孔、膈神经损伤、心房泵功能的下降和发生血栓事件。冷冻消融技术的应用[19-20]为射频消融困难或失败的患者提供了新的选择。也有报道采用心外膜消融的方法治疗左心耳房速[21]。另外还有使用心外膜消融和微创心耳切除的杂交方法[22]。Atoui等[23]报道1例大折返机制的左心耳房速患者电隔离左心耳后复发,因高血栓和出血风险,使用Lariat 装置套扎左心耳治疗房速成功。Medi等[24]对行导管消融的房速患者平均随访3个月,97%的患者左室功能可恢复正常。本文中4例患者行射频或药物治疗后心衰均有好转,符合既往报道。
总之,心耳房速虽具有特征性的心电图改变,但临床上也容易误诊为窦速或因心脏扩大而误诊为扩张型心肌病,因此应充分认识其心电图改变而及时诊断。射频消融治疗心耳房速的成功率逐渐提高,但部分患者的治疗效果仍不甚满意,因此应根据患者特点采用个体化治疗,以提高综合治愈率。

