清胃泻心汤对急性胃溃疡模型大鼠免疫球蛋白、炎症因子及氧化应激指标的影响∗
宋秀菊 韩 兵 刘春晓 王 莉
(1.湖南中医药大学,湖南 长沙 410000;2.山东省青岛市即墨区中医医院,山东 青岛 266200;3.山东省青岛市海慈医疗集团,山东 青岛 266033)
胃溃疡为常见的消化道疾病,病因十分复杂,与营养不良、应激、创伤、吸烟酗酒、过量服用非甾体消炎药、幽门螺杆菌感染等多种因素有关。发病机制有炎症学说、无酸无溃疡学说、因子失衡学说等[1]。急性胃溃疡易反复发作,引起胃部出血、溃疡穿孔等严重并发症,随着人们生活节奏加快,不良生活习惯增多,其发病率有逐年上升趋势,目前治疗以外科手术和非甾体抗炎药治疗为主,但易导致多种不良反应,疗效欠佳[2]。胃溃疡属中医学“胃脘痛”范畴,其病位在胃,涉及肝脾、外邪、饮食、情志等因素,胃气阻滞,胃失和降而发病,胃火上冲动血,治宜健脾益气、清热燥湿、疏肝和胃[3-4]。清胃泻心汤由黄连、藿香等16味中药组成,为本院治疗胃溃疡的临床协定方,具有较好的临床疗效,但其作用机制尚不明确。本研究通过腹腔注射吲味美辛和水浸拘束法建立急性胃溃疡大鼠模型,旨在观察清胃泻心汤对急性胃溃疡模型大鼠免疫球蛋白、炎症因子及氧化应激指标的影响,并探讨其作用机制。
1 材料与方法
1.1 实验动物 清洁级雄性SD大鼠,体质量(200±20)g,8周龄,北京维通利华实验动物技术有限公司,许可证:SCXK-(京)2012-0001。合格证号:110011191100312。室温饲养,自由饮水,符合《实验动物管理条例》要求。
1.2 实验药物 清胃泻心汤,药物组成:黄连15 g,藿香10 g,半夏10 g,茯苓15 g,茵陈10 g,白及10 g,黄芪15 g,生地黄15 g,牡丹皮10 g,黄芩10 g,大黄10 g,延胡索10 g,木香10 g,薏苡仁15 g,苍术10 g,陈皮10 g。上述中药饮片由青岛市海慈医疗集团中药房提供,药材加水煎煮2次,分别浓缩成1 mL含0.5 g、1 g和1.5 g原药材的药液。吲哚美辛(上海北诺生物科技有限公司,生产批号:20180917);奥美拉唑胶囊(20 mg/粒,海南通用三洋药业有限公司,国药准字H53021955)。
1.3 试剂与仪器 苏木精-伊红染色液(武汉华美生物工程有限公司);免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)试剂盒购于美国B&D公司;白细胞介素-2(IL-2)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)试剂盒购于碧云天生物科技有限公司;过氧化物酶(MPO)、丙二醛(MDA)、超氧化物歧化酶(SOD)购于南京建成生物工程研究所。RM2235型病理切片机,德国莱卡公司;BX60显微镜,日本Olympus Optical公司;LDZ-2型低速离心机(北京京立离心机有限公司);OLYMPUSAU5400全自动生化分析仪,日本奥林巴斯有限公司;ELx800酶标仪,美国伯腾仪器有限公司。
1.4 分组与造模 将60只大鼠随机分为对照组,模型组,清胃泻心汤低、中、高剂量组和阳性组,每组10只。除对照组外,其余各组采用腹腔注射吲哚美辛和水浸拘束法建立急性胃溃疡大鼠模型。具体为腹腔注射吲哚美辛,剂量为20 mg/kg,6 h后将各组大鼠拘束于长×宽×高分别为16 cm×4 cm×4 cm的笼中,浸泡于16~18℃的恒温水中,水面与剑突部齐平,浸泡6 h后,取出松绑。按照Guth标准采用溃疡数评价[5],麻醉后取完整胃组织,结扎贲门幽门制成胃袋并注入10 mL氯化钠溶液,2%的甲醛溶液中固定10 min,沿胃大弯剪开并平展,淤血点为1分,线状淤血长度<1 mm为2分,1~2 mm为3分,3~4 mm为4分,>5 mm为5分,全胃分数的综合得分为该鼠的溃疡数,溃疡数大于20分为造模成功[6]。
1.5 给药方法 于造模后第2日进行干预。对照组和模型组给予0.9%氯化钠溶液灌胃,剂量为5 mL/kg,清胃泻心汤低(0.5 g/mL)、中(1 g/mL)、高剂量(1.5 g/mL)组给予清胃泻心汤灌胃,剂量为5 mL/kg,阳性组给予奥美拉唑灌胃(0.3 mg/mL),剂量为5 mL/kg。连续7 d,每日1次。
1.6 标本采集与检测 1)溃疡指数和溃疡抑制率:给药7 d后,将大鼠处死并立即开腹,结扎幽门、贲门,取出胃,无菌生理盐水将胃内容物冲洗干净,2%的甲醛溶液中固定10 min,观察胃组织的损伤情况,游标卡尺精确测量胃黏膜上每一个损伤的长度,按照Guth标准评价溃疡指数,计算溃疡抑制率[7],溃疡抑制率(%)=(1-给药组溃疡指数/模型组溃疡指数)×100%。2)胃组织病理学观察:给药后第7日,处死各组大鼠,分离实验所需胃组织,4%多聚甲醛固定24 h,自来水冲洗,不同浓度的乙醇脱水,二甲苯透明固定,石蜡包埋,切片,厚度为5 μm,烤片,二甲苯脱蜡,乙醇水化,苏木精染色,1%盐酸乙醇溶液分化,自来水冲洗返蓝,浸入伊红染液,梯度酒精脱水,二甲苯透明,中性树胶进行封片,显微镜下观察。3)免疫球蛋白检测:给药后7 d,处死各组大鼠,心脏取血,不抗凝,3 000 r/min离心10 min,采用全自动生化分析仪免疫比浊法分析血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平。4)炎症因子测定:给药后第7日,处死各组大鼠,心脏取血,离心,取上清,采用酶联免疫吸附法(ELISA)测定各组大鼠血清炎症因子IL-2、IL-6和TNF-α水平。5)氧化应激指标测定:分别于造模后第7日,处死各组大鼠,心脏取血,离心,取上清,采用ELISA测定各组大鼠血清应激指标MPO、MDA、SOD水平,按照试剂盒说明操作。
1.7 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,组间或组内治疗前后采用t检验,(%)表示计数资料,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠溃疡面积、溃疡指数和溃疡抑制率比较 见表1。与对照组比较,模型组溃疡面积和溃疡指数显著升高(P<0.05),清胃泻心汤低、中、高剂量组和阳性组的溃疡面积、溃疡指数显著低于模型组,清胃泻心汤中、高剂量组和阳性组溃疡抑制率显著高于清胃泻心汤低剂量组(P<0.05)。清胃泻心汤中、高剂量组和阳性组溃疡面积、溃疡指数和溃疡抑制率比较差异无统计学意义(P>0.05)。
表1 各组大鼠溃疡面积、溃疡指数和溃疡抑制率比较(±s)
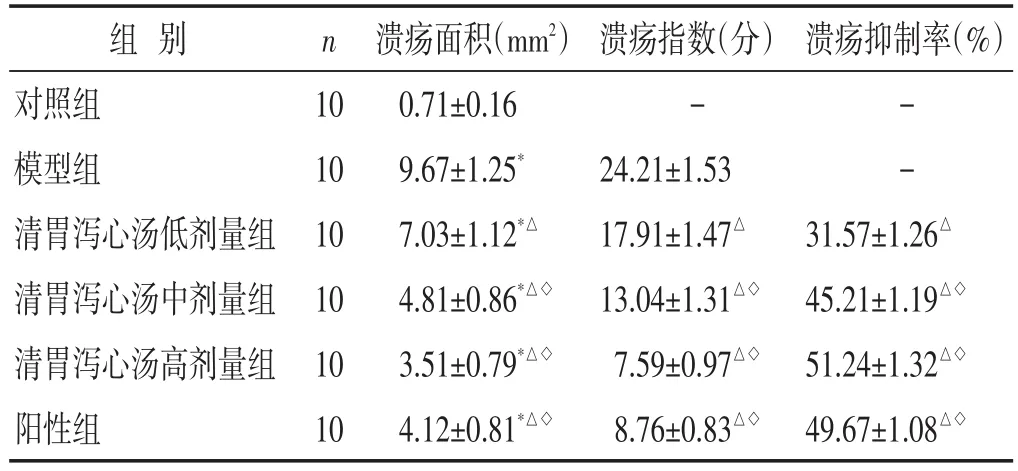
表1 各组大鼠溃疡面积、溃疡指数和溃疡抑制率比较(±s)
与对照组比较,∗P<0.05;与模型组比较,△P<0.05;与清胃泻心汤低剂量组比较,◇P<0.05。下同
组别对照组模型组清胃泻心汤低剂量组清胃泻心汤中剂量组清胃泻心汤高剂量组阳性组n 溃疡抑制率(%)10 10 10 10 10 10溃疡面积(mm2)0.71±0.16 9.67±1.25*7.03±1.12*△4.81±0.86*△◇3.51±0.79*△◇4.12±0.81*△◇溃疡指数(分)-24.21±1.53 17.91±1.47△13.04±1.31△◇7.59±0.97△◇8.76±0.83△◇- -31.57±1.26△45.21±1.19△◇51.24±1.32△◇49.67±1.08△◇
2.2 各组大鼠病理形态学比较 见图1。对照组未见明显的胃组织形态学变化;模型组胃黏膜变薄,上皮细胞出现脱落缺损,黏膜固有腺体排列稀疏紊乱,大量炎性细胞浸润,黏膜层出血,黏膜下层水肿;清胃泻心汤低剂量组胃黏膜变薄,上皮细胞脱落,黏膜固有腺体少量增生,可见炎性细胞浸润;清胃泻心汤中、高剂量组和阳性组胃黏膜变薄,上皮少量缺损、脱落,腺体增生较多,排列较整齐,少量炎性细胞浸润。
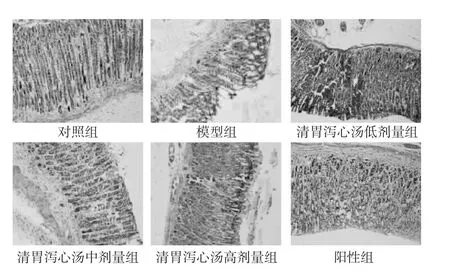
图1 各组大鼠胃组织病理形态学变化(HE染色,100倍)
2.3 各组大鼠免疫球蛋白水平比较 见表2。与对照组比较,模型组血清IgA、IgG、IgM水平显著升高(P<0.05),清胃泻心汤低、中、高剂量组和阳性组血清IgA、IgG、IgM水平均低于模型组,且清胃泻心汤中、高剂量组和阳性组显著低于清胃泻心汤低剂量组(均P<0.05)。清胃泻心汤中、高剂量组和阳性组血清IgA、IgG、IgM水平比较,差异无统计学意义(P>0.05)。
表2 各组大鼠免疫球蛋白水平比较(g/L,±s)
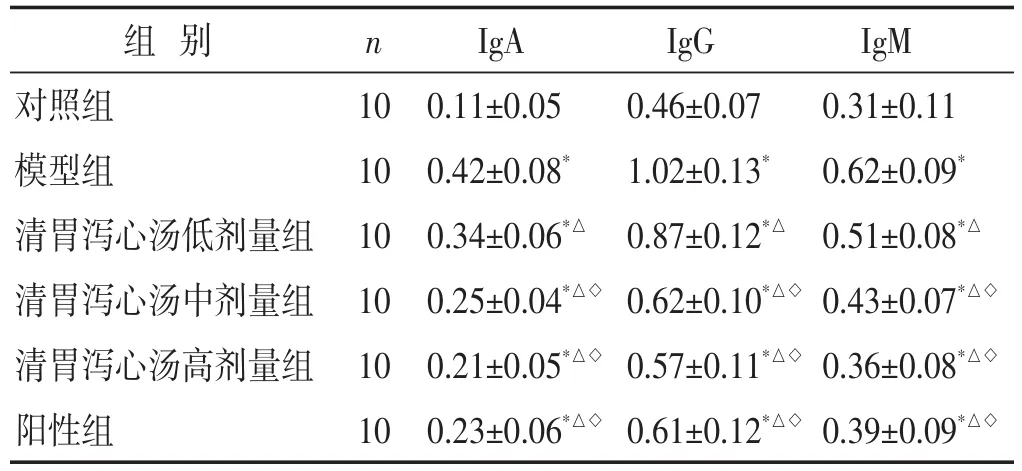
表2 各组大鼠免疫球蛋白水平比较(g/L,±s)
组别对照组模型组清胃泻心汤低剂量组清胃泻心汤中剂量组清胃泻心汤高剂量组阳性组n 10 10 10 10 10 10 IgA 0.11±0.05 0.42±0.08*0.34±0.06*△0.25±0.04*△◇0.21±0.05*△◇0.23±0.06*△◇IgG 0.46±0.07 1.02±0.13*0.87±0.12*△0.62±0.10*△◇0.57±0.11*△◇0.61±0.12*△◇IgM 0.31±0.11 0.62±0.09*0.51±0.08*△0.43±0.07*△◇0.36±0.08*△◇0.39±0.09*△◇
2.4 各组大鼠炎症因子水平比较 见表3。与对照组比较,模型组血清IL-2、IL-6和TNF-α水平显著升高(P<0.05);清胃泻心汤低、中、高剂量组和阳性组血清IL-2、IL-6和TNF-α水平均低于模型组,且清胃泻心汤中、高剂量组和阳性组显著低于清胃泻心汤低剂量组(均P<0.05)。清胃泻心汤中、高剂量组和阳性组血清IL-2、IL-6和TNF-α水平比较,差异无统计学意义(P>0.05)。
表3 各组大鼠炎症因子水平比较(μg/L,±s)
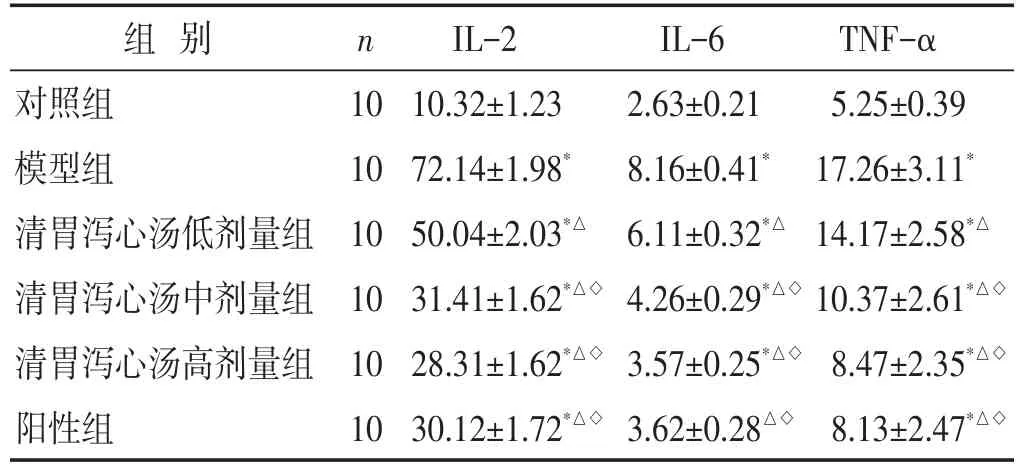
表3 各组大鼠炎症因子水平比较(μg/L,±s)
组别对照组模型组清胃泻心汤低剂量组清胃泻心汤中剂量组清胃泻心汤高剂量组阳性组n 10 10 10 10 10 10 IL-2 10.32±1.23 72.14±1.98*50.04±2.03*△31.41±1.62*△◇28.31±1.62*△◇30.12±1.72*△◇IL-6 2.63±0.21 8.16±0.41*6.11±0.32*△4.26±0.29*△◇3.57±0.25*△◇3.62±0.28△◇TNF-α 5.25±0.39 17.26±3.11*14.17±2.58*△10.37±2.61*△◇8.47±2.35*△◇8.13±2.47*△◇
2.5 各组大鼠氧化应激指标水平比较 见表4。与对照组比较,模型组血清MPO和SOD水平显著降低,MDA水平显著升高(P<0.05);清胃泻心汤低、中、高剂量组和阳性组MPO和SOD显著高于模型组,而MDA显著低于模型组,且清胃泻心汤中、高剂量组和阳性组与清胃泻心汤低剂量组比较,差异有统计学意义(P<0.05)。清胃泻心汤中、高剂量组和阳性组血清MPO、MDA和SOD水平比较,差异无统计学意义(P>0.05)。
表4 各组大鼠氧化应激指标水平比较(±s)
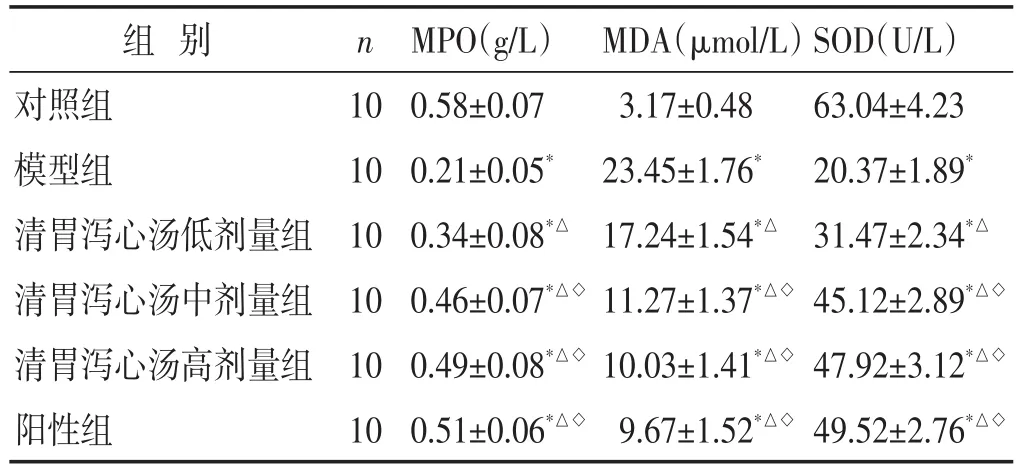
表4 各组大鼠氧化应激指标水平比较(±s)
组别对照组模型组清胃泻心汤低剂量组清胃泻心汤中剂量组清胃泻心汤高剂量组阳性组n 10 10 10 10 10 10 MPO(g/L)0.58±0.07 0.21±0.05*0.34±0.08*△0.46±0.07*△◇0.49±0.08*△◇0.51±0.06*△◇MDA(μmol/L)3.17±0.48 23.45±1.76*17.24±1.54*△11.27±1.37*△◇10.03±1.41*△◇9.67±1.52*△◇SOD(U/L)63.04±4.23 20.37±1.89*31.47±2.34*△45.12±2.89*△◇47.92±3.12*△◇49.52±2.76*△◇
3 讨论
胃溃疡病情较为复杂,主要是因胃黏膜侵袭因素增强引起,多种因素均参与了胃溃疡的胃黏膜损伤过程,导致胃黏膜防御能力下降,病程延长,易引起胃部出血、溃疡穿孔、幽门阻塞等严重并发症,严重影响患者的生活质量[8]。胃溃疡的发生与胃黏膜侵袭因素和防御机制之间平衡失调有关,胃酸分泌在胃溃疡的发病中具有关键性的作用,胃黏膜损伤修复过程涉及多种细胞、细胞外基质及细胞因子等,抑制损伤因子和提升保护因子具有重要的意义[9]。研究发现,炎症反应及氧化应激是胃溃疡发生的重要基质。程晓华等研究发现[10],活动性胃溃疡患者血清PG呈异常升高状态,与炎症活动性评分具有正相关关系;血清EGF呈异常下降状态,与炎症活动性评分具有负相关关系,动态监测活动性胃溃疡患者血清PG、EGF水平有助于评估病情及预后。体内自由基产生过多会损伤细胞,导致胃黏膜受损,罗炎杰等发现[11],兰索拉唑治疗活动期胃溃疡的临床效果明显优于奥美拉唑,可能与其显著提高患者血清SOD、NO水平及降低血清MDA、ET-1水平有关。此外,费林立等发现[12],奥美拉唑联合抗生素治疗有助于提高胃溃疡患者的临床疗效,降低复发率,这可能与改善患者免疫功能、调节胃肠激素等因素有关。因此,从免疫球蛋白、炎症因子及氧化应激指标探讨急性胃溃疡的治疗作用具有重要意义。
西医治疗胃溃疡具有给药方便、起效快的优点,但存在药物顺应性和耐药性的缺点,且远期溃疡复发率高。胃溃疡属中医学“胃脘痛”“胃痈”“吐酸”“反胃”等范畴,脾胃气机和畅,升降协调,运纳相宜,邪气侵袭,气机升降失司,脾胃运纳失职,导致疾病的发生。因中医药具有改善全身状况、稳定病情及减少副作用等优势,在治疗胃溃疡方面越来越受到人们的关注[13]。清胃泻心汤依据胃溃疡病因理论创立,重点是清热解毒,去腐生肌,其次护脾和胃。方中黄连和黄芩清热泻火、补脾益胃、敛疮生肌,清热祛腐而不伤正,藿香化湿醒脾,半夏燥湿化痰、消痞降气,茯苓利水渗湿、健脾,茵陈清热利湿,白及收敛止血,黄芪补气升阳、益气摄血、生肌长肉,生地黄滋阴补血、生津止渴,牡丹皮清热凉血、活血化瘀,大黄攻积滞、清湿热、泻火凉血、祛瘀解毒,延胡索、木香可理气止痛,木香还具有温胃化湿、醒脾消滞的作用,薏苡仁可益气除湿,苍术是运脾药,可燥湿化浊止痛,陈皮是轻升理气药,可使和胃健脾各得其宜,增加疗效。全方诸药合用可开可降、可清可补、和降胃气,使得脾升胃降。
本研究发现,清胃泻心汤低、中、高剂量组和阳性组的溃疡面积、溃疡指数显著低于模型组;清胃泻心汤中、高剂量组和阳性组胃黏膜变薄,上皮少量缺损、脱落,腺体增生较多,排列较整齐,少量炎性细胞浸润;清胃泻心汤低、中、高剂量组和阳性组血清IgA、IgG、IgM水平均低于模型组,血清IL-2、IL-6和TNF-α水平均低于模型组,MPO和SOD显著高于模型组,而MDA显著低于模型组;且清胃泻心汤中、高剂量组和阳性组明显优于清胃泻心汤低剂量组。
综上所述,清胃泻心汤可显著减少溃疡面积和溃疡指数,提高溃疡抑制率,改善胃组织形态学,其机制可能与调节免疫功能,降低炎症反应,改善氧化应激有关[14-20]。

