NLRP3炎症小体在ICU获得性衰弱大鼠呼吸肌和下肢肌中的表达
向朝雪 李福祥, 朱忠立 刘 畅 胡 健 黎俊雅 祝国芸 宋羽希
重症监护室获得性衰弱(intensive care unit-acquired weakness, ICU-AW)是严重疾病的常见并发症,在重症监护病房的患者中发生率约为50%[1]。呼吸肌无力往往影响撤机,导致拔管延迟,从而延长机械通气时间,增加住院时间。四肢肌肉功能障碍将导致生活质量下降和病死率增加[2]。由于肌肉萎缩的恢复非常缓慢,ICU-AW会导致身体机能的长期损害[3-4];甚至有报道称ICU-AW患者出院6个月后身体功能仍然受损[5]。
多项前瞻性研究发现,脓毒症是ICU-AW发生的重要的独立危险因素[6-8]。全身性炎症反应综合征和/或重要脏器炎症损害过程中产生的细胞因子造成肌肉组织损伤;而蛋白质合成和分解之间不平衡最终造成吸肌和下肢肌丢失和ICU-AW的发生[9]。本文在前期的研究中成功构建ICU-AW大鼠模型,在此基础上探讨炎症小体NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor pyrin domain containing 3, NLRP3)及其下游分子在脓毒症相关呼吸肌和下肢肌中的作用和机制,旨在为ICU-AW的诊治提供新的思路。
材料与方法
一、实验材料与试剂
兔抗NLRP3、Fbx32、GAPDH购于美国Abcam公司,兔抗IL-18、IL-1β、caspase1-p20、MURF1购于北京博奥森生物技术有限公司,全蛋白提取试剂盒、BCA蛋白定量试剂盒、蛋白上样Marker、Loading buffer购于江苏凯基生物技术股份有限公司,PCR引物、SYBRGreen Ⅰ购于北京擎科新业生物技术有限公司,PrimeScriptTMRT reagent Kit购于宝生物工程(大连)有限公司;HE染色试剂盒购于北京博奥森生物技术有限公司。其它未列出试剂纯度均达到分析纯。
二、实验动物及分组
5~7周龄清洁级健康雄性SD大鼠40只,体重200~240 g,购于成都达硕生物科技有限公司(生产许可证号:scxk(川)2008-24)。采用完全随机的方法将SD大鼠分为两组:对照组(sham组)、实验组(脓毒血症组)。实验用大鼠于我院实验中心动物房饲养,实验中所有损伤和程序均经过西部战区总医院伦理委员会批准。
三、动物模型制备
采用腹腔注射3%戊巴比妥钠(1.5 ml/kg)的方法对大鼠进行麻醉,麻醉后将其仰卧固定于操作台。实验组(脓毒血症组)大鼠在无菌条件下切开腹膜、暴露盲肠,挤出盲肠内空气后,在距离盲肠末端1 cm处使用医用真丝编织线结扎,采用12号针头在结扎的盲肠中部单次刺孔。而后,将盲肠回置于腹腔,逐层缝合腹膜、肌肉和皮肤。术后于大鼠背部皮下组织注射生理盐水5 ml行液体复苏。手术过程中未使用抗生素。对照组(sham组)大鼠切开腹膜、暴露盲肠,不行盲肠结扎、穿孔。所有大鼠均在同样的条件下进行饲养,自由进食、水。术后96 h,分离所有大鼠双侧膈肌和腓肠肌,左侧膈肌和腓肠肌用4%中性甲醛溶液固定后行病理学检查;右侧膈肌和腓肠肌于液氮中冻存,用于其它实验。
四、检测方法
1. 肌肉组织病理检测: 取对照组和实验组大鼠左侧膈肌和腓肠肌迅速放入4%多聚甲醛溶液中固定、脱水,常规石蜡包埋,以厚度4 μm切片,而后按照苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒操作说明书的步骤进行HE染色,并在光学显微镜下观察、拍照。采用IPP6.0图像分析软件测定肌纤维横截面积,每张切片测5个视野,取平均值进行统计学分析。
2. qRT-PCR检测: 采用qRT-PCR方法检测右侧腓肠肌、膈肌中NLRP3、Atrogin-1、MuRF1、Caspase-1、IL-1β和IL-18基因的表达(引物序列见表1)。提取右侧腓肠肌、膈肌组织标本中的RNA,采用Nanodrop 2000分光光度计测定RNA的浓度和OD 260/280比值。各样本均按照5 μg RNA相对应的体积,根据反转录试剂盒说明书在10 μl的反应体系中进行逆转录,条件为42 ℃,60 min;95 ℃,5 min。而后,按照qRT-PCR说明书要求,利用全自动荧光定量PCR仪进行PCR;反应条件为:95 ℃,2 min,95 ℃,15 s,60 ℃,30 min(40个循环);60 ℃,5 s。以GAPDH作为内参,各目的基因的相对表达量采用2-ΔΔct法进行计算。
3. Western blot方法检测: 采用western blot的方法检测各组大鼠腓肠肌和膈肌组织中Atrogin-1、MuRF1、NLRP3、Caspase-1、IL-18和IL-1β蛋白的表达。分别取50 mg腓肠肌、膈肌组织标本,用T-PER组织裂解液(Thermo, 美国)进行裂解;采用BCA法测定样品蛋白浓度。将100 μg蛋白样品与5×蛋白上样缓冲液充分混合后,在100 ℃条件下变性10 min。采用SDS-聚丙烯酰胺凝胶进行蛋白电泳,而后转移至PVDF膜,于室温条件下用5%脱脂奶粉溶液封闭2 h;在4 ℃条件下孵育一抗过夜(Atrogin-1、MuRF1、NLRP3、Caspase-1、IL-18、IL-1β抗体稀释比1︰1 000);采用TBST溶液洗膜后,用碱性磷酸酶标记的羊抗兔二抗(1︰5 000)在室温条件下孵育2 h,洗膜后用Odyssey双色红外激光成像系统收集信号;最后,以GAPDH为内参对目的基因条带灰度进行统计分析。

表1 目的基因qRT-PCR引物序列
五、统计学方法

结 果
一、脓毒血症时大鼠吸肌和下肢肌形态的变化
为了明确脓毒血症对ICU-AW时肌肉萎缩的影响,本研究首先探索了盲肠结扎穿孔术后脓毒血症对大鼠腓肠肌和膈肌形态的影响。沿腓肠肌纤维纵行切片的结果(图1A和D)表明,盲肠结扎穿孔术后96 h,大鼠腓肠肌中细胞核的数量减少,肌纤维排列较对照组更为疏松;而沿腓肠肌纤维的横截面的染色结果(图1B和E)更为清晰地展现了上述变化。此外,对膈肌标本的HE染色也观察到了类似的变化(图1C和F)。
二、脓毒血症时大鼠腓肠肌、膈肌纤维横截面积对比
明确脓毒血症ICU-AW大鼠腓肠肌和膈肌的病理变化后,我们分析了两组大鼠腓肠肌和膈肌横截面积的差异。对照组大鼠腓肠肌横截面积为(878.74±201.94)μm2,实验组大鼠腓肠肌纤维横截面积为(345.90±127.02)μm2,二者差异有统计学意义(P=0.018)。对膈肌纤维横截面积的分析结果表明,对照组大鼠膈肌纤维横截面积为(573.01±210.46)μm2,而实验组大鼠膈肌纤维的横截面积为(140.40±67.79)μm2,二者差异有统计学意义(P=0.028)。这一结果表明盲肠结扎穿孔术96 h后,大鼠吸肌和下肢肌纤维的横截面积明显减小,见表2。
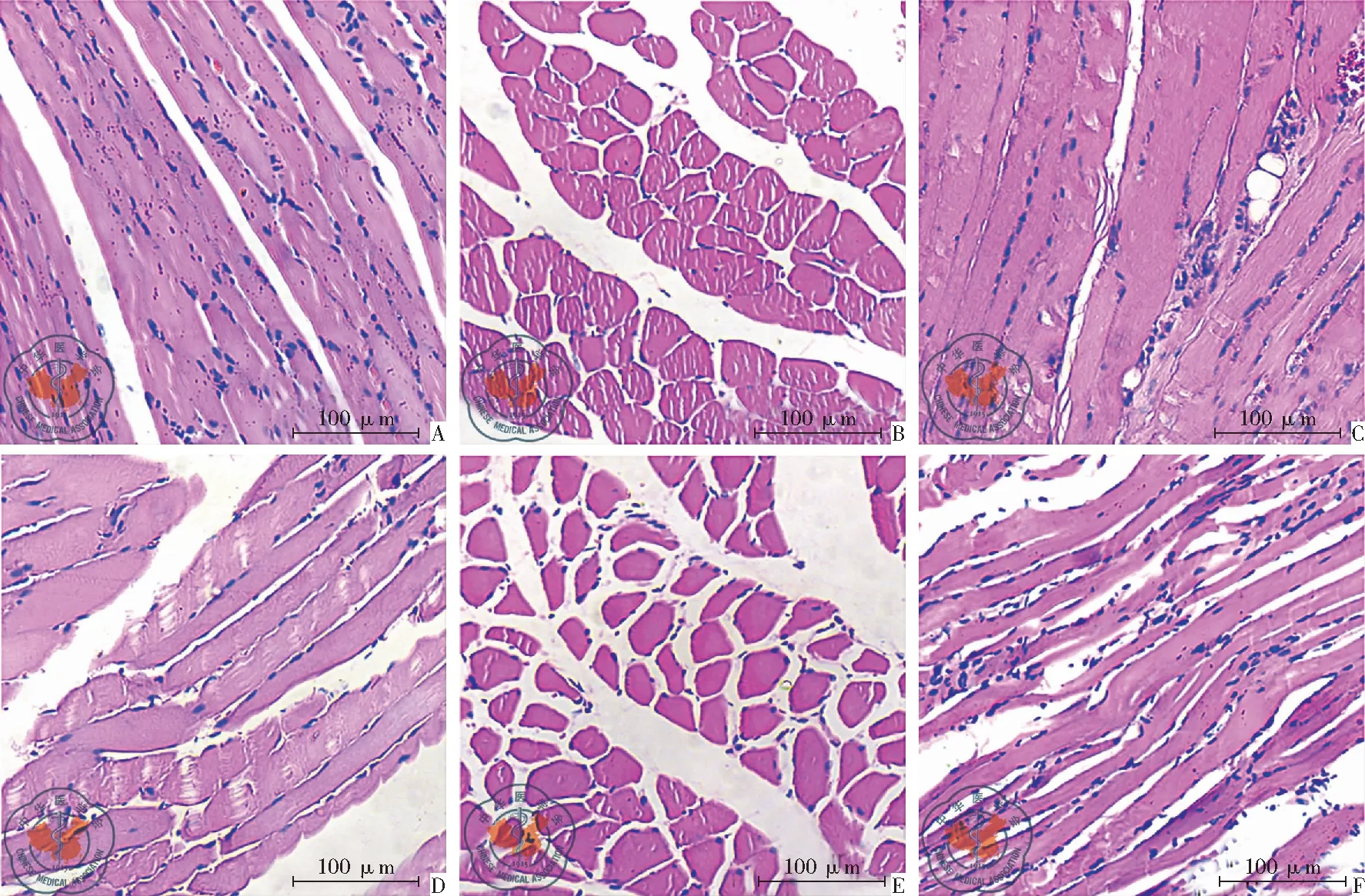
图1 盲肠结扎穿孔术后96 h大鼠腓肠肌和膈肌HE染色结果;注:A:对照组 沿腓肠肌纤维纵轴切片;B:对照组 沿腓肠肌纤维纵轴的横截面切片;C:对照组 沿膈肌纤维纵轴切片;D:实验组 腓肠肌纤维纵轴切片;E:实验组 沿腓肠肌纤维纵轴的横截面切片;F:实验组:沿膈肌纤维纵轴切片
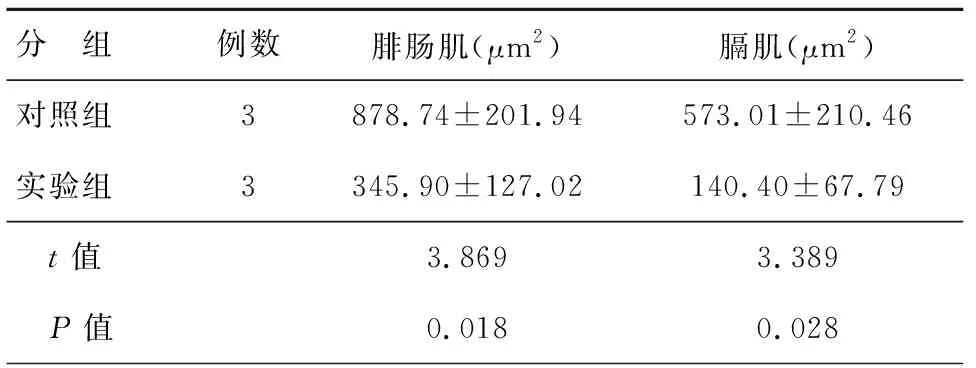
表2 对照组和实验组大鼠腓肠肌和膈肌纤维横截面积对比
三、脓毒血症对大鼠腓肠肌、膈肌组织中Atrogin-1和MuRF-1基因表达的影响
在明确脓毒血症导致大鼠腓肠肌和膈肌纤维萎缩的基础上,本研究进一步探索了盲肠结扎穿孔术96 h后大鼠腓肠肌、膈肌组织中Atrogin-1和MuRF-1基因的表达变化。qRT-PCR结果表明,对照组大鼠腓肠肌中MuRF-1和Atrogin-1的基因表达量分别为0.78±0.12和0.88±0.09;而实验组大鼠腓肠肌组织中MuRF-1和Atrogin-1基因表达量为3.24±0.20和24.19±3.81;与对照组相比,差异有统计学意义(P<0.05)。相似地,在实验组大鼠膈肌组织中也观察到Atrogin-1和MuRF-1基因表达量较对照组明显升高(P<0.05),见表3。
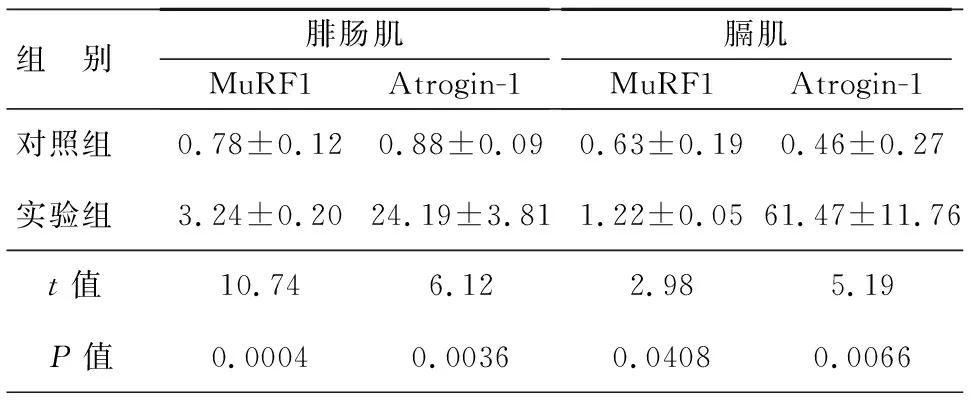
表3 对照组和实验组大鼠腓肠肌和膈肌中Atrogin-1和MuRF-1基因表达
四、脓毒血症对大鼠腓肠肌、膈肌组织中Atrogin-1和MuRF-1蛋白的表达变化
本文进一步明确了盲肠结扎穿孔术96 h后大鼠腓肠肌、膈肌组织中Atrogin-1和MuRF-1蛋白的表达变化。结果如图2A所示,实验组大鼠腓肠肌中Atrogin-1和MuRF-1的表达量较对照组明显升高(P<0.05);类似地,盲肠结扎穿孔术96 h后大鼠膈肌组织中Atrogin-1和MuRF-1蛋白表达量较对照组亦明显升高(图2B),差异有统计学意义(P<0.05)。并且,在膈肌中Atrogin-1和MuRF-1蛋白表达量增加的幅度比腓肠肌更为明显。

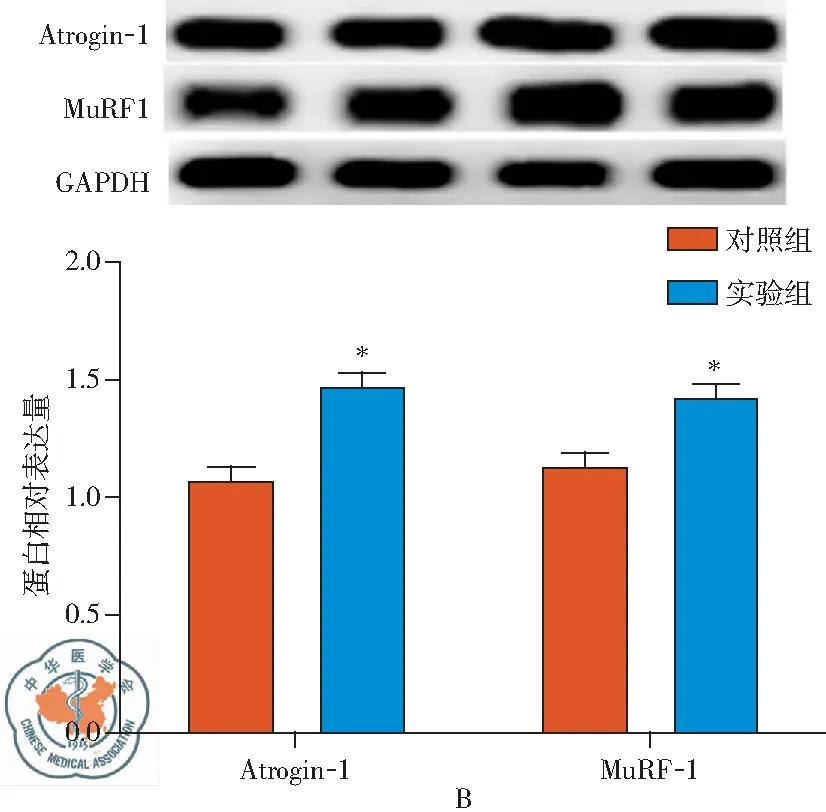
图2 脓毒血症时大鼠腓肠肌、膈肌组织中Atrogin-1和MuRF-1蛋白的表达
五、脓毒血症时大鼠腓肠肌、膈肌组织中NLRP3及其下游分子的mRNA表达
本文检测了ICU-AW大鼠腓肠肌、膈肌组织中NLRP3及其下游分子的mRNA表达变化,结果显示,对照组大鼠腓肠肌中NLRP3 mRNA表达量为0.91±0.16,而其在实验组大鼠腓肠肌组织的相对表达量为3.16±0.18,二者差异有统计学意义(P=0.0007)。对NLRP3下游分子的mRNA表达量的检测结果表明,对照组大鼠腓肠肌中Caspase-1、IL-18及IL-1β的相对表达量分别为1.25±0.78、0.72±0.15、0.0003±0.0001;而在实验组大鼠腓肠肌组织的表达量为18.01±0.45、1.54±0.03、0.0025±0.0006;差异有统计学意义(P<0.05)。相似地,对脓毒血症对大鼠膈肌组织的研究结果也表明,实验组大鼠膈肌组织中NLRP3及其下游分子的mRNA表达较对照组明显升高(P<0.05),见表4。
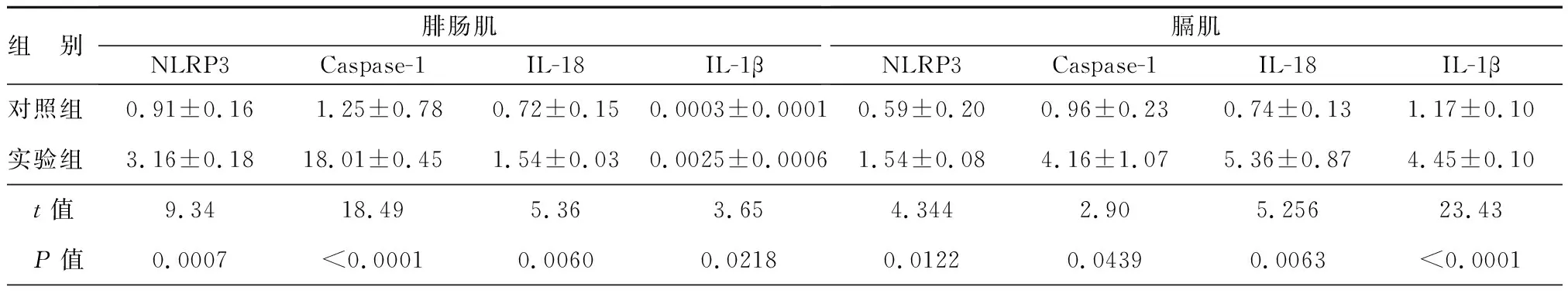
表4 脓毒血症时大鼠腓肠肌、膈肌组织中NLRP3及其下游分子的mRNA表达
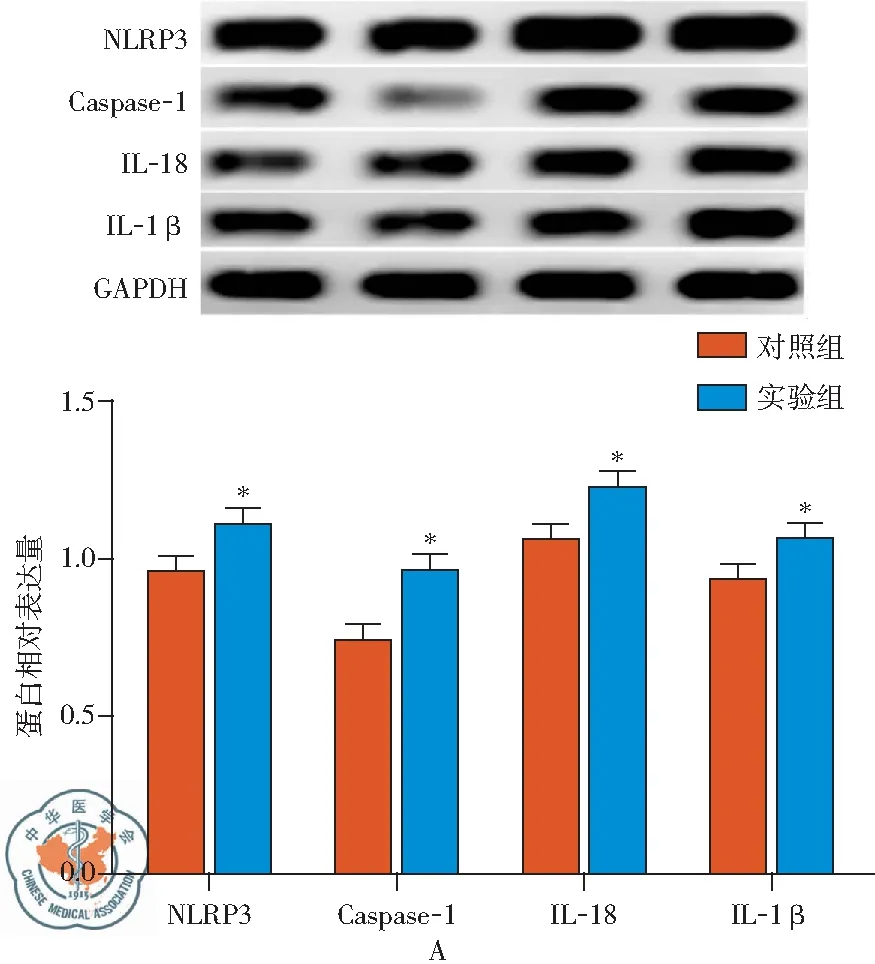
图3 脓毒血症时大鼠腓肠肌、膈肌组织中NLRP3及其下游分子蛋白表达
六、脓毒血症时大鼠腓肠肌、膈肌组织中NLRP3及其下游分子蛋白表达变化
在上述结果基础上,本文进一步验证了ICU-AW大鼠腓肠肌、膈肌组织中NLRP3及其下游分子蛋白表达变化。如图3A所示,脓毒血症96 h后,大鼠腓肠肌组织中NLRP3及其下游分子Caspase-1、IL-18和IL-1β蛋白表达水平较对照组明显升高(P<0.05)。相似地,对脓毒血症大鼠膈肌组织的检测结果也表明,盲肠结扎穿孔术96 h后大鼠膈肌组织中NLRP3及其下游分子Caspase-1、IL-18和IL-1β蛋白表达水平较对照组明显升高(P<0.05),见图3B。
讨 论
ICU-AW是一种床旁诊断,指ICU的患者在没有确切原因的情况下发生的明显虚弱[3],威廉·奥斯勒(William Osler)于1892年首先描述了严重脓毒症引起的“肉体快速流失”[10],2009年被确认并更名为“重症监护室获得性衰弱(ICU-AW)”[3]。已有的研究结果表明脓毒症、机械通气、长时间制动、高血糖状态、长时间激素及神经肌肉阻滞药物治疗等均与ICU-AW的发生有关[11]。
ICU-AW发病机制有多种理论,ICU-AW发病机制研究的动物模型制备方法也有多种,包括去神经支配-类固醇模型、废用性模型、脓毒血症模型、ICU模型、重症患者体外血清激发试验模型、兔烧伤模型、高血糖模型等[12]。本课题组在前期的研究中成功构建了脓毒血症大鼠ICU-AW模型[13]。在此基础上,本文探讨了ICU-AW时大鼠吸肌和下肢肌溶解的情况。HE染色和分析的结果表明,脓毒血症时大鼠腓肠肌和膈肌中肌纤维排列更为疏松,肌纤维的横截面积较对照组明显减小,说明吸肌和下肢肌发生了一定程度的溶解。已有的报道表明,肌肉溶解的机制非常复杂,危重病患者入ICU后不久吸肌和下肢肌中就会出现肌球蛋白重链(MyHC)的持续丧失[14]。MyHC和许多其他肌原纤维蛋白(如肌球蛋白结合蛋白)参与MuRF1的合成[15],肌球蛋白D(MyoD)参与Atrogin-1的合成[16]。本课题检测并明确脓毒血症时大鼠腓肠肌和膈肌组织中MuRF1和Atrogin-1的表达较对照组明显升高,从分子层面证明ICU-AW时大鼠吸肌和下肢肌可发生一定程度的溶解。
炎症小体由感受蛋白(包括多种炎症小体相关蛋白)、连接蛋白(凋亡相关颗粒样蛋白)以及效应蛋白组成[17]。其中,NLRP3炎症小体是研究较为深入的炎症小体,由结合蛋白NLRP3、连接蛋白ASC、效应蛋白caspase-1组成。目前已明确多种内/外源性刺激可激活NLRP3炎症小体,活化后的NLRP3炎症小体通过NBD结构域形成多聚体,募集caspase-1并水解其非活性片段[18]。活化后的caspase-1可切割IL-1β和IL-18的前体,产生相应的成熟细胞因子,还能诱导细胞的炎症坏死和组织细胞焦亡[19]。本课题的研究结果表明,盲肠结扎穿孔96 h后,大鼠腓肠肌和膈肌组织中NLRP3基因和蛋白表达的水平均明显高于对照组;此结果与继往NLRP3参与炎症反应的结果相似[20]。在此基础上,我们探索了NLRP3炎症小体相关分子在ICU-AW大鼠模型腓肠肌和膈肌组织中的表达,结果表明,盲肠结扎穿孔术后96 h,大鼠腓肠肌和膈肌中Caspase-1、IL-18、IL-1β基因和蛋白表达量均明显高于对照组,进一步说明NLRP3炎症小体参与了ICU-AW。
综上所述,盲肠结扎穿孔术制备的脓毒血症模型中,吸肌和下肢肌溶解参与ICU-AW的发生;同时,本文研究结果也说明NLRP3炎症小体参与上述过程。本文仍有不足之处,目前的研究仅限于对NLRP3炎症小体在脓毒血症ICU-AW大鼠模型中表达及其与吸肌和下肢肌萎缩关系的研究,尚未深入探讨NLRP3炎症小体参与ICU-AW的病理生理学机制,这是在后续研究中尚需要补充和完善的内容。

