上市许可持有人制度下药品生产企业不良反应监测模式探讨
王长之,陈晓博,刘曦朦,刘超
2017 年10 月8 日,中共中央、国务院两办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[1],明确提出要加强药品全生命周期管理,建立上市许可持有人直接报告不良反应和不良事件制度,由上市许可持有人(Marketing Authorization Holder,即MAH,包括持有药品批准证明文件的生产企业,以下简称为持有人)承担报告药品不良反应的主体责任。基于此,药品生产企业开展全过程的不良反应报告收集、上报、评价、风险识别、评估及控制已成为时代发展的必然趋势,原有的监测模式已难以实现法律法规要求。本文通过对药品不良反应监测相关法律法规进行梳理,结合药品生产企业不良反应监测现状,探讨上市许可持有人制度下药品生产企业不良反应监测模式,以期为我国药品生产企业创新不良反应监测方法,进一步落实其药品安全第一责任人职责提供参考。
1 我国关于生产企业药品不良反应监测的相关法律法规要求
药品不良反应(Adverse Drug Reaction,ADR)监测作为上市后药品安全性研究的一种重要手段,在全世界范围内被各个国家广泛应用。我国自20 世纪90年代开始此项工作以来,经过30余年的发展,在法律法规制定、监测体系建设、报告数量、报告质量、信息利用、风险管控等方面均取得了长足发展。从风险管理角度看,生产企业作为药品安全第一责任人,是进行药品风险识别、评估、控制以及交流的第一责任主体,并且也是贯穿药品全生命周期监管唯一不可缺位的主体。随着时代的发展,我国法律法规对药品生产企业开展不良反应监测也提出了新的要求,不断强化其履行主体责任职责(见表1)。

表1 我国药品生产企业不良反应监测相关法律法规要求
从表1 可以看出,我国药品不良反应监测制度进一步完善,药品生产企业不良反应监测主体责任进一步凸显。《药品管理法》中对于生产企业上报药品不良反应虽然仅有短短的一行规定,但从法律层面明确了生产企业的职责,为以后的行政监督、检查提供了法律依据。《药品不良反应报告和监测管理办法》(以下简称《办法》)则对生产企业体系建设、人员配备、个例报告、群体报告、重点监测以及法律责任等进行了明确规定,为生产企业开展本企业药品不良反应报告和监测指明了方向。《药品说明书和标签管理规定》则向企业传递了一个重要信息,即药品具有双重性,不是绝对安全的,企业的义务在于主动将已知的安全性信息载明,告知临床医生、病人和公众。《药品不良反应报告和监测检查指南(试行)》(以下简称《检查指南》)的发布,首次明确了监督管理部门对生产企业执行药品不良反应报告和监测情况的具体检查内容,开创了有史以来全国范围内对生产企业进行不良反应专项检查的局面。《关于药品上市许可持有人直接报告不良反应事宜的公告(2018年第66号)》(以下简称《公告》)首次明确了超适应证、超剂量用药、禁忌证用药、药品质量问题等引起的有害反应同样属于不良反应上报范围;对于国家药品不良反应监测中心(以下简称国家中心)每月反馈的监测数据生产企业也需进行分析评价后按要求上报;强制要求企业每年3月31日前向省级监测部门提交年度分析报告。
2 我国药品生产企业不良反应监测现状
从法律法规内容来看,我国对生产企业开展药品不良反应监测的要求日益提高,对生产企业贯彻落实药品上市后风险监测和控制的责任和能力不断规范,倒逼企业承担药品安全主体责任。通过对国家中心发布的监测年度报告、文献报道以及对生产企业进行药品不良反应报告和监测实地检查情况进行梳理,发现目前我国药品生产企业在开展不良反应监测过程中存在以下问题。
2.1 领导重视程度不够,监测体系不健全 《办法》规定生产企业应建立相关药品不良反应报告和监测管理制度,设立专门的机构并配备专职人员,主动对获知的不良反应信息进行收集、分析、评价、上报。《检查指南》也明确规定生产企业应建立清晰明确的药品安全问题处理机制以及包含个例、群体、境外报告、定期安全性更新报告、重点监测、安全性信号检测、说明书更新、文献检索、数据处理、资料存档等工作程序。结合我省2015—2018 年对本省生产企业药品不良反应报告和监测检查情况以及沈梦秋等[7]对2016 年江苏省生产企业药品不良反应报告和监测检查缺陷分析,目前生产企业虽已按照规定建立了专门机构,制定了相应的工作职责、工作程序等文件,配备了专职人员,但有很大一部分企业领导重视程度不够,自上而下缺乏浓厚的安全监测意识,存在组织机构不清晰,ADR 监测部门工作职责不全面,工作程序流于形式、可操作性不强等问题;在人员配备上,多数企业仅有一名专职人员,难以满足监测工作要求;在死亡病例或群体事件调查上,时间界限划定不清晰,各部门之间工作职责不明确;在对ADR监测人员以及相关部门人员的培训上,缺少系统的培训计划,存在培训内容不突出、培训频次不合理、培训效果不显著、培训记录不完善等问题。
2.2 报告收集途径不畅,报告数严重偏低“巧妇难为无米之炊”,基础报告的收集,是进行后续报告分析、评价、信号挖掘、风险效益评估、风险控制的基础,我国药品不良反应监测工作较其他发达国家虽然起步较晚,但发展速度迅猛。截至2017 年底,我国药品不良反应监测数据库已累计收到ADR 报告1218.2 万份[8],自2013 年以来,年病例报告数稳定在130 万份以上,医疗机构仍是报告收集的主渠道,且近五年来有逐年上升的趋势,但药品生产企业作为不良反应报告监测的责任主体,年报告数量占比不足2%(见表2)。与日本、美国等发达国家相比,如日本生产企业报告占比为62.9%[9]、美国生产企业报告占比达95%以上[10],我国药品生产企业报告数量占比严重偏低[11]。
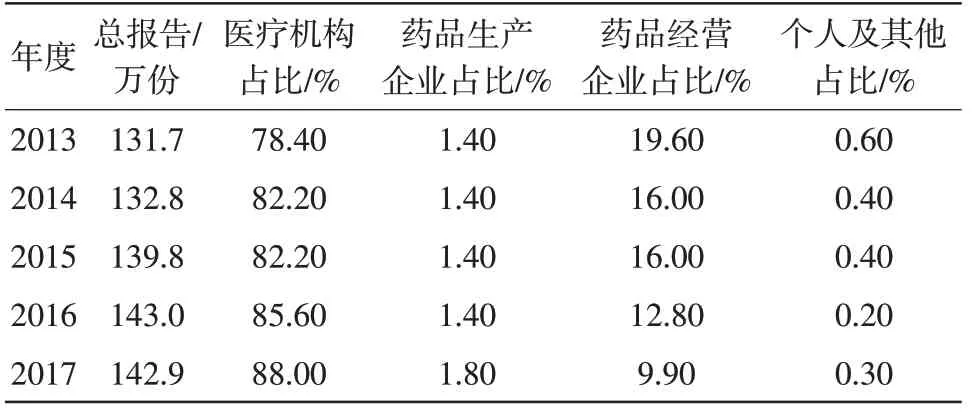
表2 2013-2017年我国药品不良反应报告来源占比
根据沈梦秋等[7]对江苏省辖区内92 家药品生产企业进行的ADR检查情况分析显示,在个例药品不良反应报告方面存在缺陷共计114 项,其中涉及生产企业未主动、有效地收集报告缺陷占42.98%,且绝大多数的企业从未收集到个例报告或者收集的报告数量远远低于其实际发生的数量,这与我省企业检查情况较为一致。2017 年对我省42 家生产企业进行ADR 检查,共发现缺陷272 项,其中个例报告方面存在缺陷共计79 项,54.8%的企业存在报告收集途径单一。通过对企业的报告收集途径进行查看,多数企业主要通过消费者电话投诉反馈,获取信息的途径较为单一,且由于消费者专业知识受限以及出于隐私保护的目的,往往反馈的信息不够全面,导致病人姓名、联系方式、合并用药、不良反应过程描述等关键信息缺失,收集到的不良反应信息无法满足报告填写完整、规范、准确等要求。其次,部分生产企业采取委托销售的方式,直接将产品的销售、配送等授权给商业公司,但在委托合同中缺少对商业公司收集相关不良反应信息的约定,导致报告收集数量严重偏低。再次,由于药品不良反应监测人员、销售人员缺少相关专业培训,自主收集报告意识不强,与临床医生沟通不畅,难以得到医疗机构的一手报告反馈。最后,由于监测人员数量与工作量不匹配以及监测人员专业知识受限,对于文献报道、论坛报道等报告来源,生产企业未进行定期信息检索,导致该部分报告未能按要求上报。
2.3 监测人员能力不足,数据利用度不高 报告收集是基础,如何从收集到的个例报告中发现风险信号,并对相关风险进行评估、控制是开展药品不良反应监测的目的。为了切实提高生产企业对上市后药品风险的防控能力,国家中心自2009年起开始向生产企业反馈该企业品种在全国发生的ADR 报告,并且由最初的一年反馈一次,逐渐增加到每季度反馈一次,直至当前每一个月反馈一次。为不断增强药品不良反应分析评价能力,国家中心采取日监测、周汇总、季度分析等工作机制对监测数据进行分析评价,深入挖掘药品风险信号,并采取修订药品说明书、暂停生产销售等风险管理措施。据国家食品药品监督管理局网站显示[12],2015 年1 月至2018年11月,共发布药品说明书修订公告89期(见表3),且70%以上公告明确表示其修订基于药品不良反应监测评估结果。但从对生产企业的ADR 监测情况以及文献报道[13-15]来看,我国多数生产企业存在监测人员数量有限,专业技术能力不足,信息利用度不高,风险控制措施实施不到位等情况。如沈梦秋等[7]对江苏省辖区内92 家药品生产企业进行的ADR检查情况分析显示,在定期安全性更新报告方面共有缺陷55 项,65.45%的缺陷项集中在企业未对严重病例进行逐例分析,未对反馈的数据进行深入分析和评价等;在评价与控制方面共有缺陷62项,80.64%的缺陷项集中在企业未主动对监测数据进行深入分析、信号提取、风险识别、调查确认、主动开展安全性研究等。这与我省生产企业ADR检查情况一致。此外,与国外企业相比,我国药品生产企业在风险沟通方面存在严重不足,以吗替麦考酚酯制剂为例,其进口产品在获得批准证明文件后主动进行了10次左右的说明书内容修订,而国产产品绝大多数企业未进行任何修订,部分企业仅有1~2次修订[16]。

表3 2015-2018年我国发布药品说明书修订情况
3 新形势下我国药品生产企业不良反应监测模式发展路径
3.1 健全内部监测体系,提高整体监测能力 2017年5 月31 日至6 月1 日,国际人用药品注册技术协调会(ICH)2017年第一次会议通过了原国家食品药品监督管理总局的申请,正式批准总局成为ICH 成员[17],我国成为其全球第8 个监管机构成员。2018年6 月7 日ICH 2018 年第一次大会上,中国国家药品监督管理局当选为ICH 管理委员会成员[18]。这一系列举措标志着我国药品监管、药品研发将逐步转化和实施国际最高技术标准和指南,并积极参与规则制定,满足国内外病人临床用药需求。药品上市许可持有人直接报告不良反应制度立足于我国加入ICH的大背景,是推动药物警戒工作发展、落实企业主体责任、加速监管要求与国际接轨的有效手段,生产企业应进一步提高认识,认清方向,吃透政策,提前布局,建立健全监测体系。如根据现有政策,生产企业要逐渐成为报告收集、分析、评价、风险预警与控制的主要责任者,在专职人员配备数量上应增加必要的人力支持;在新政策频繁落地的背景下,要投入必要的资金支持,积极参加国家、省级药品不良反应监测部门组织的各项培训,认真学习相关政策和技术规范,不断完善本企业工作制度和程序;在临床推广方面,完善风险沟通制度,加强与临床的有效沟通,保障临床合理用药;在企业内部培训方面,除了开展适合生产、销售、售后处理等部门的普适性培训,还应开展针对专职监测人员的重点性培训,包括文献检索策略、前沿的政策、国内外最新安全性信息、死亡报告和群体事件的处理、风险沟通策略、风险评估方法等,提高专职人员的专业知识和业务能力。
3.2 借助CHPS系统,畅通报告收集渠道 《公告》明确提出持有人应当建立面向医生、护士、药师、病人的有效信息收集途径,而目前实际情况是企业在获取医疗机构的一手报告时十分困难,而医疗机构作为事件发生的第一现场,其是否进行上报、上报的报告质量如何直接影响后续的报告分析和评价。从医疗机构角度看,其漏报、报告质量不高主要原因是:一医疗机构归口于卫生系统,自身对不良反应报告工作重视程度不够;是医务工作者日常工作十分繁忙,没有多余的时间进行报告收集、填报;三怕引起医疗纠纷,不愿直接与病人、企业人员接触。为此国家药品不良反应监测中心自2017 年开始在中国部署建立“中国医院药物警戒系统”(CHPS 系统),该系统与医院的HIS 系统对接,可以实现ADR病例信息智能上报、智能搜索等功能,大大减少监测人员的填报时间,并且还可以获得病人的检查检验信息,提高报告的规范性和完整性。但由于部署CHPS 系统需要医疗机构投入一定的接口费、维护费等费用,目前只有很少一部分三级医疗机构建立了该系统。因此,建议生产企业根据自身产品特点,选择一些销量大、报告多的医疗机构进行合作,通过帮助医疗机构建立CHPS系统或按照报告数付费等形式让医疗机构在进行报告上报的同时将本企业产品的报告反馈给企业,建立信息共享机制,及时获取医疗机构发生药品不良反应的一手资料,打通生产企业从医疗机构收集药品不良反应信息的“最后一公里”,提高报告收集的有效性。
3.3 建立专业数据库,提高风险识别能力 上市许可持有人制度对生产企业主动进行风险研判,积极制定有效的风险控制措施提出了明确要求,从近几年国家药品监督管理局发布药品说明书修订公告情况看,加强风险评估、主动控制风险已成为药品不良反应监测新的工作方向。在收集到了大量的基础报告后,如何对得到的报告进行科学的分析、评价、汇总、处理是生产企业的工作重心所在。在大数据、互联网+的时代背景下,生产企业建立自己专业的药物警戒数据库、文献检索数据库则会使分析、评价工作事半功倍,而一些大型制药企业早在20 世纪90 年代就开始了此项工作。如葛兰素史克(GSK)公司早在1999 年就建立了“葛兰素史克的全球安全系统(OCEANS)”,对临床前安全信息、临床随机对照试验、观察性研究、自发报告系统、文献报道等所有的安全性信息进行收集、分析,实现对产品全生命周期监管[19]。拜耳、阿斯利康、罗氏等跨国企业也分别于2001 年、2008 年和2011 年建立了本企业专门的药物警戒数据库[20-21]。目前,我国多数生产企业还处于数据库建设初级阶段,日常工作中主要利用Excel 对数据进行初步的统计汇总,部分企业建立了太美医疗药物警戒数据库[22]。建议生产企业趁早部署,根据自身实际情况,建立适合自己的专业数据库,提升风险识别能力。
3.4 借助“外脑”,加强风险控制实施 鉴于药品不良反应监测是一项专业性、技术性很强的复杂工程,每一项风险的发现、评估、确认都需要流行病学、统计学、医学等多学科的专家提供技术支持,因此生产企业在开展报告收集、上报、分析等基础工作的同时,一方面通过培训、学习不断提高自身专业素质,逐步增强风险信号识别的敏锐性,另一方面要善于利用外部资源,加强与省、市药品不良反应监测机构的沟通交流,充分利用本地区的专家资源库,以风险讨论会、风险沟通会等形式,对于发现的风险信号进行专家论证,及时进行风险确认、风险沟通,切实保障公众用药安全。

