长骨原发性胚胎性横纹肌肉瘤2例
李丽辉,王 丽,赵德强
胚胎性横纹肌肉瘤(embryonal rhabdomyosarcoma, ERMS)是软组织肉瘤常见类型,好发于头颈部、泌尿生殖道、四肢软组织,而原发于骨组织者极为罕见[1],笔者收集我院10年间2例经手术病理证实为四肢长骨ERMS患者的临床症状、影像学表现、病理学资料,并结合相关文献进行复习分析,以期提高临床对此病的诊治水平。
1 临床资料
1.1 对象 收集本院2005-01至2018-12间经手术病理确诊的长骨原发性ERMS患者2例,男、女各1例,年龄分别为13、14岁。病例1,男13岁,1个月前外伤后出现右肘关节局部疼痛,活动受限而就诊,行X线平片检查发现病变;病例2,女14岁,因6个月前感觉左侧小腿内侧中上段出现压痛,并可触及质地较硬的肿物突起而就诊。
1.2 方法 2例患者均行GE Revolution XR/d型800 mA数字化X线机平片检查,其中1例行ECT检查,1例行MRI检查(场强1.5T超导型,Siemens的Somatom),成像参数:T1WI:TR/TE 690/12 ms,T2WI:TR/TE 5000/60 ms,层厚8 mm,视野24 cm×24 cm,矩阵256×256。
1.3 结果
1.3.1 影像表现 病例1:X线平片检查显示右侧尺骨近端见囊状骨质破坏区(图1A、B),病灶轻度膨胀,并突破骨皮质,见少量层状骨膜反应,周缘见软组织肿块影;ECT检查提示右侧尺骨近端及尺骨鹰嘴浓聚影。病例2:X线平片检查显示左侧胫骨中上段髓腔内可见溶骨性骨质破坏(图2A、B),未见钙化与死骨,边界模糊,轻度膨胀,可见轻度层状骨膜反应,周缘软组织稍肿胀;MRI显示左侧胫骨中上段髓腔内可见不规则骨质破坏区,累及范围7.1 cm×2.6 cm×2.8 cm,周缘形成软组织肿块影,T1WI呈低信号,内见斑片状稍高信号(图2C),T2WI呈稍高信号(图2D),Gd-DTPA增强扫描肿块呈明显不均匀强化,其内囊变坏死区未见强化(图2E)。
1.3.2 病理结果 病例1:肿瘤细胞小,异型性明显,部分核偏位,瘤细胞呈片巢状、条索状浸润,胞浆
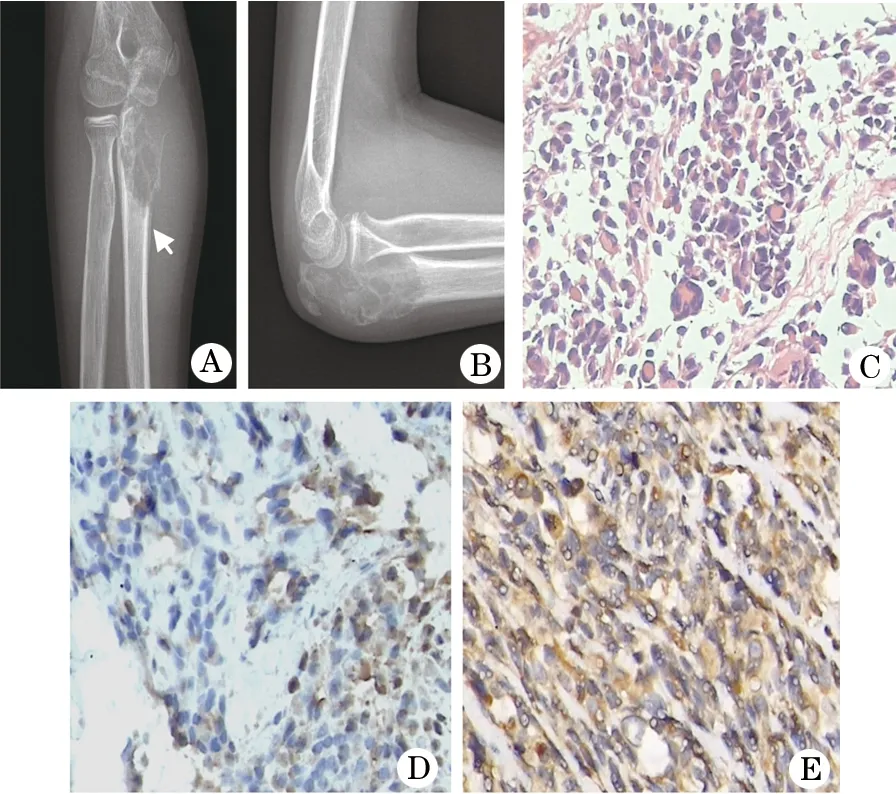
图1 长骨胚胎性横纹肌肉瘤影像学及病理图(患者1,男,13岁)
A、B.右侧尺骨近端呈溶骨性骨质破坏,轻度膨胀,边界不清,肿瘤突破内侧骨皮质,见少量层状骨膜反应(箭头所示),周缘软组织肿胀;C.肿瘤细胞小,异型性明显,呈梭形、多角形或不规则形,胞浆丰富红染,核异型性明显,部分核偏位深染,偶见核分裂象(HE×400);D、E.免疫组织化学分别显示Myoglobin与MyoD1呈阳性表达
丰富红染(图1C),浸润破坏周围骨组织及软骨组织。瘤细胞巢间纤维组织明显增生;免疫组织化学染色显示Myoglobin(+)(图1D)、Vim(+)、Desmin(+)、Actin(部分+)、SMA(少数+)、MyoD1(+)(图1F)、CK(-)、EMA(-)、S-100(-)、CEA(-)、HMB45(-)、CD99(-)、LCA(-)。病例2:瘤细胞弥漫分布,部分成簇(图2F),瘤细胞呈梭形、多角形或不规则形,胞浆红染,核异型性明显,深染,偶见核分裂象,部分间质黏液变性;侵犯骨质并见坏死及死骨。免疫组织化学染色显示Desmin(+) (图2G)、Myogenin(部分+)(图2H)、Vim(+)、Actin(局部+)、SMA(少数+)、MyoD1(+)、CK(-)、CD99(-)、S100(-)。
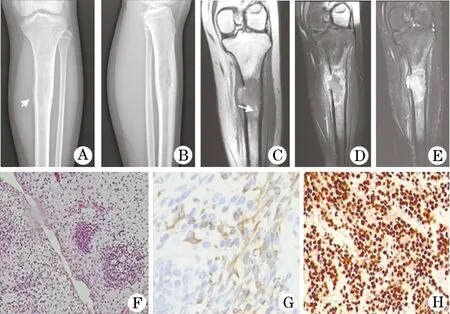
图2 长骨胚胎性横纹肌肉瘤影像学及病理图(患者2,女,14岁)
A、B.左侧胫骨中上段髓腔内可见溶骨性骨质破坏,边界模糊,轻度膨胀,可见轻度层状骨膜反应(箭头所示),周缘软组织稍肿胀;C、D、E.肿瘤T1WI呈低信号,内见斑片状稍高信号(箭头所示),T2WI呈稍高信号,增强扫描肿块呈明显不均匀强化;F.瘤细胞弥漫分布,呈成簇状、片巢状分布(HE×100);G、H.免疫组织化学显示Desmin与Myogenin呈阳性表达
2 讨 论
2.1 临床特点 横纹肌肉瘤(rhabdomyosarcoma, RMS)是一种起源于原始间质细胞的少见软组织恶性肿瘤,根据肿瘤的组织学形态及分子遗传学特征,WHO将其分为ERMS、腺泡状横纹肌肉瘤及多形性横纹肌肉瘤三种病理亚型,其中ERMS约占RMS的60%,好发于儿童及青少年,男性多于女性,发病年龄分布呈现出 “婴幼儿期” 与“大童期”两个高峰特征[2]。ERMS表现出高度恶性肿瘤的生物学行为,早期即可沿血管、淋巴管发生远处转移。ERMS最常见的发病部位为头颈部的口腔、眼眶、中耳、脑膜、鼻腔等腔隙型器官,且以5~9岁的儿童多见;其次为泌尿生殖系统,发生于女性生殖系统的肿瘤最常累及婴幼儿阴道,位于睾丸者多见于青少年及儿童;少数发生于四肢者多位于大童与青少年的软组织,而原发于四肢长骨的ERMS更为罕见[3]。长骨原发性ERMS的临床症状与肿瘤原发部位、体积大小,是否压迫及侵犯神经有关,主要表现为患肢持续性、进行性的酸胀、疼痛,可触及质地较硬的实性肿块,且病灶无移动性,按压患处可使疼痛加重;肿瘤位于关节附近时,可引起相应关节活动受限;随着病情迅速发展,相邻皮肤可出现红肿热痛及破溃、出血表现;当肿瘤病程发展为中晚期时,绝大多数因发生远处转移而出现相应的临床症状。本组2例四肢长骨ERMS患肢均处于少年期,且均以患肢疼痛为首发临床症状,触之患处均有压痛,基本与文献[3]报道一致。
2.2 病理特点 骨原发性ERMS的组织学形态与原发于软组织的肿瘤相似,镜下可见大量横纹肌母细胞或向横纹肌细胞分化的间叶源性细胞,瘤细胞呈圆形、短梭形、蝌蚪形、蜘蛛样等多种形态,胞质强嗜酸与胞质内横纹提示瘤细胞终末分化[4];基质中含有少量胶原及数量不等的黏液。横纹肌母细胞的存在是横纹肌肉瘤最具特征性的诊断特点,其可表现为带状蝌蚪样、球拍样及折稻草样,胞浆深嗜酸性[5]。但在普通光学显微镜下,特征性的横纹肌母细胞难以清晰显示,因此免疫组织化学染色在诊断ERMS中必不可少[6]。波形蛋白(Vimentin)主要用于鉴别癌与肉瘤,敏感性高、特异性差;肌红蛋白(Myogenin)广泛存在于心肌和骨骼肌,对横纹肌肿瘤细胞特异性高,敏感性差;肌调节蛋白(MyoD1)是横纹肌肿瘤的一种标记物,对横纹肌肉瘤有高度的特异性和敏感性;结蛋白(Desmin)是广泛存在于平滑肌与骨骼肌内的一种细胞骨架蛋白,对横纹肌肉瘤诊断具有价值;平滑肌肌动蛋白(SMA)是一种标记平滑肌的肌动蛋白,与Actin抗体联合使用,可用于研究RMS与平滑肌肉瘤。陈薇等[7]报道,联合应用Vimentin、Desmin、SMA、Myogenin四种抗体,并结合光镜瘤细胞特点即可对此病确诊。本组2例免疫组织化学中,其Myoglobin、MyoD1、Vimentin、Desmin与SMA均呈不同程度的阳性表达,再结合光镜细胞表现,较易确诊。
2.3 影像表现 骨原发性ERMS极其罕见,文献[8]报道发生于脑膜旁颅骨、外耳道旁颞骨和乳突,鼻腔、鼻窦旁骨板和眼眶周围骨板的ERMS实际上大多是邻近部位软组织ERMS侵蚀周围骨组织所致,并非为骨原发性ERMS。因此是否为骨原发性ERMS需结合临床各项相关检查,以排除其他原发组织器官转移至骨的ERMS,其中影像学检查在排查过程中是不可缺少的。国内外文献对原发于骨的ERMS影像表现报道极少,作者仅根据现有影像资料对其进行以下分析。
X线平片及CT对骨膜、钙化反应比较敏感,MRI具有良好的软组织分辨率,可以显示肿瘤与周围组织关系以及与周围肌肉和血管、神经的关系情况,尤其对骨髓更敏感,能根据骨髓信号改变发现早期的病变,X线平片+MRI在经济与低辐射剂量的前提下,能为临床提供骨肿瘤更多的影像学信息,从而提高对病变诊断的准确性[9]。骨原发性ERMS为高度恶性肿瘤,具有恶性骨肿瘤的一般特征,因其起源于骨髓腔,X线平片主要表现为骨髓腔溶骨性骨质破坏,边界模糊,可有轻度膨胀性,突破骨皮质可在周缘软组织形成肿块,层状且不连续的骨膜反应体现了恶性骨肿瘤对骨组织破坏大于修复的特点,本组2例在肿瘤突破骨皮质后的周缘均可见层状且不连续的骨膜反应。在MRI检查中,有文献[10]报道原发于颞骨岩部与乳突部的ERMS在T1WI上以稍低信号为主,在T2WI上呈不均匀高信号,可能是肿瘤在密集的肿瘤细胞之间有大小不等的黏液样间质区,增强后不均匀中度强化。本组患者2的MRI检查表现基本与上述发生于其他部位骨质的ERMS一致,但本例T1WI中的瘤体内见斑片状稍高信号,笔者认为是瘤内出血所致。
2.4 鉴别诊断 长骨原发性ERMS主要需与尤文肉瘤、嗜酸性肉芽肿鉴别:(1)尤文肉瘤在青少年常见恶性肿瘤中仅次于骨肉瘤位于第二位[11],患者发病年龄较ERMS稍大,多在10岁以上,常有不规则发热、继发性贫血、白细胞增高及红细胞沉降率增快。位于四肢长骨的尤文肉瘤常常位于骨干,在影像检查中多可见葱皮样、多层状骨膜反应。病理检查中,肿瘤细胞倾向于集合在血管间隙,形成假玫瑰型或菊形团样结构,肿瘤细胞CD99与神经元特异性烯醇化酶(NSE)呈阳性表达。(2)嗜酸性肉芽肿(langerhans’cell histiocvtosis,LCH)多见于20岁以下的青少年和儿童,临床主要症状为局部疼痛、压痛,软组织肿块或肿胀。实验室检查白细胞总数正常或略增高,但分类嗜酸性粒细胞增高,红细胞沉降率可增快。处于组织细胞增殖期LCH大多可见层状骨膜反应及软组织肿块,在影像学检查中与骨恶性肿瘤混淆,但随病程进入肉芽肿期与消退修复期,其影像表现呈现出良性病变的特征。病理检查以局限性朗格汉斯组织细胞增多为特点,组织细胞增殖期,病灶内含软而易碎的脂肪和坏死组织;肉芽肿期,组织细胞增多,单核细胞与泡沫细胞多见;消退期,结缔组织增生,病灶发生纤维化或骨化。
2.5 临床治疗 由于极低的发病率,目前尚无制定针对原发于长骨的ERMS的标准治疗方案,目前临床通常按照ERMS常规治疗进行,即手术切除辅以放、化疗,提倡在手术切除前行早期联合化疗,目的在于消除亚临床转移,降低肿瘤细胞活性,减少手术中肿瘤细胞播散[12],常用药物包括长春新碱、环磷酰胺、阿霉索、顺铂等。对于因年幼而无法接受放射治疗的患儿,可采用超剂量联合化疗辅以造血干细胞移植来减少化疗反应,延迟放射治疗开始的时间[13]。本组患者术后均采用长春新碱+环磷酰胺进行治疗,患者1于术后16个月出现双肺转移,第19个月死于全身多器官衰竭;患者2术后在我院进行2次化疗后,遂回老家治疗,不能继续追踪。总体上骨原发性ERMS恶性程度高,预后较差,早发现、早治疗可延长患者生存期。
综上所述,四肢长骨原发性ERMS为罕见的高度恶性肿瘤,临床多以患肢疼痛而就诊,影像学检查具有一般原发恶性骨肿瘤表现,病理检查中镜下细胞形态表现结合免疫组织化学中的Myoglobin、Vim、Desmin与SMA四种抗体阳性表达即可确诊,临床治疗以手术(具有手术适应证)切除病灶为主,辅以放、化疗及其他治疗方法可延长患者生存期。

