黄土高原刺槐林土壤酶化学计量沿着环境梯度变化
张 鹏, 王国梁,2
(1.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100; 2.中国科学院 水土保持研究所, 陕西 杨凌 712100)
土壤酶是土壤生态系统的重要组成部分,主要是由土壤微生物合成分泌的高效催化物质[1]。土壤微生物通过牺牲最小化的营养成本合成土壤酶,从而获得可吸收的矿物元素、低分子有机物以及能量,完全符合细胞经济学[2]。土壤酶广泛参与的地下生态系统中的生化反应过程,在整个地球化学物质循环过程中起到了至关重要的作用[3]。在过去的很长时间里,人们集中于对不同生态系统土壤酶动力学研究[4],例如对草地生态系统、森林生态系统酶活性的研究。近年来,由于生态化学计量学的兴起,通过研究生物体元素的关系,探索生态过程中多种化学养分元素和能量平衡,已经成为生态学研究的重要措施[5]。前人从化学计量学角度主要侧重于区域和生态系统尺度的研究[6],以揭示植物的生物量,养分循环和元素限制等方面的机理。全球气候变化显著影响着整个生态系统,全球大气的氮(N)、磷(P)沉降,气候变暖,降水变化等一系列气候变化改变了C,N以及P循环酶的相对丰度及其相应化学计量特征[7]。Sinsabaugh等发现,土壤pH值、质地、土壤养分等影响着土壤酶化学计量比[8];此外生物因子对土壤化学计量有着显著影响,微生物量(C∶N∶P)化学计量影响土壤微生物产生相应土壤酶,以便微生物在复杂的土壤有机质中获取更为有利的营养物质[9];气候对土壤酶化学计量比影响前人有过一定的研究,但降水量、气温对土壤酶的影响并没有得到一致的结果[1,10-11]。
土壤微生物量(SMB)是土壤健康的重要指标,在生态系统可持续性中发挥关键作用。生态系统即使在受到干扰后,如果具有较高微生物多样性和生物量依然可以通过微生物缓冲来维持生态稳定[12]。在前人的研究中我们得知,大尺度范围内,气候因子、土地利用类型和主要植被组成是影响不同生态系统类型中SMB变异的关键因素[13]。小尺度范围,枯枝落叶和细根投入的数量和质量差异以及相关营养物质的特异性是影响整个生态系统中SMB的关键驱动因素[14]。由于生态化学计量学的引入,SMB化学计量比引起了人们的重视。与土壤养分相比,SMB化学计量比相对稳定,尤其当SMB化学计量比不随土壤养分化学计量的变化而变化时,认为其处于稳定状态[15]。根据前人的研究,气候对SMB化学计量稳态的影响一直以来没有统一的结论[13]。因此在不同环境梯度下SMB化学计量研究显得尤为重要。
黄土高原是在过去很长时间里农牧业的生产,导致数百万公顷土地退化,生态环境脆弱,极易受到环境气候变化影响[16]。在不同的环境气候条件下,各环境因子对土壤酶活性影响程度不一。本文以黄土高原刺槐林为研究对象,通过探讨不同环境梯度下各因子与土壤酶及其化学计量特征之间的关系,为黄土高原人工林土壤养分平衡提供有效借鉴。
1 研究区域与研究方法
1.1 研究区概况
在黄土高原地区由北向南,选取神木、绥德、安塞、淳化(108°31′—110°29′E,35°24′—38°44′N)刺槐林生态系统。年均温9~10℃,多年极端最低气温-24~-29℃,多年最高气温36~42℃;年均降雨量在390~585 mm,多年年最少降雨量250~347 mm,多年最多降雨量584~879 mm,属于半湿润区到半干旱区过渡区,以大陆性季风气候为主,四季分明,区域性小气候明显;平均海拔1 100~1 200 m,坡度25°~30°;土壤主要以黄绵土、沙黄土为主;森林覆盖率35%~45%,郁闭度0.5~0.7,胸径10~20 cm,群落物种主要优势种刺槐(Robiniapseudoacacia),林下灌木以连翘(Forsythiasuspensa),黄刺玫(Rosaxanthina)等为主;草本以长芒草(Stipabungeana)、披针叶苔草(Carexlancifolia)、黄蒿(Artemisiascoparia)、凤尾菊(Saussurearomuleifolia)等为主,各样点土壤类型、年均温、降雨量等样地信息见表1。
1.2 研究方法
1.2.1 土壤采样 于2017年9月沿环境梯度选定神木、绥德、安塞、淳化4个地区,根据林地立地条件,选择海拔、坡向、坡度相似的,大小为20 m×10 m的5块样方(每块样方相距至少20 m)。每个样方内使用土钻“S”型随机取10~15个位点的0—20 cm土层土壤。将土壤样品去除可见的根和石砾,并将这些样品混合一起。在现场取样的过程中,样品在4℃下储存在便携式冰箱中。回到实验室后立即对土壤进行含水量(SWC)测定。新鲜土壤样品通过2 mm筛网,并分为两个子样品。一份子样品在4℃下储存,进行土壤酶活性和土壤微生物量测定;另一份在空气中自然风干,然后通过0.25 mm筛网用于土壤有机碳(SOC),全氮(TN)和全磷(TP)等土壤养分的测定。


表1 中国黄土高原地区采样点主要信息

表2 环境因子与微生物量沿着环境梯度的变化
1.2.3 微生物生物量测定 通过氯仿熏蒸提取法[17]测定微生物量碳(MBC)和氮(MBN)。称取两份25 g土壤样品,一份用40 ml的0.5 mol/L的K2SO4溶液浸提,另外一个子样品用氯仿在真空干燥器中熏蒸24 h。然后采用与未熏蒸样品相同的提取过程。使用总有机碳分析仪测定浸提液中的总溶解有机碳和总溶解氮。土壤微生物量磷(MBP)通过氯仿熏蒸提取法测定。称取两份2.5 g土壤样品,一份用50 ml的0.5 mol/L的NaHCO3(pH=8.5,用NaOH调节)提取,熏蒸程序与上述MBC和MBN一致,并用紫外分光光度计测定浸提液中的总溶解磷。MBC,MBN以及MBP的计算公式:
MBC=ΔMC/kC;MBN=ΔMN/kN;MBP=ΔMP/kP
式中:ΔMC为熏蒸和未熏蒸的总溶解碳的差值;kC为转换系数0.38;ΔMN为熏蒸和未熏蒸总溶解氮的差值;kN为转换系数0.45;ΔMP为熏蒸和未熏蒸的总溶解磷的差值;kP为转换系数0.4。
1.2.4 酶测定 本文测定以下4种:β-1,4-葡萄糖苷酶(BG)、β-N-乙酰氨基葡萄糖苷酶(NAG)、亮氨酸氨肽酶(LAP)和碱性磷酸酶(AP)根据标准荧光技术的修改版本测量[18]。称取3 g土壤在125 ml的Tris-HCl碱缓冲液中,并在震荡器均化10 min。调节Tris碱缓冲液的pH值以接近土壤样品的pH。将土壤浆液(200 μl)加入到96孔微量培养板中,然后向每个孔中加入50 μl对每种酶特异的200 μmol/L的荧光底物代用物。使用6个重复测量每个样品。每个样品包括土壤浆液和4-甲基伞形酮(MUB)或7-氨基-4-甲基香豆素(AMC)标准曲线(0,2.5,5,10,25,50,100 μmol/L浓度)的淬灭控制重复。亮氨酸氨基肽酶的参考标准是AMC,剩余的酶是MUB。将微孔板在25℃下孵育3 h。使用酶标仪测定荧光量,激发365 nm,发射450 nm。
1.2.5 数据分析 相关统计均在SPSS 23.0中进行并计算所有因子算数平均值和标准误差,同时对微生物量和酶及其化学计量和影响因素进行Pearson相关性分析;使用显著差异(LSD)检验不同地区土壤酶活性和化学计量之间的差异;使用Origin 9.0进行绘图;使用Canoco5.0进行冗余分析(RDA)。
2 结果与分析
2.1 环境因子与微生物量沿环境梯度的变化
环境梯度对黄土高原刺槐林地环境因子与微生物量有着不同程度的影响(表2)。环境因子中,由北到南土壤黏粒、粉粒、SWC、速效养分、全量养分均呈增加趋势;沙粒含量、土壤pH呈降低趋势。而土壤化学计量比率沿环境梯度变化并不统一,C/N,C/P分别在9.72~14.01,6.76~16.86之间波动;N/P在0.69~1.56之前呈先减小后增加变化。由北到南MBC,MBN,MBP含量分别为23.08~95.04,2.86~7.95,0.53~0.92 mg/kg;MBC,MBN,MBP,MBC/MBP均呈增大趋势;MBC/MBN在7.65~12.06范围波动,MBN/MBP在5.47~12.30之间呈先减小后增加趋势。
2.2 土壤酶活性沿着环境梯度的变化
沿环境梯度土壤酶活性变化如下:BG,LAP,NAG和AP活性分别为28.72~110.66,1.60~3.32,6.84~10.25,14.17~32.60 [nmol/(g·h)];LAP活性呈增加趋势;BG,NAG,AP活性先增加后减小而后又增加。除NAG活性在绥德最高外,其他3种酶活性均在淳化地区最高(图1)。

注:图中数值为平均值±标准误,不同字母表示不同地区存在着显著差异(p<0.05,n=5)。
2.3 土壤酶活性化学计量沿着环境梯度的变化
表3表明,沿环境梯度由北到南,BG/(LAP+NAG)、BG/AP、(LAP+NAG)/AP分别为3.15~6.46,1.5~2.96,0.41~0.70;BG/(LAP+NAG)先减小后增大,淳化最高;BG/AP先减小后增大,在神木最高;(LAP+NAG)/AP呈持续减小趋势。在对不同采样点土壤酶活性数据进行标准化处理后,淳化刺槐群落的lnBG/ln(LAP+NAG)显著高于其他3个采样点(p<0.05);lnBG/ln(AP)在绥德最高但其他采样点不存在显著性差异;ln(LAP+NAG)/lnAP在神木最高同样不同采样点不存在显著性差异。
2.4 土壤微生物量与酶及其化学计量比与影响因子之间的关系
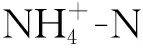

表3 土壤酶活性化学计量沿着环境梯度的变化

图2 土壤酶及微生物量与各因子之间的关系(RDA)
将土壤酶活性与微生物量化学计量比作为响应变量,将生物及环境因子作为解释变量进行冗余分析(RDA),分析结果表明:变量总解释率达到72.18%,其中第一轴的变量解释率52.91%,第二轴的变量解释率19.27%;并且A-P,TN分别解释土壤酶与微生物量化学计量比的30.5%,19.1%(图3)。相关性分析表明,MBC/MBN、BG/(LAP+NAG)与MAT、MAP、SWC、A-P、SOC、TN、C/P、N/P呈显著正相关,与pH呈极显著负相关;MBC/MBN与MAT、MAP、A-P呈显著正相关;MBN/MBP与A-P呈显著正相关;BG/AP与TN、N/P呈正相关;(LAP+NAG)/AP与MAT、MAP、黏粒、粉粒、SWC、A-P、SOC、TN、C/P、N/P呈显著正相关(附录)。
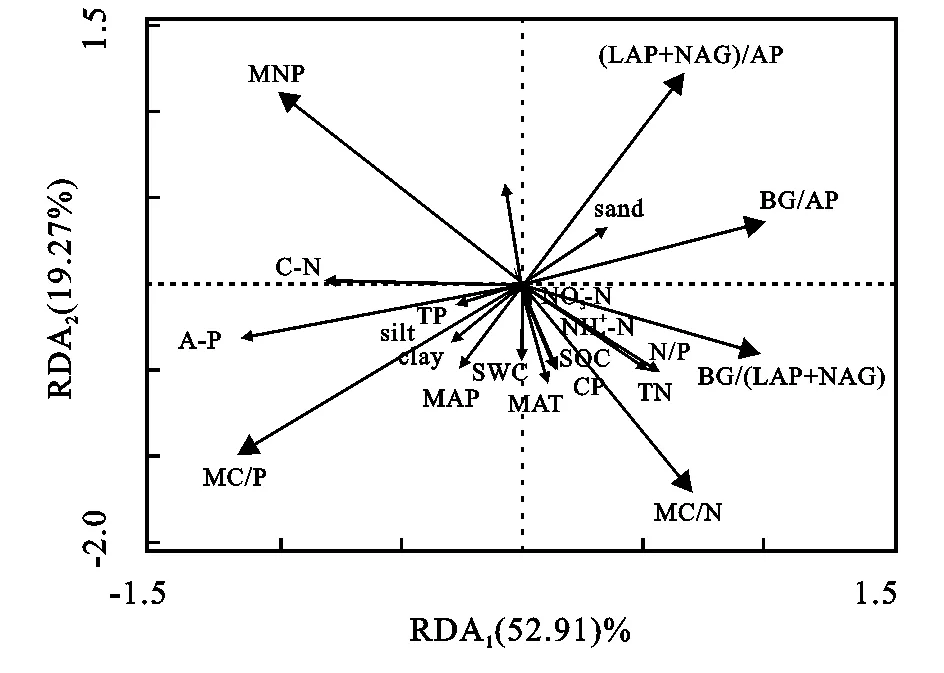
图3 土壤酶及微生物量化学计量与各因子之间的关系(RDA)
3 讨 论
3.1 土壤酶化学计量特征及微生物养分限制
黄土高原属于干旱贫营养区,土壤酶活性对土壤养分循环、能量流动以及地下生态系统稳定性起着至关重要的作用[9,19]。微生物可以通过调节其自身代谢,活化土壤养分,缓解对土壤中N,P等养分的限制,从而适应不同生境[20]。我们可以通过土壤酶表达程度以及酶化学计量特征,探究微生物应对土壤养分限制的对策[3]。
通过对土壤酶化学计量比的对数转化得出其比值为1∶0.65∶1.25,这偏离了全球生态系统的1∶1∶1的比例。本研究中土壤酶活性N/P(0.52)高于全球生态系统酶活性比(0.13)[21],表明黄土高原刺槐林地的微生物代谢往往对N源酶的投入低于P源酶,这项研究的结果与微生物的资源分配观点一致,微生物通过最佳分配其养分储备以获取最有限的资源[22]。人们普遍认为,温带生态系统中氮的有效性普遍较低[8],但是本文研究黄土高原刺槐林地以P限制为主。也就是说,当P在土壤中受限时,微生物将增加P源酶的产生。微生物在C,N和P的获取中进行权衡,以响应基质和营养资源供应的变化,表明土壤酶化学计量在黄土高原刺槐林地并不是处于稳态,而是资源依赖。不仅如此,土壤TP在不同地区的含量均处于较低水平(表3),而且在碱性土壤中P元素与土壤中Ca2+,Mg2+等离子易发生螯合反应,加重土壤P元素限制[7]。但它在限制微生物活动中的作用可能因不同的采样点而异,表明在微生物群落主要在其他采样点受到限制。同时,先前的研究表明微生物化学计量比和土壤酶活性比率具有耦合关系。然而,我们的结果表明微生物比的变化明显与土壤酶化学计量比不一致(表3)。研究结果表明虽然黄土高原N含量同样也处于较低水平,本研究中与全球生态系统土壤酶活性C/N基本一致,并且影响土壤酶化学计量主要影响因素并不是TN。造成这一现象主要原因可能是刺槐是豆科植物,由于根瘤菌的固氮作用,减轻了刺槐林N元素的限制。综上所述,黄土高原刺槐林群落主要受P元素限制。
3.2 驱动土壤酶活性及其化学计量比变化机制
在黄土高原刺槐林生态系统土壤酶活性及其化学计量比主要受到土壤养分的影响。土壤养分通过影响土壤酶的生化特性和调节酶分泌来影响土壤酶活性[23]。虽然土壤P是主要的限制养分元素,由于不同的采样点均处于较低水平并且不存在显著性差异,对土壤酶活性及其比率均未产生显著的影响。在本研究中,RDA结果表明,土壤酶、微生物量及其化学计量比分别与N/P、A-P、TN有着显著性正相关关系,此外与土壤SOC,C∶N,C∶N呈显著正相关,说明不同采样点在P元素水平一致的情况下,在随着SOC,TN的变化显著影响土壤酶活性。由北到南,土壤MBC含量下降,土壤酶C∶P比值增加。当土壤N和P的有效性较低时,土壤微生物会增加参与N和P循环的酶的产生,以满足他们对这些营养素的需求。这一过程导致由北到南,黄土高原刺槐林的土壤BG和AP活动降低。
土壤酶活性还受到年平均温度(MAT)和降水(MAP)的影响。气候因素通过影响微生物养分需求和土壤养分有效性来影响土壤酶活性和化学计量比。先前的一项研究表明,MAT可能是全球范围内空间变异的主要影响因素[10],随着温度升高,土壤酶活性增加。本文的研究结果也同样证实了这点,土壤酶活性均随着MAT的增加而增加。MAP主要是通过改变土壤含水量(SWC)来影响土壤酶活性,土壤水显著影响底物和抑制性化合物的扩散速率[25]。研究发现土壤酶活性(除NAG)与MAP,SWC呈正相关关系。降水量的增大势必导致土壤养分淋融作用降低,而导致微生物底物减少,从而使得微生物响应营养限制,分泌相应的酶以满足其营养需求[26]。因此,随着MAT和MAP沿环境梯度的增加,土壤AP活性增加,但土壤酶活性(C∶N)和(N∶P)随着MAT和MAP的增加而增高。与全球范围内的结果不同[8]。造成这一结果主要原因可能是研究区为刺槐生态系统,土壤中N限制较小,N源酶尤其是(NAG)受到环境梯度影响较小,而C源酶与P源酶受到较大,其中BG随着MAP,MAT增大而增大。P源酶由于随着环境梯度的增加,P限制的缓解,AP的分泌相对较少,使得出现以上结果。
土壤pH值对土壤酶活性有着重要影响,不同的土壤酶活性最适pH不同。本文研究结果土壤酶活性(除NAG)及其比率与pH均呈极显著负相关。Sinsabaugh等研究表明土壤AP,NAG活性与土壤pH值之间存在负相关关系,这与本文的结果一致。同时,土壤BG与土壤pH之间存在显著负相关,这与前人得到的无明显关系结果不一致[8,24];造成这种情况的主要原因可能是在不同的研究区域中,土壤pH处在不同范围,Sinsabaugh[8]等的研究范围则在4到8.5之间。而本文的研究区集中在碱性土壤范围内。在主要受P限制土壤中,土壤微生物将分泌更多的AP,以满足高pH土壤中微生物对于土壤P的需求,从而导致土壤AP活性与土壤pH之间呈负相关,土壤酶化学计量N/P也与土壤pH呈负相关。微生物生物学研究还表明,土壤pH值是不同尺度空间变异的主要驱动因素[22]。在研究区随着环境梯度增加,土壤pH增加,pH影响微生物代谢活动从而进一步影响酶活性。
本文发现土壤酶化学计量C∶P和N∶P与土壤C∶P和N∶P比值呈正相关。这些结果与Sinsabaugh等研究结果一致[8]。土壤酶作为生物催化剂,主要来自土壤微生物、根系分泌物和植物和动物残留物的分解[7]。土壤酶活性化学计量随着土壤和微生物量化学计量变化而发生变化。因此,微生物量化学计量的变化可能对土壤酶化学计量有影响[25]。结果表明,随着土壤养分的有效性,微生物量碳(MBC)会影响土壤的土壤酶活性。通过调节土壤微生物的酶产量来改变其土壤养分有效性的变化。微生物量养分的化学计量不随着土壤养分的变化而变化,说明微生物化学计量处于相对稳态。本文的研究结果表明,沿环境梯度土壤酶活性化学计量模式是通过土壤—微生物反馈与土壤养分循环共同影响。
4 结 论
ln(BG)∶ln(LAP+NAG)∶ln(AP)比值为1∶0.65∶1.25,这偏离了全球生态系统的1∶1∶1的比例,这些关系之间的差异受MAP、土壤N/P,A-P以及TN等因子的显著影响;黄土高原刺槐林生态系统普遍主要受到P限制,N限制相对较弱,同时,酶活性化学计量处于非稳定状态,土壤微生物量化学计量处于相对稳态。我们的研究结果为森林生态系统中土壤酶活性和养分循环控制提供了有效的借鉴。

