急性胰腺炎患者血小板微粒水平变化及其对中性粒细胞胞外捕获网形成的作用
祁琴琴, 杨 彬, 李会会, 鲍峻峻, 李鸿晔, 王兵兵, 梅 俏
安徽医科大学第一附属医院 消化内科, 合肥 230022
急性胰腺炎(acute pancreatitis,AP)临床上多表现为轻型[1],但有20%~30%的AP患者可发展成重症急性胰腺炎(severe acute pancreatitis,SAP) ,SAP病死率高达30%[2]。胰腺炎发病机制尚未完全阐明[3-4],中性粒细胞激活胰蛋白酶引起胰腺组织损伤[5-6],在AP发病过程中发挥关键作用。研究[7]表明,血小板在中性粒细胞促进胰腺损伤的过程中具有重要影响。血小板可以诱导胰腺内皮细胞表达P-选择素,促进中性粒细胞活化并介导血小板依赖的胰腺组织浸润。同时,血小板通过表面表达的Toll样受体(TLR)4,可结合中性粒细胞释放中性粒细胞胞外捕获网(neutrophil extracellular traps,NETs)[8-9],加重胰腺组织损伤。
胰腺炎患者发病过程存在血小板数量增加或减少的现象[10-11],血小板活化脱颗粒,释放活性物质,加重胰腺炎症损伤过程[12]。血小板活化过程中可形成大量血小板微粒(platelet microparticles,PMPs)[13-14],PMPs功能与活化的血小板相似,含有血小板膜组分及大量损伤相关分子模式(damage associated molecular patterns,DAMPs),如高迁移率族蛋白B1(high mobility group protein, HMGB1)、P-选择素和GPⅡb(CD41)等,促进炎症细胞的募集和黏附,释放蛋白水解酶及氧自由基等损伤胰腺实质细胞[15-16]。PMPs在急性心肌梗塞、类风湿关节炎、慢性肾脏病等患者中水平均明显升高[17-19],表明PMPs与机体炎症反应调节密切相关。但在胰腺炎过程中PMPs水平的改变尚不清楚。因此,本文通过检测胰腺炎过程中PMPs水平的改变,以及PMPs刺激中性粒细胞释放NETs的能力,探讨PMPs参与AP病理生理过程的作用机制。
1 资料与方法
1.1 研究对象 选择2018年9月-2019年8月本院收治的AP患者55例,其中轻症急性胰腺炎(mild acute pancreatitis,MAP)26例,中重症急性胰腺炎(moderately severe acute pancreatitis,MSAP)17例,重症急性胰腺炎(SAP)12例,AP诊断标准参考亚特兰大分类新标准共识[20]。另选取15例健康体检查为对照组。本研究经安徽医科大学第一附属医院伦理委员会批准(批号:PJ2018-12-17),所有研究对象均签署知情同意书。
1.2 PMPs分离 收集患者入院后(24 h内)次日晨血5 ml于柠檬酸钠抗凝管中,以1000 r/min离心10 min获取富血小板血浆,再将其以3500 r/min离心15 min,获取贫血小板血浆(PPP),-80 ℃保存。
1.3 PMPs检测 将PPP冰上解冻,抽取50 μl PPP,加入5 μl CD61-PE充分混合孵育20 min,加入5 μl AnnexinV- FITC和400 μl Bindbuffer孵育20 min,再加入40 μl Flow-CountTM荧光计数微球充分混合,采用流式细胞仪检测PMPs。使用5 μl兔抗人PE-IgG1及5 μl FITC-IgG1作为对照。CD61-PE 及 AnnexinV- FITC双阳性为PMPs,根据荧光计数微球计算PMPs水平。
1.4 NETs形成能力的检测
1.4.1 ELISA检测髓过氧化物酶(MPO)、中性粒细胞弹性蛋白酶(NE)和组蛋白H3 留取健康体检者晨血4 ml于EDTA抗凝管中,按照外周中性粒细胞分离试剂盒操作。在细胞培养板中置入圆形玻片,加入500 μl细胞悬浮液。分为两组,一组加入250 μl AP患者的PMPs,另一组加入等量生理盐水作为对照组。于37℃,5%CO2中培养6 h,滴管吸取上清液700 μl于EP管中, 1500 r/min离心5 min,再次取上清液。采用 ELISA方法检测上清液中MPO、NE、组蛋白H3的水平。
1.4.2 激光共聚焦显微镜下观察NETs 取出上述细胞培养板底的圆形玻片,细胞面向下放置于载玻片,滴加多聚甲醛溶液(4% PFA)固定10 min,PBS洗涤3次, 0.05% Triton×300 μl室温下破膜1min,用1%BSA封闭1 h。兔抗人CD61抗体(一抗)湿盒中4 ℃孵育过夜,PBS洗涤 5 次。加山羊抗兔IgG-H&L(二抗)37℃避光孵育 1 h,PBS缓冲液洗涤 5 次。再使用Alexa Fluor555标记组蛋白H3和DAPI在室温下避光孵育 15 min进行免疫荧光染色,PBS 洗涤 3 次,封片,暗盒放置。激光共聚焦显微镜观察NETs分布情况。
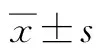
2 结果
2.1 一般资料 MAP组男22例,女4例,年龄(42.58±14.31)岁;MSAP组男12例,女5例,年龄(50.88±17.97)岁;SAP组男8例,女4例,年龄(48.25±18.12)岁;对照组15例,男11例,女4例,年龄(47.21±16.54)岁,各组性别、年龄差异均无统计学意义(P值均>0.05)。55例AP患者中胆源性17例,高脂血症型21例,自身免疫型1例,混合型6例,其他10例。
2.2 AP患者中PMPs水平比较 与对照组相比[172.00(148.25~204.25)个/μl],MAP、MSAP、SAP组PMPs水平明显升高[179.50(145.00~308.750)个/μl、1117.50(483.00~2488.25)个/μl、1848.00(1216.50~2562.00)个/μl,H值分别为4.348、23.186、19.292,P值均<0.05]。与 MAP 组、 MSAP 组比较,SAP组PMPs水平明显升高(H值分别为29.068、4.709,P值均<0.05)(图1)。
2.3 AP患者中PMPs水平与临床特征的相关性 AP患者的PMPs水平与APACHEⅡ评分、BISAP评分、Ranson评分均呈正相关,且差异均有统计学意义(r值分别0.636、0.508、0.430,P值均<0.001)。

注:a,对照组; b,MAP组; c,MSAP组; d,SAP组。
2.4 AP患者中PMPs促进NETs形成能力的检测 与对照组对比,AP组中MPO、NE和组蛋白H3水平均明显增加(P值均<0.001)(表1)。
激光共聚焦显微镜观察可见AP组中性粒细胞释放NETs形成,对照组未发现明显NETs形成(图2)。

表1 AP组和对照组MPO、NE、组蛋白H3水平比较
3 讨论
由于AP常伴发全身炎症反应和多器官功能障碍,SAP病死率明显升高。研究[21]表明,活化的血小板分泌多种炎症细胞因子和趋化因子,募集中性粒细胞、单核细胞、淋巴细胞至靶器官,加重器官炎症过程,因此,血小板活化在胰腺局部炎症和远端器官衰竭中具有重要影响。Rahman等[22]研究表明血小板CD40L可介导脓毒症引起中性粒细胞活化且募集于肺组织,引起肺水肿。Wetterholm等[23]发现在AP中血小板衍生的趋化因子CXCL4刺激中性粒细胞积聚,消耗血小板可以降低CXCL4水平,减少中性粒细胞募集、IL-6分泌和胰腺组织损伤。
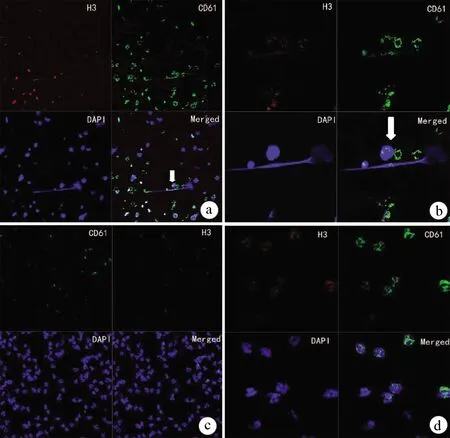
注: a-b,AP组,图a(×20)中可见中性粒细胞细胞破坏释放NETs,如白色箭头所示;图b(×63,油镜)中白色箭头所指为NETs;c-d,对照组,未见NETs。
图2激光共聚焦显微镜下AP组和对照组中NETs的形成
PMPs释放是血小板活化过程的重要标志[24], PMPs具有与活化血小板相似的功能,含有血小板膜组分及大量DAMPs如HMGB1、P-选择素和GPⅡb(CD41)等,促进炎症细胞的募集并黏附于靶器官[25]。PMPs增高与许多炎症免疫性疾病相关。Boilard等[18]研究发现类风湿性关节炎患者血清中 PMPs 增加,关节腔滑膜液中PMPs水平高于血清中 PMPs水平,但在骨关节炎患者关节腔滑膜液中未检测到PMPs,提示血小板可能通过炎症关节的血管进入关节腔,胶原活化血小板释放 PMPs。Nadaud等[26]发现肺动脉高压患者中PMPs水平增多, PMPs促凝能力大于活化的血小板,增加血栓形成的风险。本研究发现AP患者中PMPs水平升高,且SAP组PMPs水平明显高于MSAP、MAP组, PMPs与ARECHEⅡ、BISAP、Ranson评分呈正相关,表明PMPs参与AP进展过程,可作为AP疾病严重程度评估的指标。
研究[27]表明,胰腺组织局部可检测出NETs的组分MPO、NE、组蛋白、DNA 等。Brinkmann等[28]发现中性粒细胞胞外NETs是以 DNA为骨架,镶嵌MPO、NE、组蛋白等蛋白质。NETs参与清除外源性病原体,同时参与体内无菌性炎症过程如自身免疫性疾病等[29-31]。Merza等[32]发现通过牛磺胆酸盐引起的的小鼠胰腺炎中,可检测到胰腺组织中NETs形成。Bilyy等[33]发现在严重坏死的胰腺组织中, NE和瓜氨酸化组蛋白H3均阳性。Leppkes等[34]观察到中性粒细胞可能在炎症条件下进入胰管并形成NETs,造成胰管内阻塞,促进AP发生。在急性肺损伤小鼠模型中发现,活化的血小板能够刺激中性粒细胞释放 NETs,抑制血小板活化可以减少 NETs 的释放和组织损伤[35]。本研究发现来源于AP患者的PMPs,在体外与健康人中性粒细胞共同培养后可观察到NETs形成,同时发现AP组中MPO、NE和组蛋白H3较对照组水平增高,可能在AP患者中导致胰管阻塞,进一步加重胰腺炎症过程。Murthy等[27]研究表明,AP患者血中NETs形成的标志物与对照相比显著升高,重症AP较轻度AP升高明显,与本研究结果相符。
综上所述,AP中血小板活化生成PMPs,刺激中性粒细胞释放NETs阻塞胰管,加重AP严重程度,表明PMPs可作为AP疾病严重程度评估的指标,降低 PMPs形成NETs能力可能有助于抑制胰腺的炎症损伤过程。

