外来捕食者克氏原螯虾对黑斑侧褶蛙不同发育阶段幼体表型与运动能力的影响
樊晓丽, 林植华
丽水学院生态学院, 丽水 323000
外来物种入侵常常极大地影响本土物种的生态系统功能,导致种群数量下降从而对生物多样性构成重大威胁[1- 4]。克氏原螯虾(Procambarusclarkii)俗称小龙虾,原产于美国南部和墨西哥北部,国外称之为红沼泽螯虾(Red swamp crayfish),目前它已被作为一种重要的水产经济资源物种扩散到世界各地[5- 6]。我国于1929年由日本引进,现已在十几个省市的河流、池塘、沟渠、水田等水体中形成野外种群,在部分地区已成为优势种[7]。已有研究表明,克氏原螯虾的入侵对本土的水生植物、无脊椎动物等生存造成了极大威胁,显著降低引入地的生物多样性,成为著名的入侵物种之一[8-10]。该物种通过直接捕食两栖类卵和幼体,降低两栖类幼体活动水平、改变成体的繁殖行为来阻止其成功交配以及产卵,破坏水生植物而使两栖类的产卵场受到破坏,从而造成本土两栖类种群数量下降[8- 13]。
猎物的行为或表型可塑性可能是其适应入侵性捕食者所导致的快速环境变化的关键机制[14- 15]。在长期的进化过程中,许多动物通过调节自身行为或产生防御性表型来躲避捕食者捕食或降低捕食压力以保护自己免受或减少伤害的行为,这是生物体对生存环境的一种动态适应过程。已有研究表明,无尾两栖类是研究捕食者诱导的行为与表型可塑性的最常见生物之一,两栖类幼体既能直接感知捕食者诱导物,又能感知由受伤同种个体所释放出的警报信息素来觉察捕食风险的存在[16],通过降低自身活动水平[17- 18]、形成集群[19]、改变微生境利用[20]、改变体型与体色[21- 22]、增加尾鳍的相对高度与远端颜色[23- 26]、改变生活史[27],或者这些响应的各种组合,来避免被察觉或攻击其尾鳍的末端而保护其体腔内的重要器官,从而提高其存活率降低被捕食的风险。对于入侵捕食者,许多无尾两栖类幼体由于缺乏与入侵捕食者克氏原螯虾的共同进化史,故不能识别捕食信号进而诱导产生适应性的行为与形态响应,这是克氏原螯虾造成全球本土两栖类数量下降的主要原因[9, 28, 29]。但是,某些无尾两栖类幼体经过足够长的共同进化时间,已经演化发展成先天具有觉察和避免克氏原螯虾的能力[30- 31]。因此,学会识别入侵捕食者诱导物的能力对于栖息在入侵捕食者所形成的新生态环境中的两栖类种群来说是非常关键。
对于无尾两栖类来说,生活史的起点是受精卵,两个关键生活史转折点分别是幼体的孵出和变态,这两个时期均能对捕食风险表现出一定程度的表型可塑性响应[32- 33]。研究表明,为了逃避被捕食无尾类往往付出提早孵化形成较小个体的即时代价[34- 37]。无尾类幼体早期发育过程中所经历环境条件的影响可能从生活史的一个阶段延续到随后的发育阶段,即孵化阶段对捕食者所表现出来的表型可塑响应可能具有延滞效应(Carry-over effects),即能影响其变态后(如大小、形态或蝌蚪期)对捕食风险诱导的可塑响应,具体可通过改变蝌蚪期生长率和变态时间[38- 41]。目前许多研究主要集中来自无脊椎捕食者,如水蛭(Haemopsissanguisuga)和黄蜻幼虫(Pantalaflavescens)的捕食风险对蝌蚪到变态这一发育阶段的影响[42- 43],少量的研究关注克氏原螯虾诱导的无尾两栖类孵化期的表型变异以及如何影响随后的蝌蚪期直到变态幼蛙的形态特征及运动能力。
黑斑侧褶蛙(Pelophylaxnigromaculatus)隶属于两栖纲无尾目蛙科侧褶蛙属,通常在3至6月选择在持久性池塘边缘产下卵团,受精卵被强黏性的卵胶膜包裹着,窝卵数约为3000—5000枚[4,44],在其繁殖水体中同时生活着捕食无尾类卵和蝌蚪的克氏原螯虾,故其幼体往往面临克氏原螯虾的捕食风险。本文试图将黑斑侧褶蛙受精卵暴露于不同捕食风险条件下,探讨入侵捕食者克氏原螯虾对中国南部丽水地区黑斑侧褶蛙不同发育阶段幼体的表型、运动能力及行为的短期和长期影响,从而为无尾两栖类的反捕食机制和生物多样性保护提供一定的基础数据。
1 材料与方法
1.1 实验动物的采集
1.2 实验设计与管理
随机取出300枚受精卵按窝别平均分配到3个塑料箱(320 mm × 210 mm × 110 mm,80 mm水深)内。箱内捕食风险处理方法如下:空白对照组(NP:无捕食者处理)、实验组1(EP1:捕食风险存在2 d)和实验组2(EP2:捕食风险一直存在)。为了避免克氏原螯虾直接捕食黑斑侧褶蛙受精卵(或后续实验中的蝌蚪),把其关在人工缝制的透明塑料网状笼(直径60 mm,网眼直径1 mm)内,每48 h给笼内的克氏原螯虾喂食6只黑斑侧褶蛙蝌蚪,保证实验组的水体溶液中存在同种受伤个体被捕食者捕食而由皮肤释放出的示警刺激物,以此形成捕食风险[30]。整个实验过程的气候室温度设为25 ± 1℃,光周期12L∶12D。
所有实验组蝌蚪在同一天从卵胶质里孵化出来,即孵化期无明显差异,此时孵出个体很脆弱,待其生长到第三天时,从每个实验组随机捞出40只蝌蚪进行形态特征测定。将蝌蚪轻轻移入底部有标尺的培养皿内,加入适量水,蝌蚪身体处于完全舒展状态,用Sony DSC-T100数码相机拍摄蝌蚪的俯视图,用JmageJ 1.44p软件测定蝌蚪的体长(吻端到泄殖腔的距离)、尾长(尾鳍基部到末端的距离)和尾肌宽(尾鳍基部肌肉的宽度)[41,45-46]。刚孵出蝌蚪常处于倾斜状态且尾鳍发育狭窄,故无法测定尾鳍高和尾肌高。后将每个实验组分成4个重复组,密度设为15只/箱(2.79只/L),保持原有捕食风险继续饲养。
蝌蚪饲养过程中,每48 h粉质牛蛙饲料(0#,天邦牌特种水产配合饲料)进行充足喂食,避免食物水平对蝌蚪发育的影响。每周用曝气24 h后的自来水进行完全换水,按一定顺序调换塑料箱位置以减少位置形成的温度差异影响。实验期间,每天观察克氏原螯虾和黑斑侧褶蛙蝌蚪的存活情况,替换死亡的克氏原螯虾个体,若黑斑侧褶蛙蝌蚪出现死亡,及时捞出后,用大小相似剪尾标记蝌蚪个体加以补充以保持密度不变(补样个体不进行统计分析)。以黑斑侧褶蛙蝌蚪出现一只前肢(42期)作为变态标志,从实验开始到蝌蚪出现一只前肢所经历的天数记为变态期。一旦开始出现,每天观察3次,将每只变态个体及时捞出,单独编号后置于盛有水深为5 mm的塑料杯内,杯口用网眼为1 mm的网布封住,避免幼蛙逃逸,待其尾部完全消失[46]。实验结束后,所有剩余蝌蚪和幼蛙放回到采集水体中。
1.2.1黑斑侧褶蛙蝌蚪的游泳能力与形态测定
第30天,通过水迷宫视频跟踪分析系统(Morris型,安徽正华生物仪器设备有限公司)检测不同实验组黑斑侧褶蛙蝌蚪的游泳能力。测试时,每只蝌蚪在游泳池内(水温约为25 ℃)适应1 min后,用柳树枝条轻触黑斑侧褶蛙蝌蚪尾鳍基部使其快速游动,记录黑斑侧褶蛙蝌蚪在1 min内的疾游速(mm/s)、平均游速(mm/s)和总路程(mm)。运动测定后,拍摄蝌蚪俯视图、侧面图测定其体长和尾长,用JmageJ 1.44p软件测定蝌蚪的尾鳍高(尾鳍最高处的长度)和尾肌高(尾鳍基部肌肉的高度)[41]。
1.2.2黑斑侧褶蛙蝌蚪的反捕食行为观察
为了检测捕食风险克氏原螯虾对黑斑侧褶蛙蝌蚪活动水平的影响,每隔10天采取瞬间观察法记录不同实验组内的蝌蚪行为,具体时间为4月1日、4月11日、4月21日、5月1日和5月11日。在30 min内每5 min记录黑斑侧褶蛙蝌蚪在水体中的活动状况,当蝌蚪处于游动、摆尾和摄食时被认为处于活跃(游泳)状态[18]。实验操作时观察者安静坐在一侧,保持安静且不随意走动,避免人为影响蝌蚪的活动。
1.2.3黑斑侧褶蛙幼蛙的跳跃能力与形态测定
每只黑斑侧褶幼蛙在室内(25 ± 1℃)内适应10—15 min后,将其放入1%的绿色食用色素溶液中浸湿其四肢,捞出后置于铺有白色纱布的地面上,用柳树枝条轻触其尾杆骨来刺激其跳跃,至少让每只幼蛙跳跃10次以上。通过涂料痕迹来确定跳跃长度,从上一个后肢印迹的末端到下一个后肢印迹的末端之间的距离为一个跳跃,测量出最长三次的跳跃距离(± 0.01 cm),求出平均值[46]。运动测定后,通过轻轻按压幼蛙腹部使膀胱内尿液排空,用吸水纸吸干其体表水分,用Sartorius分析天平称取体重(± 0.0001 g),数显游标卡尺(± 0.01 mm)测定幼蛙体长(从吻端到尾杆骨之间的距离)[46]。
1.3 数据分析
用Statistica统计软件包完成所有数据的统计分析。统计分析前,检验数据正态性(Kolmogorov-Smirnov test)和方差同质性(F-max test)。经检验,数据无需转换符合参数统计的条件。用单因素方差分析(One-way ANOVA)、单因素多变量方差分析(One-way MANOVA)、两因素方差分析(Two-way ANOVA)及后续的Tukey′s检验、线性回归等处理和比较相应的数据。描述性统计值用平均值 ± 标准误(Mean ± SE)表示,显著性水平设置为α= 0.05。
2 结果
2.1 克氏原螯虾对黑斑侧褶蛙刚孵出蝌蚪形态特征的影响
有捕食者和无捕食者处理下的黑斑侧褶蛙刚孵出蝌蚪形态特征的统计性描述见图1。One-way ANOVA结果表明,有无捕食者条件下黑斑侧褶蛙孵出蝌蚪的形态差异显著(Wilks λ=0.48,df=6, 76,P<0.0001)。进一步的Tukey′s test表明,捕食者长期存在条件下黑斑侧褶蛙孵出蝌蚪的体长、尾长和尾肌宽均显著短于无捕食者的空白对照组和捕食者仅存在2 d的实验组(P<0.001),无捕食者、捕食者仅存在2 d的实验组之间的刚孵出蝌蚪体长差异显著(P<0.001),但尾长和尾肌宽差异不显著(P>0.05,图1)。
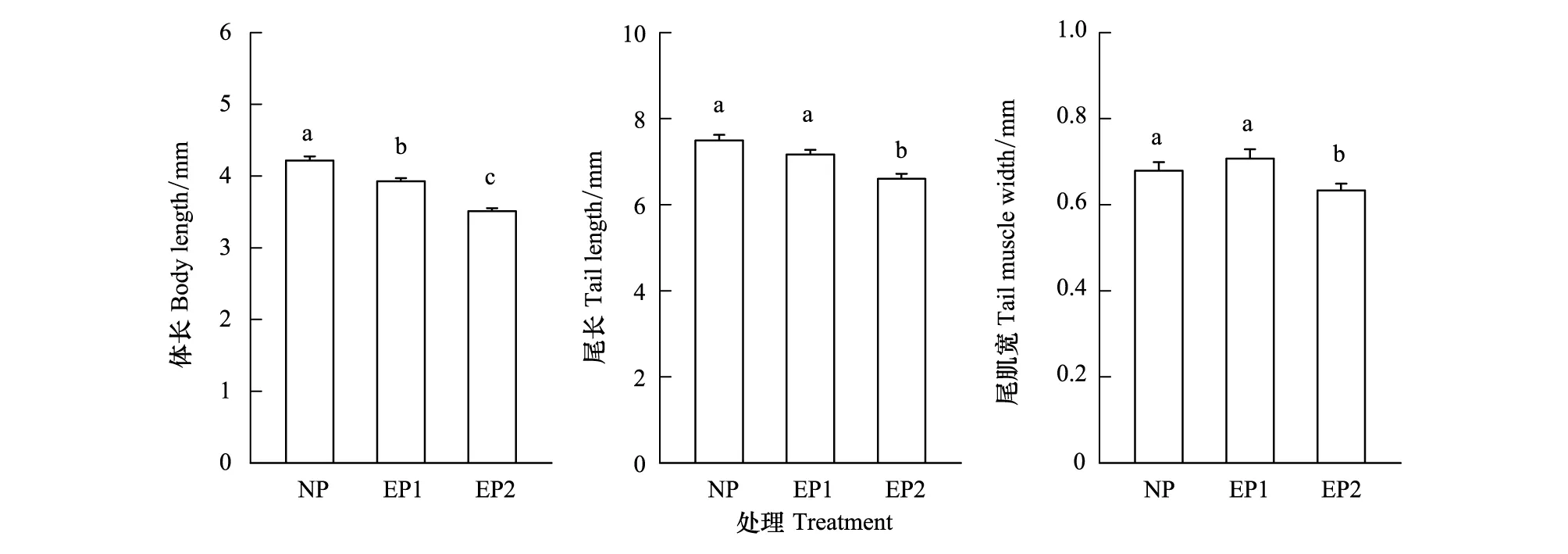
图1 有无捕食者处理下,黑斑侧褶蛙刚孵出蝌蚪的形态特征Fig.1 Morphological characteristics of Pelophylax nigromaculata hatchlings under the presence and absence of predatorsNP表示无捕食者,EP1:捕食者处理2 d,EP2:捕食者一直处理,图中数据用平均值 标准误(范围)表示,小写字母表示组间差异显著,a>b>c
2.2 克氏原螯虾对黑斑侧褶蛙蝌蚪游泳能力与形态特征的影响
有捕食者和无捕食者处理下的黑斑侧褶蛙蝌蚪游泳能力的统计性描述见图2。One-way MANOVA结果表明,有无捕食者条件下黑斑侧褶蛙蝌蚪的游泳能力组间差异显著(Wilks λ=0.79,df=6, 320,P<0.0001)。进一步的Tukey′s test表明,长期捕食者存在条件下黑斑侧褶蛙蝌蚪的游泳总路程和平均游速均显著小于无捕食者和捕食者存在2 d的实验组(P<0.001),无捕食者和捕食者存在2 d的实验组之间差异不显著(P>0.05)。疾游速的组间差异不显著(P=0.265,图2)。One-way ANOVA结果表明,运动能力所检测的黑斑侧褶蛙蝌蚪体长、尾长、尾鳍高、尾肌高的组间差异均不显著(P>0.05)。
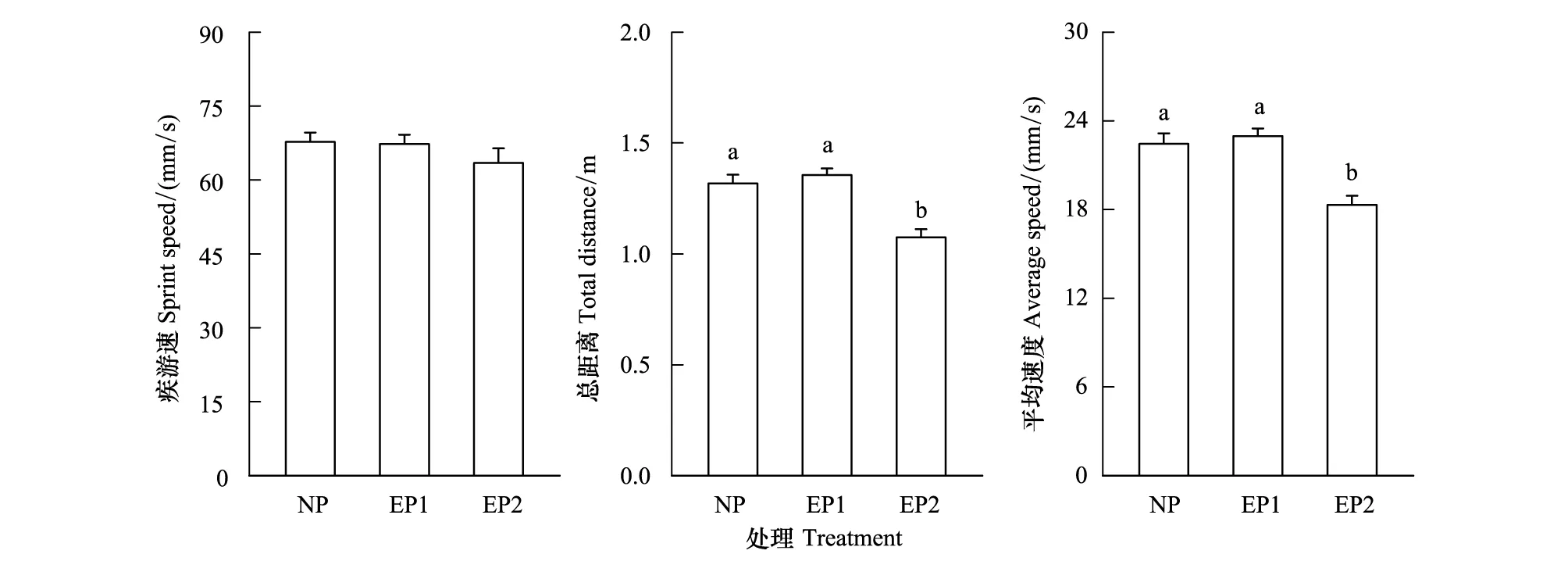
图2 有无捕食者处理下,黑斑侧褶蛙蝌蚪的游泳能力Fig.2 Swimming ability of Pelophylax nigromaculata tadpoles under the presence and absence of predators
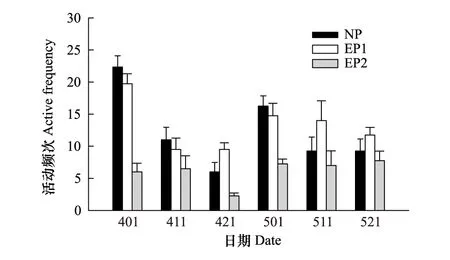
图3 有无捕食者处理下黑斑侧褶蛙蝌蚪的活动状态 Fig.3 Active state of Pelophylax nigromaculata tadpoles under the presence and absence of predators
2.3 克氏原螯虾对黑斑侧褶蛙蝌蚪活动状态的影响
不同时间所测试蝌蚪活动状态的两因素方差分析(Two-way ANOVA)结果表明,测试时间(F4,44=6.98,P<0.001)、捕食者设置(F2,44=22.89,P<0.001)和两因素的相互作用(F8,44=2.98,P<0.009)均显著影响蝌蚪的活动频次(图3)。不同实验时间,长期捕食者存在实验组蝌蚪活动频次均小于无捕食者和捕食者存在2 d的实验组。无捕食者实验组蝌蚪的活动频次前期高于捕食者存在2 d的实验组,后期低于捕食者存在2 d的实验组。以检测的时间序号为自变量(1—6),以与对照组的比值为因变量的线性回归分析结果显示,捕食者存在2 d实验组蝌蚪活动频次与检测时间相关不显著(r=0.52,F1, 4=1.48,P=0.291),长期捕食者存在实验组蝌蚪活动频次与检测时间呈显著的正相关(r=0.82,F1, 4=8.21,P=0.046)。
2.4 克氏原螯虾对黑斑侧褶蛙蝌蚪的变态时间、大小和幼蛙跳跃能力的影响
有捕食者和无捕食者处理下的黑斑侧褶蛙变态个体形态特征的统计性描述见图4。单因素多变量方差分析(One-way MANOVA)结果表明,有无捕食者条件下黑斑侧褶蛙的变态时间、体长和体重、跳跃距离差异显著(Wilksλ=0.87,df=8, 240,P<0.05),Tukey′s test表明,无捕食者和捕食者存在2 d的实验组黑斑侧褶幼蛙的体长和体重均显著小于有捕食者存在的情况(P<0.001),无捕食者和捕食者存在2 d的实验组黑斑侧褶幼蛙的体长和体重之间差异不显著(P>0.05),而变态时间和幼蛙跳跃距离组间差异不显著(P> 0.05,图4)。
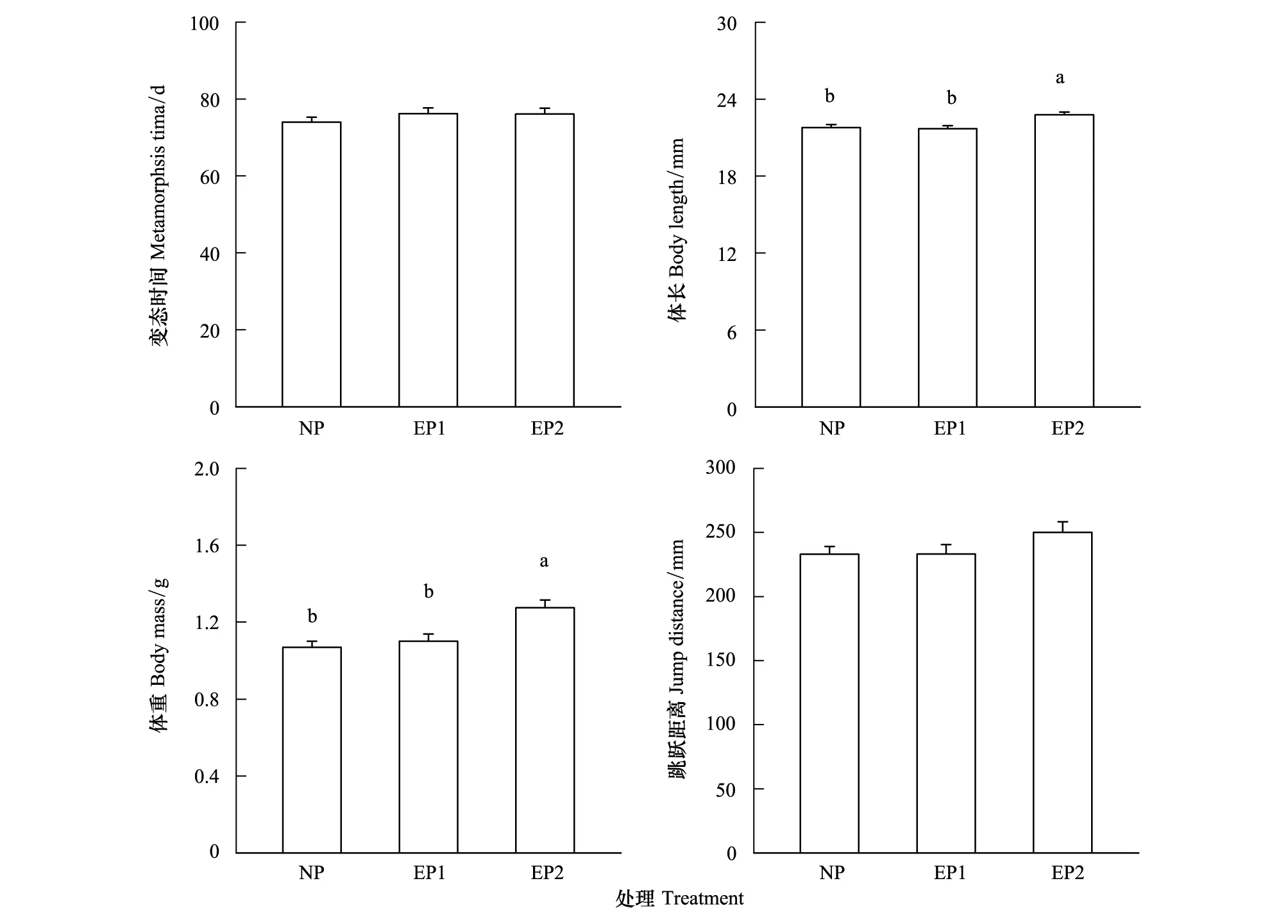
图4 有无捕食者处理下黑斑侧褶幼蛙的变态特征和跳跃能力Fig.4 Metamorphotic characteristics and jumping ability of Pelophylax nigromaculata juvenile under the presence and absence of predators
3 讨论
3.1 黑斑侧褶蛙蝌蚪对克氏原螯虾捕食风险的行为响应
捕食作用是猎物行为的重要选择压力,行为可塑性在捕食者与猎物的交互过程中发挥了决定性作用,行为的协同进化对于本土猎物响应入侵捕食者威胁的适应性显得尤为重要[30]。降低活动水平是栖息在水中的无尾类蝌蚪减少被捕食的最有效行为响应之一[18,19,47- 48]。本实验过程中,黑斑侧褶蛙蝌蚪能识别外来捕食者克氏原螯虾同种个体示警诱导物而适应性地降低活动水平(图3),无论示警诱导物是短暂还是持久接触,即克氏原螯虾捕食风险的存在显著抑制了黑斑侧褶蛙蝌蚪的活动水平,这与已有大多数研究是一致的[17- 18]。例如,西方铲足蟾蜍(Pelobatescultripes)蝌蚪学会识别来自入侵捕食者克氏原螯虾的化学诱导物,且相应地降低活动水平[31]。位于葡萄牙西南部的5种蝌蚪(Hylameridionalis、Hylaarborea、BufoBufo、Discoglossusgalganoi、Alytescisternasii)在克氏原螯虾存在时同样发生降低活动水平或空间回避行为[30]。类似的行为可塑性也发生在两栖类幼体对其他入侵捕食者的行为反应[47]。虽然大多数研究是在实验室内进行的,但是对同种受伤个体示警诱导物的反应也很可能发生在野外生境中[48]。克氏原螯虾进入我国近90年,对于春季繁殖的黑斑侧褶蛙来说,或许已经有足够长的进化时间,两栖类幼体对入侵捕食者的行为响应(在数十年内)比形态响应(可能需数百或数千年)进化可能更快些[29]。已有研究表明,Pelophylaxperezi蝌蚪从与受攻击同种个体的示警物质的接触中学会识别新的捕食者,对新的捕食风险发生行为响应,且能连续9天记住这些关系[49- 50]。因此,行为可塑性有助于降低黑斑侧褶蛙蝌蚪受到外来捕食者克氏原螯虾的伤害和缓解入侵物种对本土自然种群的影响。
3.2 黑斑侧褶蛙幼体对克氏原螯虾捕食风险的表型响应
捕食风险对无尾两栖类胚胎发育的直接影响是改变孵出个体的表型。本研究结果表明,当长期存在克氏原螯虾捕食风险时,黑斑侧褶蛙孵出蝌蚪的体长、尾长和尾肌宽均显著小于无捕食者的空白对照组和捕食者仅存在2 d的实验组,这与已有大多数研究结果是一致的。例如,在捕食者水蛭(Haemopsissanguisuga)或潜水甲虫(Dytiscusmarginalis)存在的情况下,Ranatemporaria均孵化成体长较小且尾鳍较短而深的蝌蚪[42,51]。类似地,三刺鱼(Gasterosteusaculeatus)可诱导Ranaarvalis和R.temporaria孵化成较短尾鳍的蝌蚪[16]。
变态时间与大小是生活史复杂的无尾类的两个重要适合度成分。大多数研究表明,无尾类蝌蚪往往通过加快发育(缩短变态时间)或降低生长率(即产生较小变态个体)来响应捕食风险的存在[52]。无尾类蝌蚪在权衡捕食风险代价时,往往采取降低活动水平来逃避捕食者,从而导致在时空上限制了觅食活动,大大减少了对其生长的能量投入[53]。本研究表明,来自克氏原螯虾的捕食风险并没有对黑斑侧褶蛙蝌蚪的变态时间产生显著影响,这与R.temporaria蝌蚪的变态时间也不受捕食者影响的结果一致[42]。无尾类孵化期对捕食风险产生的表型可塑性响应能对变态表型产生延滞效应,比如,在捕食者潜水甲虫存在下R.temporaria发育成体长较短的幼蛙[42]。感到意外的是,本实验与克氏原螯虾捕食风险不存在或短暂存在相比而言,捕食风险长期存在下的黑斑侧褶幼蛙的体长和体重反而更大些。可能的原因包括:(1)从生理角度看,无尾类个体发育早期所经历的不利环境条件产生的不良影响通过随后发育后期阶段的补偿性生长来抵消[54- 55];(2)从行为角度来看,当存在捕食者克氏原螯虾化学信号时,黑斑侧褶蛙蝌蚪采取降低活动水平策略,在充分喂食条件下,更多的能量用于生长,行为可塑性的动态进化似乎对本土两栖类适应外来捕食者起着决定性作用[56];(3)从整个实验过程来看,捕食风险长期存在组黑斑侧褶蛙蝌蚪的相对活动水平与实验时间呈显著正相关,这表明黑斑侧褶蛙蝌蚪的活动水平随着生长时间的向后推进而变得越强烈,可能是由于不断长大的蝌蚪个体重新评估了来自笼内的捕食风险信号,打破了最初由捕食风险导致的觅食活动的时空限制,从而形成较大的变态个体。因此,入侵捕食者克氏原螯虾对黑斑侧褶蛙幼体表型的长期影响是复杂可变的。
3.3 黑斑侧褶蛙幼体对克氏原螯虾捕食风险的运动能力响应
孵化阶段对捕食风险的表型可塑响应可能会延续影响到后期生长阶段个体的运动性能[54]。本研究结果表明,克氏原螯虾捕食风险的长期存在显著抑制了黑斑侧褶蛙蝌蚪的游泳能力,主要表现在游泳耐力方面(包括游泳总路程和平均游速),而非疾游速(图2)。克氏原螯虾被认为是积极追逐型捕食者,故处于活跃状态下的蝌蚪比不活跃状态下遭受被捕食风险相对小些[29]。这表明黑斑侧褶蛙蝌蚪能在运动能力上对克氏原螯虾的捕食方式作出适应性响应。另外,来自克氏原螯虾的捕食风险对黑斑侧褶蛙变态幼蛙跳跃能力不产生影响,这与已有研究结果一致。例如,与欧洲医蛭(H.sanguisuga)一同饲养的R.temporaria蝌蚪发育成较小的幼蛙,但并不影响幼蛙的跳跃能力[42]。也有研究表明,捕食风险造成的无尾类孵出幼体表型变异降低幼蛙的运动能力[51]。
本研究表明了黑斑侧褶蛙蝌蚪能够感知来自入侵捕食者克氏原螯虾的捕食风险,诱导产生较小的孵出个体、蝌蚪较低的活动水平,但这种不足可通过后期补偿生长,不影响进入陆地生境的变态个体的表型与运动能力。据此可推测,黑斑侧褶蛙蝌蚪这种识别能力和适应性响应可能有助于缓解外来捕食者克氏原螯虾对其自然种群的影响。
致谢:符晓雯、吴飞玲参与实验动物的管理、行为观察、形态特征和运动能力的测定。

