GBS感染胎膜早破孕妇抗感染治疗对妊娠结局、新生儿情况的干预分析
河南省安阳市妇幼保健院妇产科 (河南 安阳 455000)
冯 元
胎膜早破是指发生于分娩前的胎膜自然破裂表现,是诱发母儿感染、胎儿宫内生长受限、胎儿死亡、脐带脱垂、晚期流产等不良妊娠结局的主要原因[1]。引起胎膜早破的机制相对复杂,病原微生物上行感染是导致胎膜早破的常见原因,而B族链球菌(GBS)感染则为引起胎膜早破的关键病原菌,其具备较强的绒毛膜吸附及穿透能力,是引起胎膜早破、早产、产褥期感染、新生儿败血症的主要因素[2]。Mach等[3]统计发现,携带GBS的孕妇,其分娩新生儿中GBS感染率为35%左右,其中约有3%均合并早发性疾病。因此必须重视GBS感染胎膜早破孕妇的抗感染治疗,强化孕产期干预及管理。基于此,为探讨抗感染治疗对GBS感染胎膜早破孕妇妊娠结局及新生儿情况的改善效果,现对我院近年来收治的70例GBS感染胎膜早破孕妇的临床资料进行了回顾性分析,报道如下:
1 资料与方法
1.1 一般资料 收集2013年2月~2017年1月于我院住院分娩的70例GBS感染胎膜早破孕妇的临床资料。纳入标准:于我院建档且定期产前检查;确诊为GBS感染;妊娠28~32周;均为单胎;妊娠期间未应用抗菌药物;临床资料完整。排除标准:合并妊娠糖尿病、妊娠高血压疾病者;合并心肝肾肺疾病者;合并先天性心脏病者;前置胎盘、胎盘早剥者;胎儿发育异常者;合并甲状腺功能异常者;潜在肺部感染或上呼吸道感染者;合并其他致病菌引起生殖系统感染者;临床资料不完整者。其中接受抗感染治疗38例(观察组),未接受抗感染治疗32例(对照组)。观察组年龄23~37岁,平均(29.5±3.4)岁;产次0~4次,平均(2.6±0.4)次;孕周(30.3±0.3)周;既往流产17例。对照组年龄22~36岁,平均(29.7±3.5)岁;产次0~3次,平均(2.5±0.5)次;孕周(30.5±0.4)周;既往流产18例。
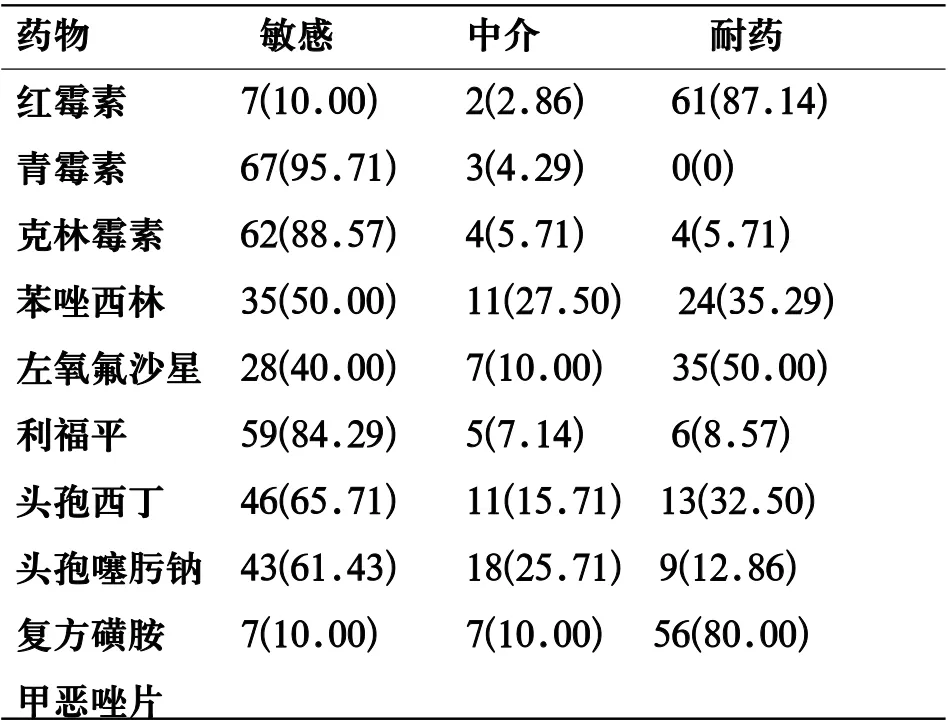
表1 所有GBS感染胎膜早破孕妇药敏试验结果[n(%)]
1.2 方法 ①药敏试验。所有产妇入院后均进行药敏试验,采用纸片琼脂扩散法(K-B)测定产妇GBS菌株对抗生素的耐药性,参照临床与实验室标准化研究所标准[4]判定结果。药敏纸片包括红霉素、青霉素、克林霉素、苯唑西林、左氧氟沙星、利福平、复方磺胺甲恶唑片、头孢西丁、头孢噻肟钠;培养基为5%脱纤维羊血M-H平板。②抗感染治疗。38例观察组入院后均接受抗感染治疗,根据药敏试验结果选择抗生素治疗,其中29例无青霉素过敏者予青霉素(天津药业焦作有限公司,批号H41020094)静脉滴注治疗,首次500万U青霉素+250ml 0.9%氯化钠溶液,250~350万单位/4h,直至分娩;9例青霉素过敏者予克林霉素(重庆莱美药业股份有限公司,批号H19991072)静脉滴注,900mg克林霉素+250ml 0.9%氯化钠溶液,900mg/8h,直至分娩。其余32例对照组产妇均未予抗感染治疗,均予静卧,强化营养支持、产前监护等处理。
1.3 观察指标 ①药敏试验结果。记录所有产妇药敏试验结果。②妊娠结局观察。两组产妇均随访至分娩,记录两组分娩结局,统计宫内感染、羊水污染、产后出血、产褥期感染等不良妊娠结局发生率,上述诊断均参照实用妇产科学中相关标准[5]。③新生儿情况观察。统计两组胎儿窘迫、早产、新生儿肺炎、新生儿窒息、新生儿感染等新生儿不良结局发生率,均参照实用儿科学中相关标准进行诊断[6],记录新生儿体质量,同时新生儿出生1min、出生5min均进行Apgar评分[7],统计观察新生儿皮肤、呼吸、反射、肌张力及运动、心搏速率等方面评定新生儿情况。总分0~10分。<7分提示存在轻度窒息;<4分提示重度窒息。
1.4 统计学方法 研究数据均采用SPSS20.0 统计学软件进行处理。计量资料采用(±s)表示,组间对比进行t检验;计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
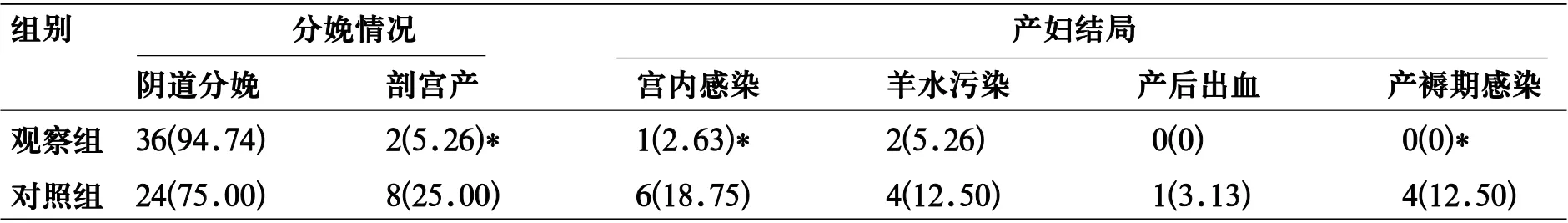
表2 两组妊娠结局比较[n(%)]
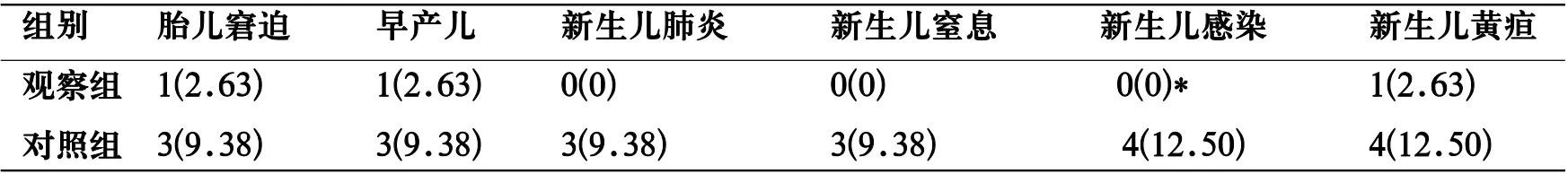
表3 两组新生儿结局比较[n(%)]
2 结 果
2.1 所有GBS感染胎膜早破孕妇药敏试验结果 70例GBS感染胎膜早破孕妇其GBS菌株对青霉素敏感率(95.71%)最高,其次为克林霉素(88.57%)、利福平(84.29%),见表1。
2.2 两组妊娠结局比较 观察组剖宫产率低于对照组(χ2=5.526,P<0.05),其宫内感染、产褥期感染发生率低于对照组(χ2=5.014、5.037, P<0.05),见表2。
2.3 两组新生儿结局比较 观察组各新生儿不良结局发生率均低于对照组,但仅新生儿感染发生率对比差异有统计学意义(χ2=5.037,P<0.05),见 表3。
2.4 两组新生儿出生情况比较 两组新生儿体质量对比差异无统计学意义(P>0.05),观察组出生1min、出生5min Apgar评分均高于对照组 (P<0.05),见表4。
表4 两组新生儿出生情况比较(±s)
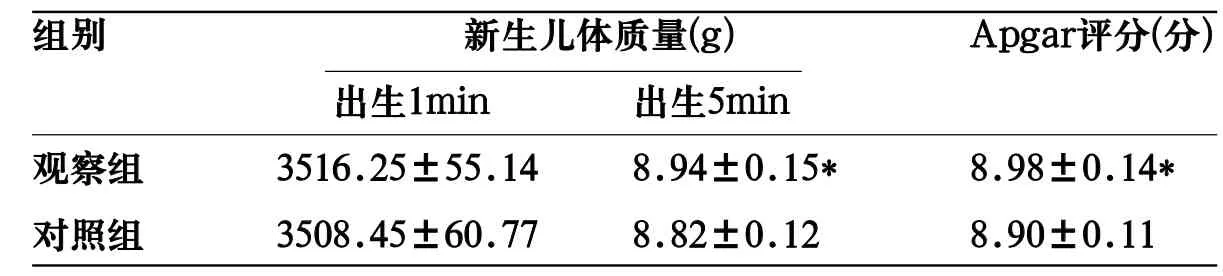
表4 两组新生儿出生情况比较(±s)
注:与对照组比较,*P<0.05.
组别 新生儿体质量(g) Apgar评分(分) 出生1min 出生5min观察组 3516.25±55.14 8.94±0.15* 8.98±0.14*对照组 3508.45±60.77 8.82±0.12 8.90±0.11
3 讨 论
GBS为β溶血革兰阳性球菌,又称无乳链球菌,常寄居于直肠及阴道,是围产期感染常见条件致病菌,且其危害性较大,有其超强的绒毛膜穿透能力,可引起羊膜绒毛膜炎、泌尿系统感染、败血症及产褥期感染[8]。统计报道显示,正常健康人群携带GBS所占比例为15%~35%,孕产妇为10%~30%[9]。且GBS感染是引起产妇胎膜早破的主要原因,GBS可通过蛋白水解酶途径,促进细胞因子、前列腺素、磷酸酯酶A2释放,同时可与炎症细胞相互作用直接侵袭胎膜,引起胎膜水肿变性,导致胎膜张力降低,刺激子宫收缩,增加早产风险[10]。且携带GBS产妇分娩过程中胎膜破裂,胎膜屏障作用消失,可能引起胎儿呼吸道感染,同时GBS病菌可快速扩散至子宫内,引起上行感染,导致晚期流产、胎儿发育不良、新生儿窒息等不良结局,影响母婴健康。Polettini等[11]表示,GBS可完全逆行侵入完整非完整胎膜,导致新生儿感染,同时胎儿可能误吸GBS引起菌血症,若未及时治疗,可能导致病情进展,引起代谢紊乱、呼吸衰竭及神经系统后遗症,严重影响胎儿发育。
目前对GBS疾病的防治首选抗感染治疗,常用抗菌药物包括青霉素、红霉素、克林霉素、头孢类等,但随抗生素的广泛应用,GBS对抗菌药物耐药性逐渐提升,朱燕飞等[12]进行药敏试验发现,GBS对红霉素、克林霉素耐药率提升至10%~20%之间。同时陆少颜等[13]统计GBS对红霉素、克林霉素、氯霉素、左氧氟沙星等抗生素耐药率分别高达45%、40%、19.0%、4.8%,且部分对两种或两种以上抗生素均耐药。本研究对70例GBS感染胎膜早破孕妇进行GBS菌株耐药性检测发现其对青霉素、克林霉素、利福平敏感度最高,而其对复方磺胺甲恶唑片、红霉素、左氧氟沙星、苯唑西林耐药率均较高,因此选择青霉素、克林霉素作为主要抗感染治疗药物。但目前临床上对GBS感染胎膜早破孕妇应用抗感染干预的有效性尚存在争议。有研究者[14]表示,对GBS感染孕妇采用预防性抗感染治疗其临床结局与未进行治疗的孕妇相似,该观点认预防性应用抗生素对新生儿GBS感染无明显防治效应。但徐一鸣等[15]发现,孕妇生殖道GBS感染可能增加不良妊娠结局发生风险,而通过抗感染治疗可降低胎膜早破发生风险,改善母婴结局。
本研究中,38例GBS感染胎膜早破孕妇均进行抗感染干预,根据药敏试验结果,选择青霉素、克林霉素作为主要抗生素,均持续用药直至分娩,结果发现,观察组孕妇其剖宫产率明显降低,且宫内感染、产褥期感染发生率降低,与未采用抗感染治疗的对照组相比差异有统计学意义,肯定了抗感染治疗对妊娠结局的改善效果,同时比较新生儿情况发现,观察组新生儿感染发生率明显低于对照组,且其出生1min、出生5min新生儿Apgar评分略高于对照组,提示控制感染对改善新生儿结局有其肯定作用。但同时还需注意,部分GBS感染深入宫腔,或已影响胎儿者,持续抗感染至分娩可能增加抗菌药物耐药性,增加胎儿肝肾负担,影响其生长发育。因此,必须重视孕35周前筛查,尽早发现GBS感染,并强化孕妇阴道内环境及免疫功能的改善,以降低胎膜早破风险,减少抗感染药物对胎儿发育的影响。

