莫西沙星注射液治疗社区获得性肺炎的疗效及预后分析
广东省惠州市中心人民医院呼吸内科 (广东 惠州 516000)
林宇挺 李伟坚 林常青
社区获得性肺炎(CAP)发病多见于5岁以下小儿及65岁以上老年人,国内一项研究显示16585例住院CAP患者中,≤5岁及>65岁的患者分别为37.3%和28.7%,构成比显著高于26~45岁青壮年(9.2%)[1]。CAP致病原组成及耐药特性在不同国家、地区之间差异显著,我国成人CAP患者中,肺炎链球菌、肺炎支原体等病原菌对大环内酯类药物呈高耐药率[2]。针对成年CAP患者,临床多选用喹诺酮类药物予以治疗,但目前优先选用何种药物尚无统一标准。对此,本研究观察莫西沙星(MOX)与左氧氟沙星(LVF)两种常用喹诺酮类药物在成人CAP治疗中的应用情况,现报道如下。
1 资料与方法
1.1 一般资料 研究对象为2017年1月至2018年12月我院120例CAP患者。纳入标准:符合《中国成人CAP诊断和治疗指南(2016年版)》[3]中诊断标准者;年龄18~75岁者;自愿签订知情同意书者。排除标准:合并恶性肿瘤或心肝肾功能异常者;合并肺部器质性病变者;伴有其他呼吸道疾病者;对本研究药物过敏者;精神智力障碍者。按随机数表法分为MOX组(n=60)和左氧氟沙星(LVF)组(n=60)。其中MOX组男39例,女21例,年龄18~68岁,平均(52.51±8.94)岁;体温平均(38.32±0.70)℃。LVF组男37例,女23例,年龄19~70岁,平均(53.26±9.11)岁;体温平均(38.57±0.72)℃。2组一般资料无显著性差异 (P>0.05)。
1.2 方法 MOX组:予以盐酸莫西沙星注射液(生产企业:成都天台山制药有限公司,规格:20mL:0.4g,批准文号:国药准字H20140125)静脉滴注,0.4g/次,1次/d。LVF组:予以盐酸左氧氟沙星注射液[生产企业:扬子江药业集团有限公司,规格:5mL:0.5g(按C18H20FN3O4计算],批准文号:国药准字H20143199)静脉滴注,0.5g/次,1次/d。2组均持续治疗7d。
1.3 观察指标 治疗7d后评估疗效。于治疗前及治疗7d后采集患者清晨空腹静脉血,离心分离血清,采用ELISA法检测血清炎症因子[白介素-6(IL-6)、降钙素原(PCT)、C反应蛋白(CRP)]水平,试剂盒均来自上海润裕生物科技有限公司。记录不良反应情况。
1.4 疗效标准 参照《抗菌药物临床应用指导原则》[4]评估疗效,痊愈:临床症状、体征消失,痰培养转阴,实验室检查正常,X线片显示炎性病灶基本吸收;显效:临床症状、体征明显好转,痰培养转阴或2种菌培养后仍有1种菌阳性,实验室检查正常,X线片显示大部分炎性病灶吸收;进展:临床症状、体征有所改善,痰培养仍为阳性,实验室检查未恢复正常;无效.临床症状体征无改善或病情加重。总有效率=(痊愈+显效)/总例数×100%。
1.5 数据分析 采用SPSS20.0软件;疗效、不良反应等分类资料以n(%)表示,采用χ2检验;血清学指标等连续性资料用(±s)表示,采用t检验; P<0.05为差异有统计学意义。
2 结 果
2.1 疗效 MOX组总有效率高于LVF组 (P<0.05)。见表1。
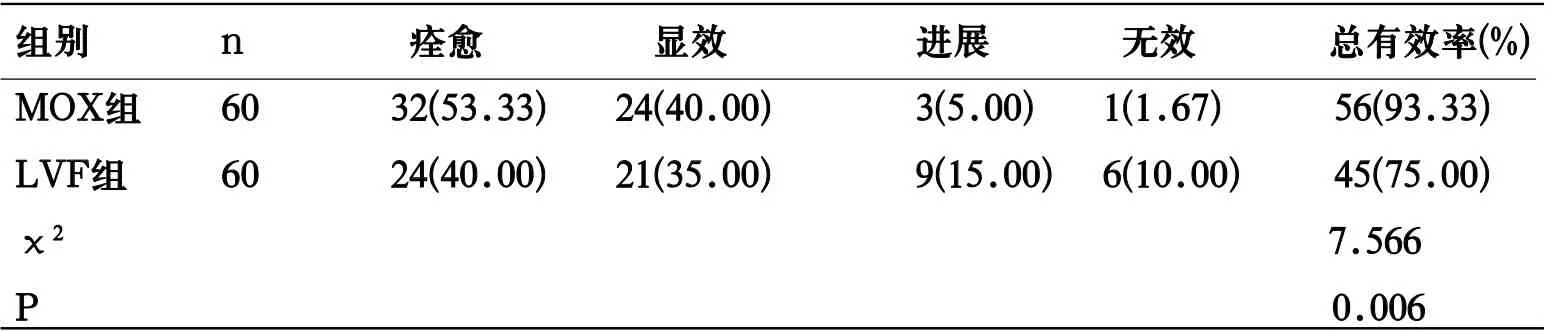
表1 2组疗效比较[n(%)]
2.2 血清炎症因子水平 治疗7d后,2组血清IL-6、PCT、CRP水平均较治疗前显著降低,且MOX组低于LVF组(P<0.05)。见表2。
表2 2组血清炎症因子水平比较(±s)
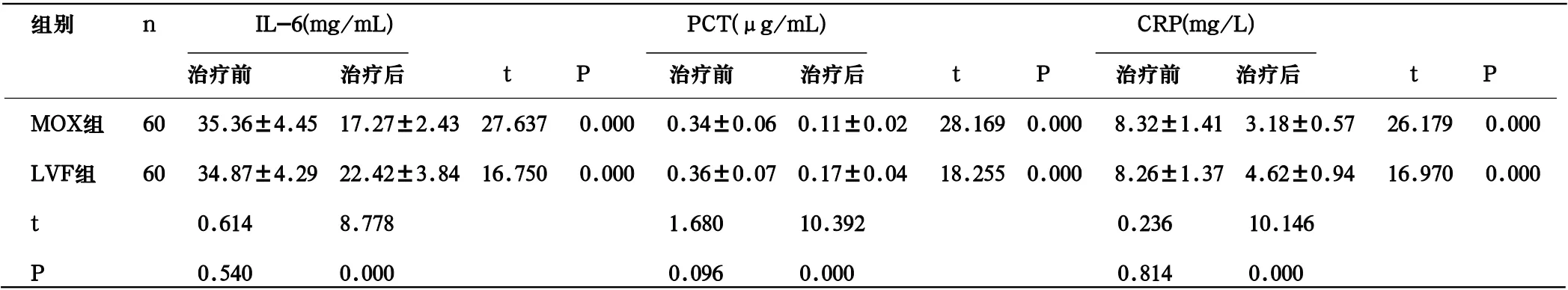
表2 2组血清炎症因子水平比较(±s)
组别 n IL-6(mg/mL) PCT(μg/mL) CRP(mg/L) 治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P MOX组 60 35.36±4.45 17.27±2.43 27.637 0.000 0.34±0.06 0.11±0.02 28.169 0.000 8.32±1.41 3.18±0.57 26.179 0.000 LVF组 60 34.87±4.29 22.42±3.84 16.750 0.000 0.36±0.07 0.17±0.04 18.255 0.000 8.26±1.37 4.62±0.94 16.970 0.000 t 0.614 8.778 1.680 10.392 0.236 10.146 P 0.540 0.000 0.096 0.000 0.814 0.000
2.3 不良反应 MOX组、LVF组总不良反应发生率差异无统计学意义(P<0.05)。见表3。
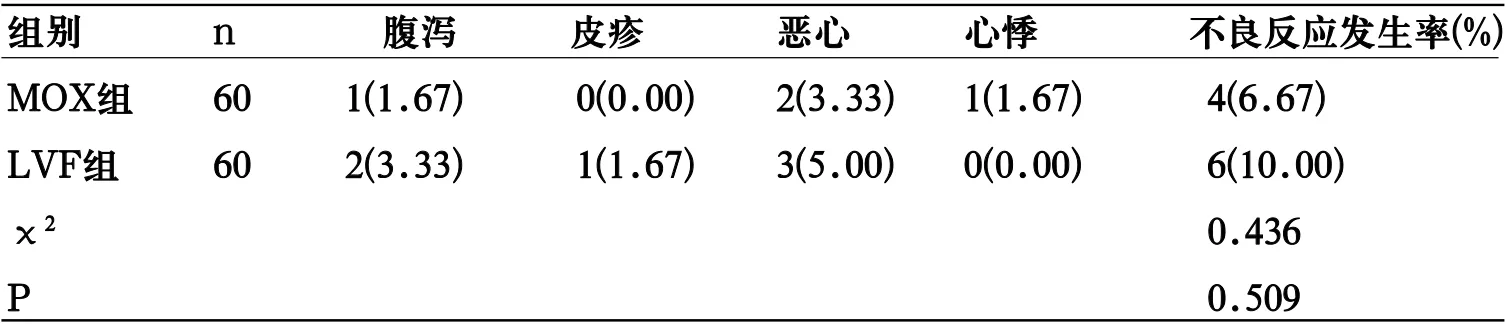
表3 2组不良反应发生情况比较[n(%)]
3 讨 论
我国人口基数较大,且老龄化严重,CAP已成为影响中老年人身体健康和生命安全的严重问题。我国CAP主要致病原包括肺炎链球菌、肺炎支原体、流感嗜血杆菌、肺炎衣原体等,肺炎链球菌、肺炎支原体等病原菌对大环内酯类、β-内酰胺类药物呈高耐药率是我国CAP病原学有别于其他多数国家的重要特 点[5]。
MOX和LVF均是氟喹诺酮药物,抗菌谱广,抗菌效果显著,临床广泛应用于CAP治疗。MOX作为第4代喹诺酮类抗菌药物,其于LVF分子结构上8位碳原子上引甲氧基,使其与病原菌结合能力、对细菌细胞壁穿透能力显著提升,抗菌谱增宽,抗菌能力增强。本研究中,MOX组总有效率(93.33%)高于LVF组(75.00%),也显示MOX治疗成人CAP疗效优于LVF。韩俊等[6]对MOX的药代动力学及药效学研究显示,其于肺组织浓度较高,血药浓度-时间曲线下面积(AUC)/最小抑菌浓度(MIC)居氟喹诺酮类药物首位。周理想等[7]研究亦显示,在CAP治疗中,MOX剂量为400mg/d时,AUC/MIC为192,而LVF在700mg/d的剂量下AUC/MIC仅为90.7。显示MOX药效优于LVF。
呼吸道在被病原微生物感染时,炎症细胞在支气管黏液中增多、聚集,肺泡巨噬细胞、中性粒细胞在致炎因子和抗原物质的刺激下激活,产生IL-6、PCT、CRP等炎症因子,引起炎症反应[8]。本研究中,治疗7d后,2组血清IL-6、PCT、CRP水平均较治疗前显著降低,且MOX组低于LVF组,显示MOX在改善CAP患者炎症反应方面优于LVF。徐意等[9]研究亦显示,MOX治疗老年CAP患者抗感染效果理想,可显著降低患者血清PCT、可溶性髓系细胞表达触发蛋白-1(sTREM-1)、CRP等炎症因子水平,与本研究基本一致。此外,本研究还显示,MOX组不良反应发生率与LVF无明显差异,且未出现严重不良反应,表明MOX治疗CAP具有良好安全性。
综上所述,相较于LVF,MOX治疗CAP可进一步提升疗效,减轻炎症反应,且安全性良好,于患者病情转归有利。

