SHMT1基因启动子甲基化与缺血性卒中相关
胡景岑,李 链,王淑瑜,许 磊,杨德伦,韩丽媛*,许国栋,2*
(1.宁波大学 浙江省病理生理学技术研究重点实验室,浙江 宁波 315211; 2.宁波市医疗中心李惠利医院病案室,浙江 宁波 315211)
缺血性卒中(ischemic stroke)是脑部缺血引起脑组织损伤的一种急性脑血管疾病,2016年中国缺血性卒中发病率已经达到276.75/10万[1]。
高同型半胱氨酸血症 (hyperhomocysteinemia,Hhcy)是卒中发病的一个重要危险因素。丝氨酸羟甲基转移酶 (serine hydroxymethyltransferase 1,SHMT1)的表达减少可以引起叶酸代谢受阻及同型半胱氨酸(homocysteine, Hcy)再甲基化途径出现异常,进而造成Hhcy。
DNA甲基化是一种可遗传的、可逆的在DNA 序列上发生甲基化修饰来调控基因表达的过程,进而影响蛋白结合[2]。异常的DNA甲基化与卒中[3]有密切关系,但国内外未见SHMT1基因甲基化与卒中的关系的研究。本研究通过检测290名健康人群和141例缺血性卒中患者的SHMT1基因启动子甲基化水平, 分析SHMT1启动子甲基化与缺血性卒中间的关联, 为预防缺血性卒中发病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 研究对象:本次研究对象来源于慢性病管理系统中登记的290名健康对照组和141例缺血性卒中病例组。纳入标准为在深圳居住满6个月且已在社区健康服务中心建立健康档案的汉族居民,且均为年满20岁的原发性高血压患者。原发性高血压的定义为3次血压测量的平均值,收缩压在 140 mmHg以上且舒张压在 90 mmHg以上,或者正在服用降压药物的患者。排除标准为继发性高血压患者、恶性肿瘤患者、严重肝肾疾病患者、妊娠者,或者有服用叶酸或维生素B6或B12史。所有受试者在纳入研究前均被详细告知实验的目的、方法,并签署知情同意书。本研究已通过深圳南山慢性病防治院和宁波大学医学院伦理委员会审核(文号:1120170008)。
1.1.2 试剂:EZ DNA Methylation-GoldTM kit试剂盒(Zymo Research公司);methylated阳性参照 (QIAGEN公司);酶Light Cycler® 480 SYBR Green Ⅰ Master Mix试剂盒(Roche 公司)。
1.2 方法
1.2.1 基线资料的收集:所有参与的调查员均经过统一培训,按既定方案对纳入人群进行问卷调查、体格检查和实验室检查。问卷调查包含年龄、性别、吸烟和饮酒情况、抑郁情况等人口学资料;体格检查包含身高、体质量、血压、腰臀比(waist hip ratio, WHR);实验室检查包含Hcy、三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、低密度脂蛋白(low density lipoprotein, LDL)、空腹血糖(blood glucose, Glu)和尿酸(uric acid, UA)等生化指标。
1.2.2 DNA的提取和转化:空腹12 h后,抽取5 mL静脉血到EDTA抗凝管,血液在采集后立即置于低温采样箱移送到实验室,如不能立即进行下步实验则将血液保存到-80 ℃超低温冰箱。外周血DNA主要通过NP968-S核酸提取仪及其配套试剂盒自动提取。采用Multiskan GO紫外分光光度计自动检测DNA的浓度及质量。DNA亚硫酸氢盐转化采用EZ DNA Methylation-GoldTM kit试剂盒。
1.2.3 RT-qPCR检测SHMT1基因启动子甲基化水平:利用 NCBI 数据库及甲基化在线分析软件(UCSC)搜索 SHMT1基因启动子区域的CpG岛,确定CpG岛的位置及 DNA 检测片段,并获取相应的DNA 序列,通过PyroMark Assay Design Software 2.0 软件确定检测片段并进行引物设计,具体引物序列见表1。甲基化水平的检测采用荧光定量甲基化特异性PCR。将经过亚硫酸氢盐修饰过样本DNA以及EpiTect Control DNA,methylated阳性参照作为模板,选择以人ACTB基因作为实验内参基因,应用SYBR Green 荧光染料法,采用的实时荧光定量PCR仪和试剂盒检测样本中目的基因甲基化水平。反应体系为1.5 μL亚硫酸盐转化后的DNA、 0.5 μL的正向引物、0.5 μL的反向引物、10 μL Zymo TaqTMPreMix和7.5 μL DNAase/RNAase-free water。PCR扩增的条件为95 ℃预变性10 min;95 ℃变性解链20 s,58 ℃退火45 s,72 ℃延伸20 s,共45个循环;40 ℃延伸5 min,于4 ℃保存。待测样本的DNA序列完成PCR扩增后,采用Qsep100 DNA分析仪进行甲基化水平检测。
1.2.4 SHMT1基因甲基化水平与相关mRNA表达水平关联性的分析: 530个样本SHMT1基因甲基化数据来源于The Cancer Genomics Browser (UCSC; https://genome-cancer.ucsc.edu/)。与之相应的mRNA表达数据来源于The cBioPortal database (http://www.cbioportal.org/)。采用Pearson相关探究SHMT1基因甲基化水平与相关mRNA表达水平间关联强度。

表1 qMSP引物序列Table 1 Primers sequence of qMSP
1.3 统计学分析

2 结果
2.1 基线资料分析
在290名对照组和141例卒中组中,性别、UA、TG、TC、WHR、吸烟和抑郁状况中无差异。卒中组的年龄、Hcy、BMI、SBP、DBP、Glu均高于对照组(P<0.05)。卒中组的LDL低于高血压组(P<0.05)。高血压组的饮酒情况高于卒中组(P<0.05)(表2)。
2.2 两组间DNA 甲基化水平比较
本研究选择SHMT1启动子片段位于hg19, Chr17:18266824-18266911,片段中有6个CpG岛(图1)。SHMT1基因启动子甲基化在卒中组和对照组中呈非正态分布。结果发现卒中组SHMT1基因启动子甲基化水平高于对照组 (P<0.05)(表2)。
表2 研究对象的基线资料比较Table 2 Characteristics comparison of study
*P<0.05 compared with control.
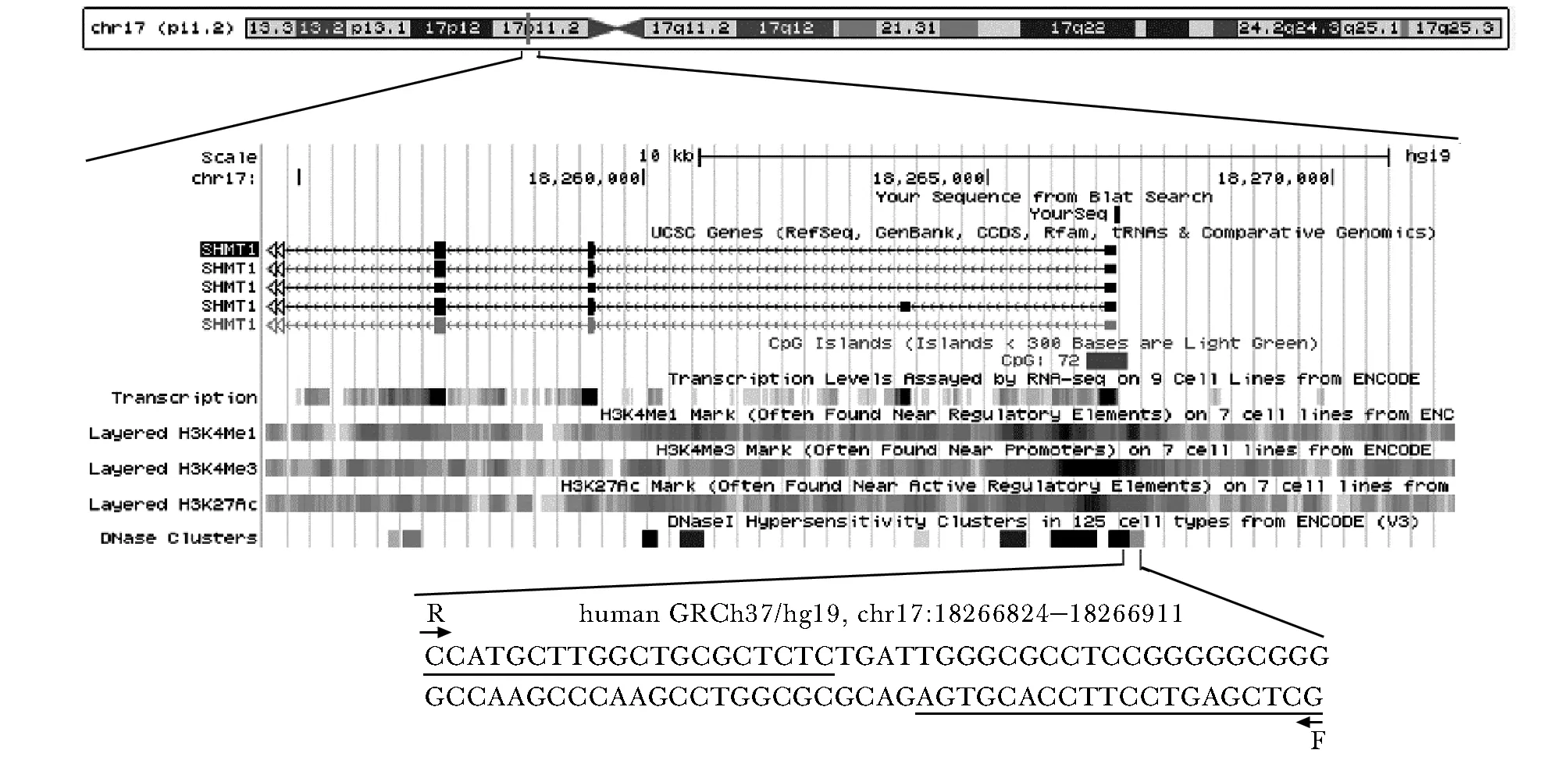
图1 SHMT1启动子区域目标片段Fig 1 Characteristics of target sequences in SHMT1 gene promoter
2.3 相关因素和SHMT1基因甲基化相关性分析
在对照组UA与SHMT1甲基化相关(P<0.01),在卒中组发现TG与SHMT1甲基化相关(P<0.05)(表3)。
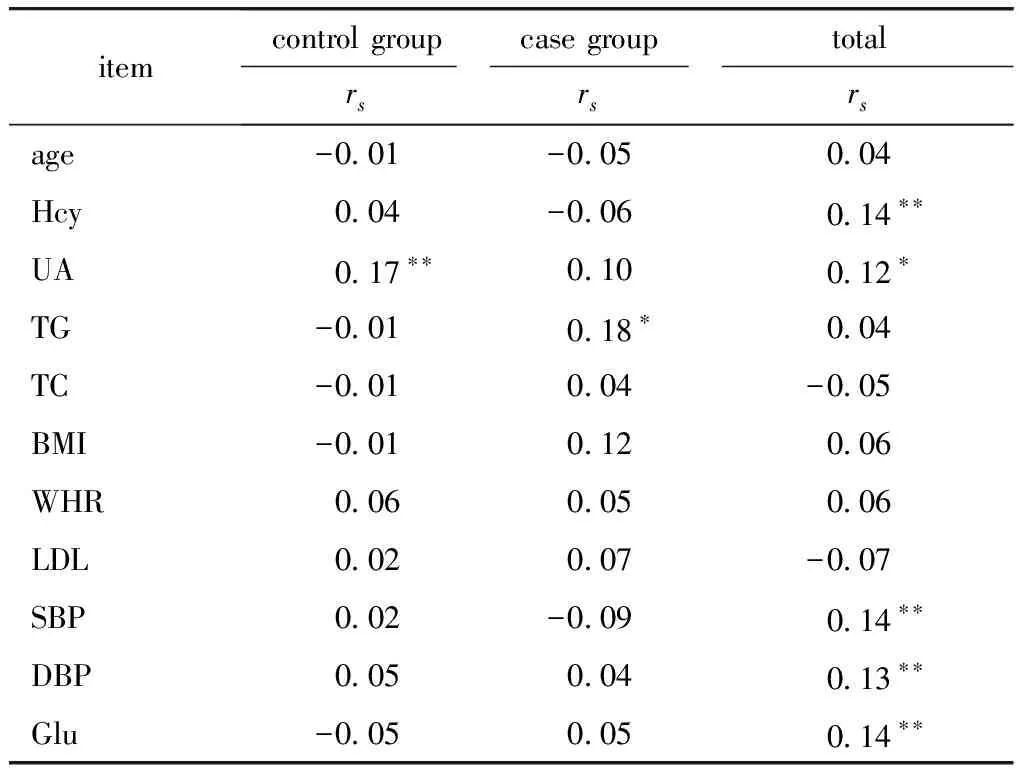
表3 相关因素和SHMT1甲基化Spearman秩相关性分析
*P<0.05,**P<0.01.
2.4 不同亚组中SHMT1甲基化与卒中的关系
二分类Logistic回归分析结果显示在调整年龄、性别、BMI、Hcy、UA、TC、TG、LDL、Glu、WHR、SBP、DBP、吸烟、饮酒和抑郁状态等变量后,SHMT1甲基化是卒中的危险因素。在进一步的亚组分析中发现,在男女组中,SHMT1甲基化均是卒中的危险因素,且性别和基因甲基化对卒中存在交互作用。结果还表明不同同型半胱氨酸血水平和基因甲基化对卒中存在交互作用(表4)。
2.5 ROC曲线分析
ROC曲线下面积为0.804,95%CI=0.760~0.849 (P<0.01)。
2.6 SHMT1甲基化水平与相关mRNA表达水平关联性分析
进一步下载数据库数据分析SHMT1甲基化与相关mRNA表达水平的关联性,结果发现SHMT1甲基化表达与mRNA的表达呈负相关,r=-0.472,P<0.01。
3 讨论
缺血性卒中是遗传因素和环境因素共同作用的一种疾病,其发病机制异常复杂。动脉粥样硬化的形成和发展是缺血性卒中重要的病理生理基础,约有68%以上的缺血性卒中患者存在不同程度的动脉粥样硬化[4]。近年来,越来越多的研究发现,DNA甲基化在卒中的发生发展过程中起着显著作用[5-6]。

表4 SHMT1启动子甲基化水平与卒中的多元logistic回归分析
crude.unadjusted; model 1.adjusted for age, gender, BMI, Hcy, UA, TC, TG, LDL, Glu, WHR, SBP, DBP, smoking, drinking, and psychology;*P-interaction<0.01:the interaction effect between different facters(gender, age, homocysteine) and SHMT1 methylation on strdce.
SHMT1是叶酸代谢过程中碳单元的重要提供者。SHMT1 基因高甲基化通过降低SHMT1的表达,进而引起叶酸代谢受阻及Hcy再甲基化途径出现异常,造成Hcy在血中蓄积而产生高同型半胱氨酸血症。此外,细胞中SHMT1的沉默可以诱导抗氧化系统和氧化产物之间的不平衡,增加氧化应激下游效应因子(如MMP2等)[7]的表达,进而引起血管钙化和动脉粥样硬化[8]。本研究也在进一步亚组分析中发现不同Hcy水平与SHMT1 基因甲基化对缺血性卒中存在交互作用。
性别与SHMT1基因甲基化对缺血性卒中也存在交互作用,女性中SHMT1基因甲基化的OR值高于男性。在以往研究中也有报道,心血管疾病相关基因甲基化在性别上存在差异[9]。可能原因是男女间性激素水平存在差异,性激素可以修饰DNA甲基化水平[10]。此外,先前在全基因组DNA甲基化的研究中也发现不同性别基因组甲基化水平存在差异[11],有学者认为这种差异是由于男女中叶酸和一碳单位的摄入量存在差异引起的[12]。
在国外一项单核苷酸多态性分析中发现SHMT1 rs1979277在卒中组和正常对照组间基因型存在着统计学差异,其中等位基因A是卒中的风险等位基因。在新加坡华裔中进行的研究中发现SHMT1 rs11868708位点与卒中遗传易感性相关,等位基因A可以增加24%的卒中危险[13]。此外,在本课题组前期进行的一项病例研究中发现HMT1高甲基化是高血压的危险因素之一[14]。本研究在调整相关混杂因素后也发现SHMT1甲基化是缺血性卒中的危险因素。
综上所述,SHMT1甲基化与缺血性卒中相关联,且SHMT1甲基化可以作为诊断缺血性卒中潜在的生物标志物,通过检测SHMT1甲基化水平对缺血性卒中高危人群进行筛选,以期达到二级预防的目的。

