不同温度及乙醇含量对生料醋醅中醋酸菌产酸能力的影响
李阳 张丽珍 杨埔 张一中

摘要:从正常发酵的生料醋醅中分离、筛选得到一株醋酸菌,通过形态学、16S rDNA基因序列分析,确定菌株为巴氏醋杆菌。菌株发酵过程中,改变发酵温度和初始乙醇添加量,研究其对有机酸种类和含量的影响,为评价食醋品质提供参考依据。利用高效液相色谱检测样品,检测到的有机酸有草酸、乳酸、乙酸、柠檬酸,最高含量分别是2.5 mg/100 mL,5.0 mg/mL,3.4 mg/100 mL,0.17 mg/mL。在37,42,47 ℃这3个温度下最适宜有机酸生成的乙醇添加量分别是4%,6%,2%,最利于醋酸菌发酵的温度是42 ℃。
关键词:生料醋醅;醋酸菌;温度;乙醇含量;有机酸
中图分类号:TS201.3 文献标志码:A doi:10.16693/j.cnki.1671-9646(X).2020.02.002
Effect of Different Temperature and Ethanol Content on Acid Production Ability of Acetic Acid Bacteria in Raw Material Vinegar
LI Yang1,*ZHANG Lizhen1,YANG Pu1,ZHANG Yizhong2
(1. School of Life Science,Shanxi University,Taiyuan,Shanxi 030006,China;
2. Institute of Sorghum Research,Shanxi Academy of Agriculture Sciences,Jinzhong,Shanxi 030600,China)
Abstract:A strain of Acetobacter was isolated and screened from the normal fermented raw material vinegar,and the strain was identified as Acetobacter pasteurianus by morphological and 16S rDNA gene sequence analysis. During the fermentation of the strain,the fermentation temperature and initial ethanol addition were adjusted to studied its effect on the type and content of organic acid,which provided a reference for evaluating the quality of vinegar. The samples were detected by high performance liquid chromatography. The organic acids detected were oxalic acid,lactic acid,acetic acid and citric acid,and the highest content were 2.5 mg/100 mL,5.0 mg/mL,3.4 mg/100 mL,and 0.17 mg/mL respectively. The optimum ethanol content at different temperatures 37,42,47 ℃ was 4%,6%,2%. The optimum fermentation temperature for acetic acid bacteria was 42 ℃.
Key words:raw vinegar;acetic acid bacteria;temperature;ethanol addition;organic acid
食醋在春秋時期就有记载,是一种常见的酸味调味料,通常以粮食为主料,加入大曲后进行糖化、酒精发酵、醋酸发酵[1],再加水淋制最终得到成品醋的过程。发酵过程中微生物种类众多、成分丰富,含有多种维生素、氨基酸[2],还有黄酮、酚酸[3]等有益成分,在降低血压[4]、缓解疲劳[5]等方面有显著效果,因此人们对食醋的需求也越来越高。传统食醋的酿造原料需要经过蒸煮,生料醋的特色就是原料与发酵剂混合后直接发酵[6],酿造过程中反应类型更多、更复杂[7],因此口感与传统食醋相比更加醇厚。
醋酸菌在酿造过程中扮演重要角色,负责将乙醇氧化成乙酸[8-9],过高的乙醇含量会抑制微生物的生长[10],不适的温度会破坏发酵酶类的活性[11],因此探究合适的初始乙醇含量和发酵温度尤为重要。关于生料醋醅中醋酸菌的研究相对较少,可以参考的数据不多。陈洋[12]从浙江等醋厂中筛选出了耐10%乙醇、耐40 ℃高温的醋酸杆菌,经16S rDNA鉴定为巴氏醋杆菌,并研究了其耐乙醇机制。胡宇豪等人[13]对耐12%乙醇的巴氏醋杆菌的培养基进行了优化,得出在常规培养基中加入5.5%乙醇、0.5%乙酸时,产酸量可以最大程度地提高。李文等人[14]从腐烂的猕猴桃中筛选出一株醋酸菌,耐40 ℃高温、耐12%高醇,经研究可使产酸量提高30.54%。向进乐等人[15]从木瓜醋中检测出了草酸、酒石酸等10种有机酸,且醋酸含量最高。目前,生料醋的研究尚存在较多空白,比如有机酸的类型、高温、高醇对其发酵性能的影响等。
试验以自然发酵的生料醋醅为样品,分离纯化出醋酸菌菌种,再通过菌落形态特征、产酸定性试验、16S rDNA序列的分析对其进行鉴定。发酵过程中添加不同含量的乙醇,研究不同温度下对醋酸菌产酸特性的影响,研究成果可以作为优化醋酸发酵的数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
基础培养基:葡萄糖10 g/L,酵母粉3 g/L,蛋白胨4 g/L,琼脂12 g/L,1.6%溴甲酚紫4 000 μL,灭菌后加入3%无水乙醇。
发酵培养基:葡萄糖10 g/L,酵母粉10 g/L,硫酸镁0.5 g/L,磷酸二氢钾0.5 g/L,琼脂12 g/L,接种前加入5%无水乙醇。
1.1.2 试剂
无水葡萄糖,山东西亚化学工业有限公司提供;硫酸镁,天津市北辰方正试剂厂提供;磷酸二氢钾,北京精求化工厂提供;酵母浸粉,北京奥博星生物技术有限责任公司提供;无水乙醇,天津欧博凯化工有限公司提供;琼脂粉,北京索莱宝科技有限公司提供;甲醇(色谱纯)、甘油,北京博奥拓达科技有限公司提供。
1.2 仪器与设备
高效液相色谱仪,安捷伦科技公司产品;超净工作台,苏净安泰AIRTECH产品;AD-88型大容量全温气浴振荡器,常州国宇仪器制造有限公司产品;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂产品;MS7-H550-Pro型磁力搅拌器,SCILOGEX产品。
1.3 方法
1.3.1 醋酸菌的筛选
从发酵了12,18,24,30,36 d的醋醅中采样约10 g,再分别加入装有50 mL蒸馏水的锥形瓶中,于28 ℃条件下,以转速180 r/min振荡培养30 min,将样品稀释至10-3,吸取50 μL涂布至基础培养基,于28 ℃恒温培养箱中培养,菌落长出后,多次分离纯化,直至长出单一菌落,最后挑取菌落加入到甘油培养基中,于-20 ℃的冰箱中保存备用。
1.3.2 产酸定性试验
挑取菌种于发酵培养基活化2次,接入到加有溴甲酚紫酸碱指示剂的基础培养基,于28 ℃条件下培养2~3 d,可使培养基变成黄色的菌株为产酸细菌。
1.3.3 菌种鉴定
筛选出菌种后编号为1,观察其形态特征并进行分子生物学鉴定,确定其分类地位。
1.3.4 醋酸菌的产酸特性试验
醋酸菌涂布发酵培养基,于恒温培养箱活化2~ 3 d,挑取已活化的菌株接种到试管发酵培养液,于振荡培养箱培养1~2 d,吸取2%的发酵培养液至锥形瓶培养48 h,从0 h开始,每隔12 h采一次样。乙醇体积分数设置6个梯度,分别是0,2%,4%,6%,8%,10%;培養温度分别为37,42,47 ℃,通过高效液相色谱仪测定产酸类型和产酸量。
1.3.5 高效液相色谱条件
产酸高效液相色谱检测条件参照杨钰昆等人[16]的测定方法。色谱柱为AQ-C18;流动相为甲醇∶磷酸二氢钾(0.02 mol/L)为3∶97(V/V),磷酸调pH值至2.7,流速1.00 mL/min,柱温30 ℃,检测波长210 nm,进样量10 μL。
1.3.6 数据处理
将通过3次重复试验得到的数据利用SPSS 20软件分析和Excel软件绘制图表。
2 结果与分析
2.1 醋酸菌的鉴定
2.1.1 醋酸菌的分离
菌落形态见图1。
该菌长势良好,菌落为白色小圆形,表面光滑,边缘整齐。
2.1.2 醋酸菌的鉴定
(1)形态学鉴定。挑取醋酸菌滴至有无菌水的载玻片上,干燥后用草酸铵结晶紫染液染色60 s,纯净水冲去多余染液,干燥后进行光学显微镜观察。菌体呈短棒状,单个或多个排列。
显微镜观察图见图2。
(2)分子生物学鉴定。
醋酸菌的系统发育树见图3。
2.2 37 ℃条件下发酵过程中有机酸的含量变化
2.2.1 乳酸含量变化
乳酸含量变化见图4。
由图4可知,不同乙醇含量的发酵液中,乳酸均呈增加趋势。乳酸含量受乙醇体积分数影响较大,发酵48 h后,乙醇体积分数为8%和10%的培养液中乳酸含量最低,为2.6 mg/mL;添加量为2%时,乳酸含量达到最大,为4.7 mg/mL。
2.2.2 乙酸含量变化
乙酸含量变化见图5。
由图5可知,乙醇体积分数为2%时乙酸含量由0增加到1.8 mg/100 mL;添加8%和10%乙醇时,发酵0 h检测到乙酸含量为0.34 mg/100 mL和-0.36 mg/100 mL,可能是种子培养基代入,12 h后下降到0;添加0,4%,6%乙醇在发酵过程中没有检测到乙酸。
2.2.3 柠檬酸含量的变化
柠檬酸含量变化见图6。
由图6可知,乙醇含量为4%时柠檬酸含量最高,发酵24 h含量最大,为0.08 mg/mL,高于添加量为8%的柠檬酸含量。不同的乙醇添加量对发酵过程中柠檬酸含量的影响各不相同,其中添加量为10%时柠檬酸含量最低,可见高浓度乙醇含量不利于醋酸菌的发酵。
2.3 42 ℃条件下发酵过程中有机酸的含量变化
2.3.1 乳酸含量变化
乳酸含量变化见图7。
由图7可知,乙醇添加量越少,发酵过程中乳酸含量增加越多,发酵48 h添加6%乙醇的培养液中,乳酸含量最高达到3.9 mg/mL;添加量为10%的乙醇在发酵至48 h时,乳酸含量最低,为3.1 mg/mL。
2.3.2 乙酸含量变化
乙酸含量变化见图8。
由图8可知,乙醇添加量为8%时,在48 h检测到乙酸含量为3.4 mg/100 mL,高于37 ℃乙酸的最高含量;添加10%乙醇,发酵液中乙酸含量维持在2.5~3.4 mg/100 mL,高于添加6%乙醇检测到的乙酸含量;添加0,2%,4%乙醇在發酵过程中没有检测到乙酸。
2.3.3 柠檬酸含量变化
柠檬酸含量变化见图9。
由图9可知,乙醇添加量越少,对发酵过程中柠檬酸含量的影响越低,发酵过程中柠檬酸均呈增加的趋势,添加量为4%的发酵液中柠檬酸含量最多,48 h达到0.17 mg/mL。
2.4 47 ℃条件下发酵过程中有机酸的含量变化
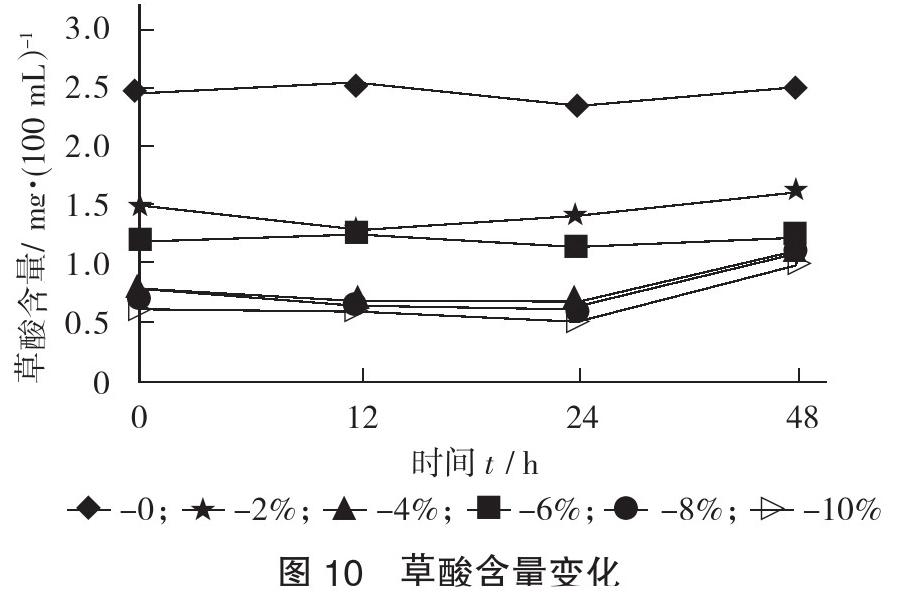
2.4.1 草酸含量变化
草酸含量变化见图10。
由图10可知,不添加乙醇的培养液中草酸含量最高,48 h含量达到2.5 mg/100 mL,在整个发酵过程中,添加2%乙醇的培养液中生成的草酸为1.7 mg/100 mL,均高于其他乙醇添加量;添加10%时草酸含量增加最低,发酵至48 h只有1.03 mg/100 mL。
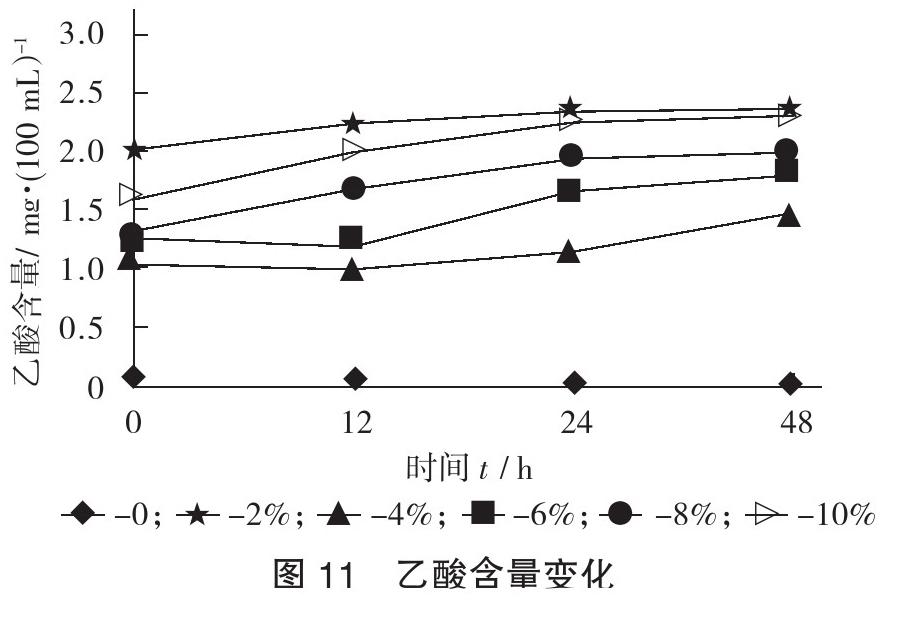
2.4.2 乙酸含量变化
乙酸含量变化见图11。
由图11可知,除0外,不同乙醇添加量的发酵液中,乙酸含量都呈增长趋势,其中添加2%的乙醇时乙酸含量最高,发酵48 h可达1.97 mg/100 mL;不添加乙醇的培养液中乙酸含量为0,可见乙醇可促进乙酸的生成。
2.4.3 乳酸含量变化
乳酸含量变化见图12。
由图12可知,乳酸含量在发酵24 h内都有不同程度的下降,24~48 h继续增长,可能是由于发酵初期营养物质消耗太快,乳酸作为碳源被利用。观察不同乙醇含量对乳酸的影响,得出添加2%的乙醇,乳酸含量最高,发酵48 h达到5.02 mg/mL;添加4%乙醇乳酸含量最低,在48 h检测只有3.19 mg/mL,低于42 ℃培养条件下检测到的乳酸含量,可见温度也是影响发酵的关键因素之一。
3 结论
试验从生料醋醅中筛选出醋酸菌,经形态学和16S rDNA鉴定为巴氏醋杆菌,通过改变其发酵过程中的温度和乙醇添加量,研究其对醋酸菌产酸特性的影响。
温度设置37,42,47 ℃ 3个梯度,乙醇添加量设置0,2%,4%,6%,8%,10% 6个梯度。将2%的种子培养液接入发酵液后通过高效液相色谱检测样品,检测到的有机酸有草酸、乳酸、乙酸、柠檬酸,比赵方圆等人[17]的试验结果多一类草酸。不同温度、乙醇含量对有机酸的生成影响较大,乙醇添加量为10%时有机酸的生成都受到了抑制,可见高浓度的乙醇会影响微生物的活性,与张月阳等人[18]的研究结果一致。37,42,47 ℃ 3个温度下最适宜有机酸生成的乙醇添加量分别是4%,6%,2%,耐受性低于孙文瑛等人[19]从腐烂水果中筛出的耐11%乙醇的醋酸菌。分析不同温度下几种有机酸的产酸量,可知42 ℃更适宜巴氏醋杆菌产酸,此菌株对温度的耐受性高于邵建宁等人[20]研究的耐40 ℃高温的醋酸菌。检测到的有机酸中,乳酸含量最高为5.0 mg/mL,在42 ℃,8%乙醇条件下乙酸含量最高为4.2 mg/100 mL,二者在醋中均是含量最高的有机酸,与方冠宇等人[21]的研究结果一致。草酸、柠檬酸的含量最高时分别是2.5 mg/100 mL,0.17mg/mL,这类不挥发有机酸的存在很好地中和了乙酸带来的刺激感,使醋的酸味更加柔和爽口。
通过对生料醋醅中的巴氏醋杆菌进行研究,挑选出发酵的最适温度和最适乙醇含量,优化生产工艺,最大程度增加生料醋中有机酸的含量,提升生料醋的口感,也为生料醋产品的进一步开发提供参考。
参考文献:
Wang Xiaodan,Shi Dong,Hu Bandong. Bacterial diversity of Moutai-flavour Daqu based on high-throuhgput sequencing method[J]. Journal of the Institute of Brewing,2017(1):138-143.
王争争,张磊,李婷,等. 不同陈酿期山西老陈醋中氨基酸成分的变化研究[J]. 食品工程,2015(2):52-54.
苏静. 山西老陈醋多酚类物质的提取及抗氧化活性研究[D]. 太原:山西大学,2010.
刘珂. 浅谈我国食醋的功能及发展趋势[J]. 中国调味品,2010,35(6):32-39.
信亚伟,孙惜时,谈甜甜,等. 食醋的营养价值和保健功能作用研究进展[J]. 中国调味品,2015,40(2):124-127.
陈洋,汪超,高冰,等. 高耐受性醋酸菌的筛选及发酵特性研究[J]. 中国酿造,2015,34(12):28-33.
Wang X S,Du H,Zhang Y,et al. Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J]. Applenviron Microbiol,2018(4):9-17.
王宗敏,陆震鸣,朱青,等. 镇江香醋醋醅微生物Bacillus cirulans发酵特性的初步研究[J]. 中国调味品,2016,41(9):24-28.
B Ndoye,S Lebecque,R Dubois-Dauphin,et al. Themoresistant properties of acetic acids bacteria isolated from tropical products of Sub-Saharan Africa and destined to industrial vinegar[J]. Enzyme and Microbial Technology,2006,39(4):916-923.
Wei Y Q,Wu X Y,Xu Z M,et al. A Thermotolerant Acetobacter pasteurianus T24 achieving acetic acid fermentation at high temperature in self-adaption experiment[J]. Advances in Applied Biotechnology,2015(4):287-293.
Nittaya Pitiwittayakul,Pattaraporn Yukphan,Wilawan Sintuprapa,et al. Identification of acetic acid bacteria isolated in Thailand and assigned to the genus Acetobacter by GroEL gene sequence analysis[J]. Ann Microbiol,2015(3):1 557-1 564.
陳洋. 耐乙醇醋酸菌特性研究及应用[D]. 武汉:湖北工业大学,2016.
胡宇豪,李戴阳,汪超,等. 耐受乙醇巴氏醋杆菌ZJ-25培养基的优化[J]. 中国酿造,2017,36(4):118-121.
李文,王陶,谢昊讯,等. 耐高温、高醇醋酸菌筛选、鉴定及低能离子选育[J]. 中国食品学报,2018,18(8):107-114.
向进乐,罗磊,马丽苹,等. 木瓜酒和木瓜醋发酵工艺及其有机酸组成分析[J]. 食品科学,2016,37(23):191-195.
杨钰昆,宋佳,乔沈,等. 高效液相色谱法同时测定酵素原液中的乳酸和醋酸[J]. 食品工业科技,2018,39(10):246-250.
赵方圆,李静媛. 新型葡萄醋酿造工艺[J]. 食品与发酵工业,2019,45(2):124-128.
张月阳,李海峰,曹健,等. 高耐受性醋酸菌的研究和应用进展[J]. 中国酿造,2016,36(11):11-14.
孙文瑛,陈雄,王志,等. 耐高温高醇醋酸菌的筛选及其发酵工艺的初步优化[J]. 中国酿造,2011(1):44-47.
邵建宁,王秉峰,路等学,等. 耐高温耐高酒度醋酸菌突变株的选育[J]. 中国调味品,2005(9):28-31.
方冠宇,穆晓静,蒋矛箭,等. 浙江玫瑰醋发酵过程中细菌菌群结构变化与有机酸形成相关性研究[J]. 食品科学,2019(11):1-12.
收稿日期:2019-10-14
基金项目:山西省重点研发计划项目(201703D211010,201803D221008-9)。
作者简介:李阳(1994— ),女,硕士,研究方向为食品科学与工程。
*通讯作者:张丽珍(1977— ),女,教授,博士,研究方向为生物资源的筛选及利用。

