关于数据管理和数据完整性的药品cGMP警告信分析
周清萍,周娜,梁毅
(中国药科大学国际医药商学院,江苏南京 211198)
数据完整性(Data Integrity)是确保药品安全有效和质量达标的制药行业应尽责任的基本内容,是直接体现制药企业的质量管理水平的标准之一。对于监管机构而言,数据完整性是确保制药产品质量以及提交信息准确的关键要素。近年来,美国食品药品监督管理局(FDA)在其动态药品生产质量管理规范(cGMP)检查中越来越关注涉及数据完整性的违规行为,使得数据完整性成为制药企业及相关实验人员关注的重点。在此背景下,美国FDA、英国药品和医疗保健用品管理局(MHRA)、世界卫生组织(WHO)以及国际药品监管公约/药品监管合作计划(PIC/S)先后发布了有关数据完整性的指南,我国也于2016年10月推出《药品数据管理规范(征求意见稿)》。本文结合对各国家/组织发布的指南文件的研究,统计分析2014—2019年FDA 对美国境外企业发出的245 封cGMP 警告信,重点解析警告信中有关数据完整性的内容,从而了解FDA 的检查趋势,期望为国内各制药企业及检查员提供参考。
1 数据完整性的背景、定义及范围
20世纪80年代的“仿制药丑闻”中,提交给FDA 的用于支持简略新药申请(ANDA)的数据中存在伪造数据的现象。为解决这一问题,FDA 将新重点放在批准前检查(PAIs)上,以评估上市申请中包含的原始实验室数据,并检查生产场地是否能够按照申请中的描述进行生产。与此同时,FDA 认为制药行业对计算机化系统的依赖性有所增加,为保证数据安全性并加强电子数据监管,FDA 于1997年制定并发布了21 CFR 11,即电子记录和电子签名的最终规则及其序言[1]。由此,各监管机构开始对数据管理和数据完整性问题采取检查和执法行动。
英国药监部门MHRA 在2018年3月9日发布了一份行业指南——GXP 数据完整性指南和定义(‘GXP’ Data Integrity Guidance and Definitions),指南定义数据完整性是指数据完整、一致、准确、可信、可靠的程度,并且保证这些数据特征在整个数据生命周期中得以维持[2]。FDA 于2018年12月13日发布的“数据完整性及其动态药品生产质量管理规范符合性问答行业指南”也明确指出确保数据完整性在整个cGMP 数据生命周期中至关重要,即数据(包括原始数据)从产生、记录、处理(包括分析、转换或迁移)、审核、分析、报告、转移、储存、归档、恢复直至失效、销毁整个生命过程中的所有阶段,都要保证数据的完整性、一致性和准确性[3]。表1列出了部分国家/组织的数据完整性指南。

表1 部分国家/组织数据完整性指南Tab.1 Guidelines for data integrity in partial countries/organization
2 国外数据完整性监管法规介绍
2.1 英国相关行业指南
2018年3月9日,英国MHRA 发布了《关于GXP 数据完整性的行业指南》(GXP Data Integrity Definitions and Guidance for Industry),不 同 于2015年3月发布的仅适用于GMP 的数据完整性草案,其适用范围包括GDP、GCP、GLP、GMP、GPvP,但不适用于医疗器械。新指南旨在促进基于风险的数据管理办法,包括数据风险、数据的关键性和数据生命周期,针对的是数据完整性而非数据质量,修订 “原始数据”的定义,增加“对于在动态状态下获得并以电子方式生成的数据,其纸质副本不能视为‘原始数据’”的内容,并在“数据管理”中要求“合同提供方应确保与第三方签订的任何合同/技术协议中包含数据的所有权、数据管理和可访问性,合同提供方还应将数据管理审查纳入供应商保证计划中。”
2.2 美国相关行业指南
FDA 于2018年12月13日发布了最终的《数据完整性及药品cGMP 符合性问答行业指南》(Data Integrity and Compliance with cGMP Guidance for Industry)。该指南以问答的形式呈现,共18 个问题,涉及数据完整性和数据管理领域。值得注意的是,FDA 指南在Q13 中着重讨论了“预注射”、“试验注射”的情况,即以获得期望合格结果或避免不可接受结果为目的(如在正式试验之前测试不同样品)的取样和测试,这种违反cGMP 的做法又被称为“合规性测试”。同样的,FDA 认为在准备、测试或平衡过程中使用实际样品,也是将试验伪装成“合规”的手段。
2.3 欧洲药品管理局的相关规范
欧洲药品管理局(EMA)于2016年8月发布了问答形式的数据完整性指南,解决了23 个与数据完整性相关的问题。与FDA 指南不同的是,EMA 指南贯彻ICH Q9 的理念,侧重于在数据完整性方面应用质量风险管理方法,多次提到“风险评估”的概念。同时,EMA 指南着重阐述“数据生命周期”这一概念,23 个问题中有9 个(Q3 - Q11)被明确标明与数据生命周期有关,认为应在数据生命周期的每个阶段均衡考虑数据的风险性和关键性。最显著的差别是,EMA 指南的最后五个问题(Q19 - Q23)中明确了服务合同的提供方和接受方双方在数据完整性领域的职责和期望,而FDA 指南中完全没有提到任何与服务合同相关的信息。
值得一提的是,尽管各指南都很重视风险管理工具在数据管理中的应用,但对于数据风险的分级以及数据完整性风险管理方法没有具体的解释与示例。2019年3月,欧洲化学工业委员会的分支机构The Active Pharmaceutical Ingredients Committee (APIC)发布了《基于风险的数据完整性管理实践指南》[9]。这份指南着重介绍了一种全面的数据完整性风险管理方法,以整体的角度评估组织的数据完整性,从较高层次的业务流程进一步深入到较低层次,最后挖掘到涉及GXP 数据的单个活动或系统,并采用图形方式展示了该方法的步骤顺序,为企业在数据完整性中应用风险管理方法提供完整的示范,是一份实用性技术指南。
3 FDA 警告信统计分析
3.1 警告信的来源
从FDA 官方网站的警告信数据库中筛选出2014—2019年FDA 针对美国以外的其他国家/地区企业发布的所有与药品cGMP 相关的警告信,共245 封。
3.2 警告信的总体分类统计
3.2.1 各年份分布情况
2014—2019年FDA 发给美国境外企业的药品cGMP相关警告信共245 封。2011—2015年药品cGMP 警告信的数量每年稳定在19 ~ 22 封之间[10],2016年警告信的数量锐增至43 封,2017年高达61封,成为发布cGMP 警告信数量最多的年份,而后的2018 和2019年分别有57 和45 封。由于药品生产质量相关问题频繁出现,因而FDA 的检查力度逐渐加强,如图1所示。
3.2.2 地区分布情况
2014—2019年FDA 发出的245 封警告信共涉及33 个国家和地区(见表2)。2014—2019年警告信分别涉及8、9、14、13、14、14 个国家和地区,这体现了FDA 的药品cGMP 国际检查范围更加广泛,尤其亚洲地区的国家数目明显增加,韩国、新加坡、马来西亚等国是在2017年后新增加入收到警告信的国 家。
2014—2019年收到警告信数量最多的国家是中国(大陆)(73 封)、印度(73 封),紧随其后的是欧洲(31 封)。值得关注的是,美国FDA 与欧盟的互认协议(the Mutual Recognition Agreement,MRA)已于2018年11月28日生效,通过互认协议,美欧双方监管机构可以避免重复检查,从而节约必要的资源,将重点放在其他更需要监管的场地上[11]。美国FDA 于2019年7月11日完成对斯洛伐克国家药品管控研究所的认可,至此完成了对所有28 个欧盟成员国药品检查机构的能力评估,这也意味着美国FDA 发给欧洲国家的警告信将会有所减少。从现有数据来看,2017年欧洲国家收到的警告信有8 封,2018年5 封,到了2019年仅有2 封。互认协议使得美国FDA 将考虑把节约下来的资源重新整合到高风险国家的检查上,如印度和中国的生产场地。
3.2.3 企业分布情况
2014—2019年美国FDA 检查的生产场地涉及原料生产企业(81 封)、制剂生产企业(150 封)和原料药及制剂生产企业(8 封),在2014、2016、2018年和2019年存在由于企业拒绝、拖延、误导检查人员对生产的核查而发出各1、3、1、1 封警告信,各年份的企业具体分布情况如图2所示。由图2的趋势分析,美国FDA 各年对原料药生产企业的检查力度较平稳,而在近三年明显加大对制剂生产企业的检查力度,由于制剂是直接面向患者且具有高风险的特点,对制剂生产企业的趋严监管应该是一个长期的事 态。
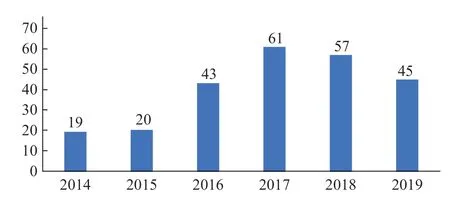
图1 2014—2019年FDA 药品cGMP 警告信数量Fig.1 Quantity of FDA drug cGMP warning letters from 2014 to 2019

图2 2014—2019年药品cGMP 警告信的企业分布情况Fig.2 Enterprise distribution of drug cGMP warning letter from 2014 to 2019
3.3 数据完整性缺陷统计分析
3.3.1 涉及数据完整性缺陷的警告信统计
美国FDA 在20年前就开始在数据完整性方面采取检查和执法行动,涉及这一主题的警告信的数量从2014年的12 封和2015年15 封,在2016年翻了一番骤增到33 封,在2017年持续增长至43 封,如表2所示。同时收到有关数据完整性缺陷警告信的国家数量也在增加。印度曾是收到此类警告信的主体,而在过去的三年里,中国(大陆)登上了榜首,占近六年总数的34.3%,其生产企业收到的警告信超过80%涉及数据完整性缺陷,如表3所示。不难看出,FDA 在近几年的检查中持续关注数据管理和数据完整性。
3.3.2 数据完整性主要缺陷概括
美国FDA 对药品生产企业的检查重点是具有动态性和时效性的,通过近几年下发的警告信可知,数据管理和数据完整性是当前的检查重点之一。根据对2014—2019年的数据完整性缺陷项的分类统计可知,相关缺陷项共涉及303 条,频次较高的前三项分别是实验室系统(即自动化、机械化及电子设备)控制、实验室完整数据、主生产和批生产记录控制。从统计中可以发现,出现频次最高的前三项缺陷占总缺陷频次的52%,前6 项占总缺陷频次的83%,这说明数据完整性问题相对集中,不同国家/地区的药品生产企业在这一方面存在共性。另一方面,可以看出有些缺陷项是新侧重点,并在后续几年内被持续关注,如从2016年开始关注药品放行前的实验室检测,要求对于每批药品应在放行前进行适当的实验室测定,以确保符合药品的最终标准,需要这部分的验收测试记录来支持在美国市场销售的药品;如对稳定性测试数据的关注度趋高,要求应对每种药品的足够数量的批次进行稳定性试验,以确定适当的失效日期,并保存所有稳定性试验的完整记录。FDA 检查过程中数据完整性缺陷常见如下情形:
(1)实验室数据维护不当。实验室记录应包括为确保药品符合既定规范和标准而进行所有必要试验(包括检验和分析)的完整数据[9]。由于制药企业实验室涉及的分析样本多、数据量大,一直是数据完整性检查的重点区域。警告信中常引用的问题有:在色谱软件中删除或覆盖原始数据;未保存基本的色谱资料,如进样序列、进样方法、积分参数记录;有选择地报告数据或在检测过程中有选择地使数据无效;在无书面证明或调查的情况下对样品进行重新测试;官方实验室控制记录中未报告或调查OOS 结果或丢弃了与OOS 结果相关的样品制备原始数据;在正式检测前使用样品试针但不报告该次结果等。

表2 药品cGMP 警告信的地理分布统计Tab.2 Geographical distribution statistics of drug cGMP warning letters
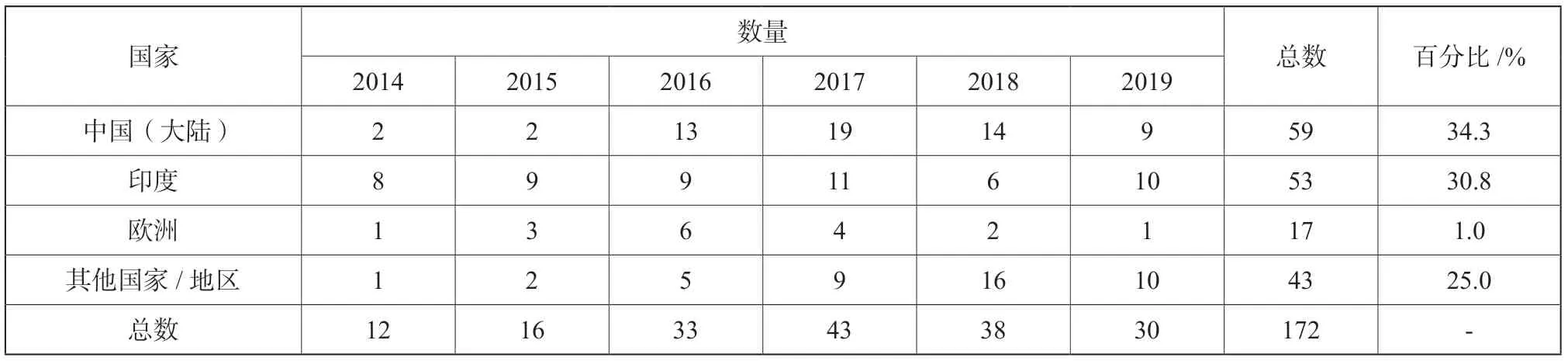
表3 不同国家/地区涉及数据完整性问题的总量和百分比Tab.3 Quantity and percentage of data integrity issues in different countries
(2)实验室系统控制不足。实验室设备计算机控制/数据采集处理分析系统包括HPLC/UPLC、GC、NMR、CDS 色谱工作站等,应对这些系统进行适当的控制,以确保主要生产、控制记录或其他记录的变更仅由授权人员进行,防止未经授权的数据访问更改[12]。从警告信中可看出,常见的问题有:设备缺乏审计跟踪功能、该功能未激活或被禁用,无法记录数据的更改;使用共享登录账户访问色谱系统,所有用户都有管理员权限,无法使计算机化系统生成的数据追溯到个人;软件系统的时间日期未被锁定,用户可以更改分析时间和日期;分析人员可以随意更改或删除色谱图;分析人员可以改变积分参数以掩饰或最小化杂质峰等。
(3)主生产和批生产记录控制不足。cGMP 要求所有的生产过程均需记录,生产记录是美国FDA 检查的重中之重,从原料的入库、入厂检验及发放、生产工艺过程的控制、中间体及成品的检验等均要求有完整的原始记录及全套批记录。每批药品的生产和控制记录,应由一人填写,注明日期和签名,并由另一人独立复核,注明日期和签字[12]。主要缺陷项包括:没有在活动执行同时完成批生产和控制记录;使用非受控文件如草稿纸记录关键生产数据,且此非正式记录的数据与质量部门审核的正式批记录上的数据不一致;记录上缺少关键信息,如原料药的称重质量、产品批号、操作人和复核人的签字等;预先签署空白的批生产记录,伪造生产数据等。
(4)省略和篡改分析证书(COA)。监管机构和客户依赖于COA 提供有关药品质量的准确信息,省略和篡改COA 上的信息会损害原料供应链的责任和可追溯性,可能导致消费者面临风险,因此FDA 在2017年再次聚焦对COA 的检查。常见的问题有:企业重新包装API 时将原分析结果转移到以自己公司为信头的新的COA 上;伪造COA,没有进行COA上报告的测试;COA 上缺少部分关键信息,如原生产商的名称和地址、测试设备的标识等。
(5)其他缺陷:如过多地中止正在进行的样本分析以掩盖OOS 结果;限制、妨碍FDA 检查,拒绝提供文件副本等。

表4 2014—2019年FDA 警告信数据完整性缺陷项统计Tab.4 Statistics of data integrity defects in FDA warning letters from 2014 to 2019
3.3.3 数据完整性修复
一般而言,当FDA 在现场检查中观察到严重的数据缺陷时,其后续下发的警告信中会针对这一问题提出修复建议。通过对这些建议的分析总结可以发现,FDA 十分重视纠正措施与预防措施(Corrective Action & Prevention Action,CAPA)程序的应用。当存在数据和记录维护不当的缺陷时,企业首先要对整个数据系统和数据、记录及报告不准确情况进行全面、独立的回顾性审核,调查数据和记录不准确的程度、范围和根本原因,并制定CAPA 计划,同时进行风险评估,总结不完整数据对实验室结果和产品质量的影响,采取一定的纠正措施如通知客户、召回药品等。实际上,企业的质量系统是保证数据完整、准确、可靠的关键,应进一步强化质量部门对数据的监管,及时识别不良数据操作行 为。
4 讨论
药品cGMP 警告信具有权威性,通过分析警告信可以理解FDA 对药品的检查重点和现场检查思路,发现国际制药行业普遍存在的质量问题,企业可以从中汲取经验教训从而改进质量管理体系。FDA 近年来对数据管理和数据完整性领域关注度持续上升,企业应将数据完整性纳入质量管理体系中,从人、机、料、环、法五个层面对其进行控制。
第一,应明确不同层次人员的职责。管理层应确保实施有效、专业且有意义的策略来实现良好的数据管理,建立企业内部数据管理政策和程序,完善数据完整性员工培训,将对数据完整性的评估纳入内部GMP 审计中,必要时可以聘请第三方专家进行数据完整性审计。其他级别的员工(操作人、复核人、批准人)都必须了解数据完整性的重要性,以及其所在工作岗位可以对GXP 数据产生影响的程度[9]。
第二,应定期校验、验证设备和计算机化系统,以确保其始终保持有效状态。实验室色谱系统的安全性决定电子记录的完整、准确的程度,企业应为访问人员设置独立账户和密码、划分权限并管理,系统管理员角色(具有更改文件和设置权限)应独立于负责记录的人员,增加系统定时自动退出功能防止未经授权的访问。企业应确保系统的审计跟踪功能正常运行,保证固定、完整的时间戳,并及时更新计算机化系统,建立预防维修程序、以及备份和恢复策略。
第三,应保证物料的信息完整。对于外购的物料,要进行入厂检验并保存检验记录,生成正确的COA,2019年FDA 着重关注物料入厂检验程序,其下发的警告信中存在13 家生产企业未对进厂物料进行检测,违反21 CFR 211.84(d)(1)&(2)条例;对于企业生产的中间体和成品,应有相应的批号/编号,保存其生产记录和检测数据,确保可追溯性。
第四,应创造一个透明且开放的工作环境(即质量文化)。基于以上的数据完整性指南,显然可以看出各监管机构将质量文化视为确保数据完整性的重要因素。企业应创造一种开放、透明的质量文化,让员工了解数据完整性是组织的核心价值,鼓励员工识别并及时报告问题[3]。
第五,应实时跟踪法规政策和执法行动。数据管理和数据完整性仍然是全球卫生当局执法行动的焦点之一,各国家/地区都出台了相应的指南。企业应实时跟进相关法规政策的落地,根据数据完整性的法规要求,进行全面的差异分析,调查确定问题的范围和根本原因,并对其潜在影响进行科学合理的风险评估。企业也可利用各监管机构的执法行动报告,如美国FDA 药品cGMP 警告信、欧盟不合规报告,我国飞行/跟踪检查通报等信息,了解目前的检查重点和趋势变化。

