不同施肥措施对桉树人工林土壤细菌群落结构及多样性的短期影响
李超,许宇星,吴志华,方良,张沛健
不同施肥措施对桉树人工林土壤细菌群落结构及多样性的短期影响
李超,许宇星,吴志华*,方良,张沛健
(国家林业和草原局桉树研究开发中心,广东 湛江 524022)
为探索桉树人工林土壤细菌群落对不同施肥措施的响应特征,本研究利用Illumina高通量测序技术,分析不同施肥处理下桉树人工林土壤细菌的群落结构、多样性及与土壤环境因子之间的关系。结果表明:(1)高施肥量处理虽然对土壤全氮、磷、钾含量未产生显著影响,但显著增加了土壤速效氮、有效磷、速效钾含量;随着施肥量的增加,pH呈现升高趋势但差异不显著。(2)桉树人工林土壤细菌门水平优势群落主要为绿弯菌门Chloroflexi、变形菌门Proteobacteria、放线菌门Actinobacteria和酸杆菌门Acidobacteria,不同施肥处理间土壤细菌群落多样性及丰富度均产生显著差异,施肥处理显著增加了土壤细菌丰富度而降低了其细菌多样性指数。(3)施肥处理显著改变桉树人工林土壤优势细菌门类的相对丰度,如绿弯菌门Chloroflexi以及放线菌门Actinobacteria的群落相对丰度。(4)冗余分析表明,全氮TN、全磷TP、pH与细菌群落结构相关性较强,是影响细菌群落结构的主要环境因子。放线菌门Actinobacteria对环境因子变化的响应极其敏感,与有效磷AP、有机质OM、全磷TP、全氮TN、全钾TK、pH、有效钾AK、有效氮AN均呈显著的负相关。
桉树人工林;土壤细菌;施肥;微生物群落结构
桉树()作为世界三大速生树种之一,在我国南方广泛种植。截至2018年,我国桉树人工林面积达546.74万公顷[1]。桉树实现了仅用全国2%的林地生产了全国25%的木材的目标,对林业带来了巨大的经济效益和生态效益[2]。近年随着桉树人工林的快速增长,长期高强度多代的经营模式导致桉树人工林出现土壤地力衰退、养分过度消耗、林下物种多样性减少等生态与环境问题[3-4],广受社会关注。如何对桉树人工林土壤质量进行改善是实现桉树人工林生态系统向良性循环方向发展、保障林业可持续经营的关键[5]。
施肥能够改变土壤的理化性质,改善土壤养分有效性,显著影响土壤中碳、氮、磷库以及土壤微生物量,从而影响土壤微生物结构及功能类群,对提高植物生产力具有重要的作用,对生态系统的生物地球化学过程产生影响[6-8]。土壤微生物作为土壤肥力和健康程度的重要指标,比土壤理化性质更能准确地反映土壤质量,能更有效地响应土壤质量变化[9-10]。合理施肥可显著影响土壤的微生物群落,从而直接或间接地影响土壤微生物生物量及人工林产量[11]。
施肥作为目前提高桉树人工林生产力最直接有效的方法[6],也是森林经营中抑制地力衰退的一种有效措施。关于桉树施肥效果的研究已有相关报道[12-15],而关于土壤细菌群落特征是如何响应施肥措施的研究较少。因此,本研究以新建2 a生桉树人工林土壤为研究对象,通过高通量测序技术,探索桉树土壤细菌群落组成结构及多样性对不同施肥措施的响应特征,以及导致土壤细菌群落差异的影响因子,将有助于对桉树人工林土壤质量进行评价和改善,对桉树人工林的科学施肥及可持续健康发展具有重要的现实意义。
1 材料与方法
1.1 试验地概况
试验地位于广东省湛江市南方国家级林木种苗示范基地(21°30′ N,111°38′ E),属北热带湿润大区琼雷区北缘,为海洋性季风气候,年平均气温23.1℃,极端最低温为1.4℃,极端最高气温为38.1℃,年降雨量1 567 mm,年相对湿度80.4%[16]。试验林前茬为8 a生大花紫薇()林,砍伐后于2018年4月选取长势均一的尾巨桉()幼苗(20 cm ± 2 cm)造林,初植密度均为2 m × 3 m,每公顷约1 650株。造林后,每年上半年在距离根桩50 cm处完成1次追肥(芬兰复合肥N:P2O5:K2O = 15:15:15)。
1.2 试验设计与土壤样品采集
本次施肥试验共设置100、300、500 g·株-13个处理并以邻近未砍伐大花紫薇林土壤为对照处理(施肥量为0 g·株-1),分别编号为F100、F300、F500、CK。2019年12月,在每个处理中设置3个20 m × 20 m 样地,每个样地间大于50 m,采用多角线多点随机采集0 ~ 20 cm表层土壤,在每个样地内随机选取9个点混合成1个土样,每个处理共计得到3个土壤样品。每个样品中,取约10 g新鲜土壤放入灭菌的离心管并立即放入液氮中用于细菌群落结构分析,样品尽快保存到实验室-80℃的冰箱中。剩余样品自然风干后过2 mm的筛用于化学性质测定。
1.3 分析方法
土壤pH值采用pH计进行测定(1:2.5土水比),土壤有机质采用水合热重铬酸钾-硫酸-比色法,全氮TN和速效氮AN分别采用开氏定氮法和碱解扩散法,全磷TP和有效磷AP分别采用碱熔-钼锑抗比色法和硫酸-盐酸双酸法,全钾TK和速效钾AK均采用火焰光度法[17]。
土壤微生物采用CTAB方法进行DNA提取,并利用琼脂糖凝胶电泳检测提取DNA纯度及浓度,取适量样品利用无菌水在试管中稀释至1 ng·μl-1作为模板,细菌扩增区域为16SV3-V4,所选取引物为341F(CCTACGGGNGGCWGCAG)-805R(GACTACHVGGGTATC- TAATCC)。使用Bio-rad T100梯度PCR仪(T100TM Thermal Cyeler)进行PCR,其产物使用2%浓度的琼脂糖凝胶进行电泳检测。根据PCR产物浓度进行等浓度混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物,割胶回收目标条带。产物纯化试剂盒使用的是Thermo Scientific公司GeneJET 胶回收试剂盒。使用New England Biolabs公司的NEB Next Ultra DNA Library Prep Kit for Illumina建库试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测,每个样品DNA量取10 ng,进行上机测序。
1.4 数据处理与分析
利用Usearch 软件(Usearch 8.1.1831)将所有样本序列按照序列间的距离进行聚类,后根据序列之间的相似性将序列分成不同的操作分类单元 (OTU)。通常在97%相似水平下的OTU进行生物信息统计分析。在OTU聚类结果的基础上,获取OTU聚类中的代表性序列,选择丰度最高的序列作为OTU的代表性序列,进行各类的OTU分析。调用Mothur软件,计算各个样品的Chao1指数、Ace指数、Shannon指数、Simpson指数值。
采用SPSS 17.0对试验期土壤化学性质进行单因素方差分析,并完成LSD检验。利用R software package v.3.2.3对不同菌群结构间的差异进行PCoA分析。同时利用 SPSS软件的皮尔森相关分析(Pearson correlation analysis)和典型相关分析(Canonical Correlation),结合Canoco for windows 软件(version 4.5)进行冗余分析,把握环境因子同细菌群落结构及α-多样性的相关关系。
2 结果与分析
2.1 不同施肥量桉树人工林土壤化学性质分析
不同施肥量桉树人工林土壤化学性质存在显著差异(表1)。由表1可知,随着施肥量的增加,pH逐渐升高,但未产生显著差异。与CK相比,F100处理使土壤有机质含量下降,但随着施肥量的增加,有机质含量逐渐回升,当施肥量达到500 g·株-1时,土壤有机质含量恢复到CK土壤水平。不同施肥处理间土壤全氮、全磷、全钾含量未产生显著差异,但高施肥量处理显著增加了土壤速效氮、有效磷、速效钾含量。

表1 不同施肥措施下桉树人工林土壤化学性质
注:1.F100、F300和F500分别表示施肥量为100、300和500 g·株-1
2.同行数据后不同小字字母表示P<0.05
2.2 不同施肥措施桉树人工林土壤细菌群落α-多样性分析
本次采用对测序进行随机抽样的方法,对抽样序列与所代表OTU数目构建稀释曲线(图1)。图1显示4个处理12个土壤样品的稀释曲线趋于平缓,表明测序数据渐进合理,更多的测序数据对新的OTU贡献率非常小。
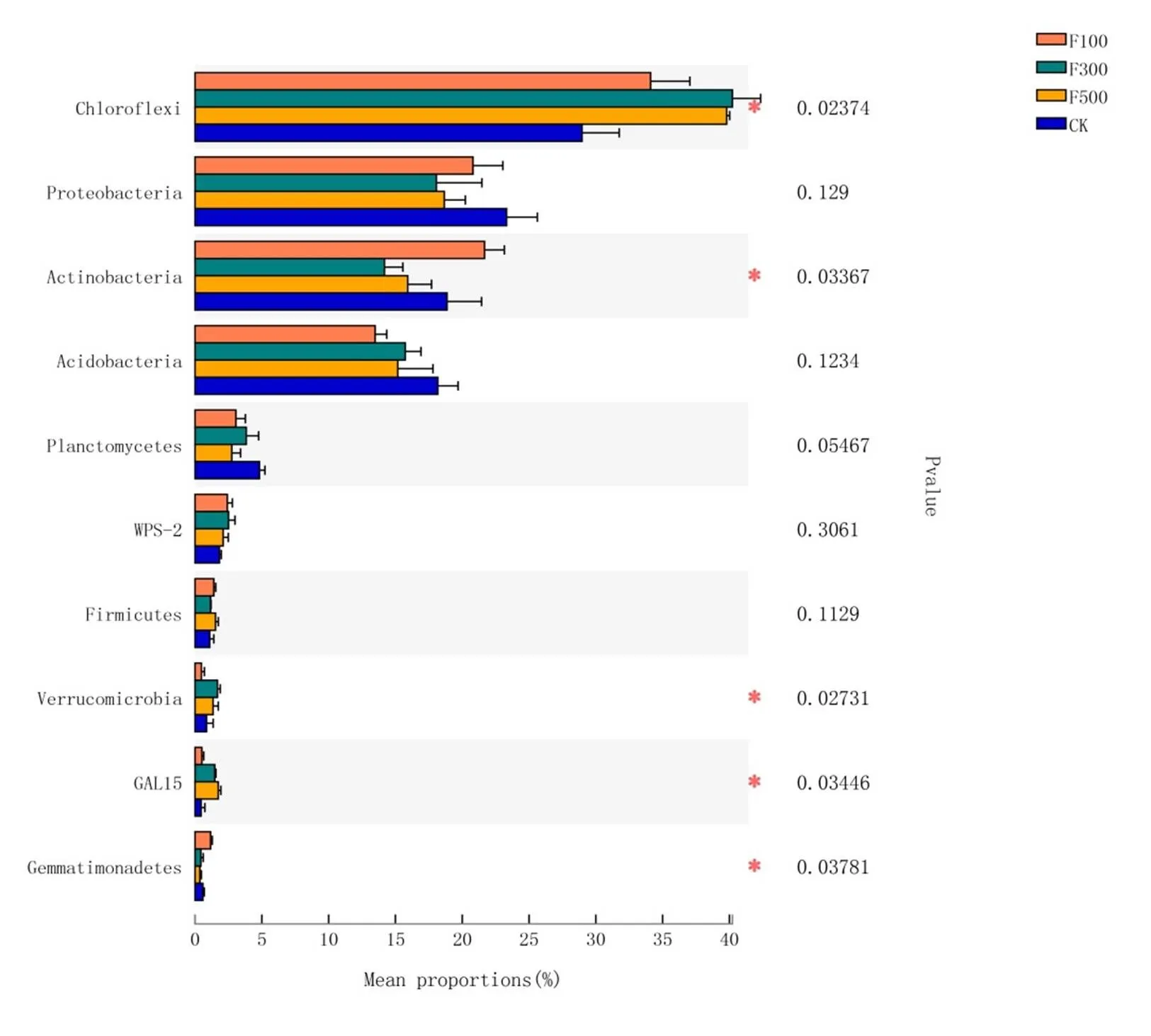
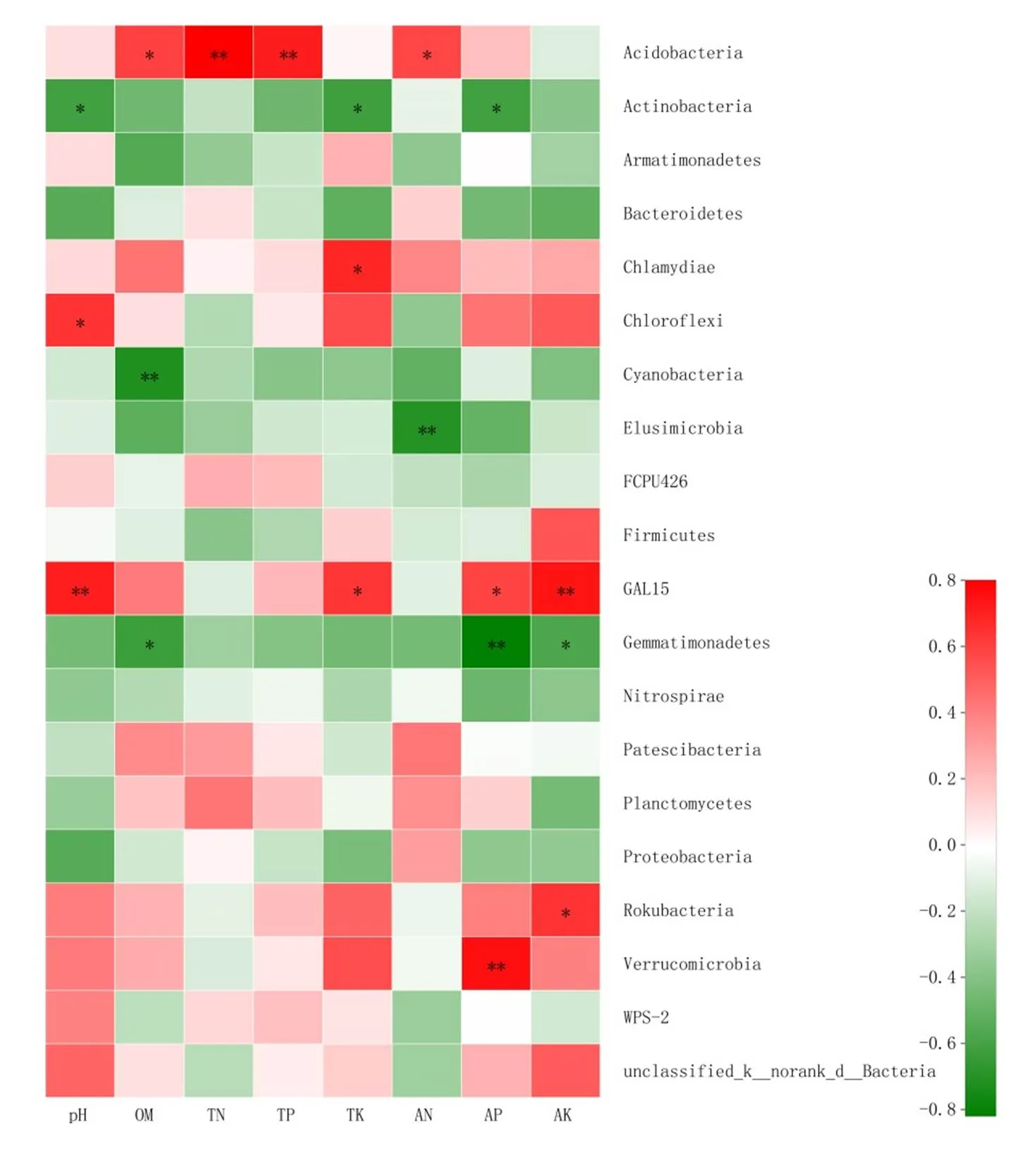
OTU水平的细菌群落α-多样性结果表明(图2),不同施肥处理间桉树人工林土壤细菌群落多样性及丰富度均产生显著差异,施肥处理显著增加了土壤细菌丰富度而降低了土壤多样性指数。其中,F300处理的Chao1指数、ACE指数均高于或显著高于其他处理和CK,具体顺序表现为F300>F500>F100>CK ,而F300和F500处理的多样性指数(Shannon和Simpson指数)显著低于F100和CK处理,按大小表现为Shannon指数: CK > F100> F300> F500,Simpson指数:CK 图1 不同施肥措施下桉树人工林土壤细菌稀释曲线 图2 不同施肥措施下桉树人工林土壤细菌微生物多样性 基于12个土壤样品OTU水平构建主坐标分析显示(图3),施肥处理的细菌群落结构与CK显著分开,第一主成分解释了群落结构差异的42.77%,第二主成分解释了群落结构差异的34.81%,共同解释了细菌群落结构差异的77.58%。此外,不同施肥处理间桉树人工林土壤细菌群落组成存在明显差异,这表明施肥对土壤细菌群落结构存在较大影响。其中,CK、F100和F300处理的细菌群落相对独立,但F500处理的土壤样本点分布与F300处理样本点相对集中,说明施肥量从F300增加到F500,并未引起土壤细菌群落结构的显著变化。 施肥对桉树土壤细菌群落组成及其相对丰度在门水平的影响如图4所示。由图4可知,桉树土壤的优势细菌为绿弯菌门Chloroflexi (28.97% ~ 40.22%)、变形菌门Proteobacteria(18.07% ~ 23.32%)、放线菌门Actinobacteria(14.18% ~ 21.67%)和酸杆菌门Acidobacteria(13.48% ~ 18.17%)。 图3 不同施肥措施下桉树人工林土壤细菌PCoA分析 图4 不同施肥措施下桉树人工林土壤细菌门水平群落组成饼图 由图5可知,绿弯菌门Chloroflexi的群落丰度在CK处理中显著低于其他3个施肥处理,其他优势细菌如放线菌门Actinobacteria、疣微菌门Verrucomicrobia、GAL15、芽单胞菌门Gemmatimonadetes等在4个处理间也产生了显著差异。 图5 不同施肥措施下桉树人工林土壤细菌门水平差异 土壤各化学性质同各处理门水平细菌丰度的冗余分析表明(图6),全氮TN、全磷TP、pH与细菌群落结构相关性较强,是影响细菌群落结构的主要环境因子。其中放线菌门Actinobacteria与AP、OM、TP、TN、TK、pH、AK、AN均呈显著的负相关,绿弯菌门Chloroflexi含量与pH、TK呈显著正相关,酸杆菌门Acidobacteria含量与OM、TN、TP、AN呈显著正相关,疣微菌门Verrucomicrobia含量与pH、AP呈显著正相关,芽单胞菌门Gemmatimonadetes含量与pH、OM、AP、AK呈显著负相关,GAL15含量与pH、TK、AP、 AK呈显著正相关,变形菌门Proteobacteria与各环境因子相关性不显著(图7)。 图6 不同施肥措施下桉树人工林土壤细菌门水平冗余分析 图7 不同施肥措施下桉树人工林土壤细菌与环境因子相关性热图 (1) 随着施肥量的增加,pH虽呈现升高趋势,但未达到显著差异。高施肥量处理显著增加了土壤速效氮、有效磷、速效钾含量。说明施肥有效提高了土壤可溶性养分含量/肥力,改善土壤酸碱度,这与前人研究结果一致[18]。 (2) 本研究显示两年生桉树人工林土壤的优势细菌为绿弯菌门Chloroflexi(28.97% ~ 40.22%)、变形菌门Proteobacteria(18.07% ~ 23.32%)、放线菌门Actinobacteria(14.18% ~ 21.67%)和酸杆菌门Acidobacteria(13.48% ~ 18.17%)。此外,不同施肥处理间土壤细菌群落多样性及丰富度均产生显著差异,施肥处理显著增加了土壤细菌丰富度而降低了其多样性指数。 (3) 施肥显著改变桉树人工林门水平土壤细菌的相对丰度。其中,绿弯菌门Chloroflexi的群落丰度在CK处理中显著低于其他3个施肥处理,表明施肥能显著增加绿弯菌Chloroflexi的群落丰度。 (4) 冗余分析表明,pH、AN、AP与细菌群落结构相关性较强,是影响细菌群落结构的主要环境因子。不同的微生物类群对各环境因子的响应特征各异,其中放线菌门Actinobacteria与AP、OM、TP、TN、TK、pH、AK、AN均呈显著的负相关,表明放线菌门Actinobacteria对土壤环境因子变化的响应极其敏感。放线菌是产生抗生素和酶的重要微生物资源之一,对植物病害的防治具有一定作用[19]。如何让微生物与植物在生态系统中更好的互利共生,达到更加长期稳定的生态平衡,还有待进一步研究。 [1] 国家林业和草原局.中国森林资源报告(2014-2018)[M].北京:中国林业出版社,2019. [2] 谢耀坚.真实的桉树[M]. 北京:中国林业出版社, 2015. [3] 徐大平,张宁南.桉树人工林生态效应研究进展[J].广西林业科学,2006,35(4): 179-187. [4] WASSIE A, WUBALEM A,LIANG J, et al. Effects of exoticspp. plantations on soil properties in and around sacred natural sites in the northern Ethiopian Highlands[J]. AIMS Agriculture and Food,2016,1(2): 175-193. [5] 胡治刚,胡江春,刘丽,等.海洋微生物复合制剂对桉树人工林土壤质量的影响[J].生态学杂志,2009, 28(5):915-920. [6] 陈祖静,高尚坤,陈园,等.短期施肥对桉树人工林土壤真菌群落结构及功能类群的影响[J].生态学报,2019,40(11):1-9. [7] LI Y, NIU S L, YU G R. Aggravated phosphorus limitation on biomass production under increasing nitrogen loading: a meta-analysis[J].Global Change Biology,2016,22(2):934-943. [8] BEDADA W, LEMENIH M, KARLTUN E.Soil nutrient build-up, input interaction effects and plot level N and P balances under long-term addition of compost and NP fertilizer[J].Agriculture Ecosystems & Environment, 2016,218:220-231. [9] VIMAL S R, SINGH J S, ARORA N K, et al. Soil-Plant-Microbe Interactions in Stressed Agriculture Management: A Review[J].Pedosphere,2017, 27(2):177-192. [10] SONG D L, XI X Y, ZHENG Q, et al.Soil nutrient and microbial activity responses to two years after maize straw biochar application in a calcareous soil[J].Ecotoxicology and Environmental Safety,2019,180:348-356. [11] 李超.正视桉树人工林生态问题[J].桉树科技,2015, 32(4):54-58. [12] 陈少雄.桉树人工林土壤养分现状与施肥研究[J]. 桉树科技,2009,26(1):53-64. [13] 曹继钊.广西桉树人工林土壤肥力状况及施肥效应研究[D].南宁:广西大学,2011. [14] 吴华静,梁士楚,田丰,等.不同经营措施对尾巨桉人工林土壤呼吸的影响[J].西南林业大学学报,2016, 36(5):58-64. [15] 杨盛军,李昌荣,郭东强,等.广林巨尾桉5号无性系配方肥选择[J].广西林业科学, 2018, 47(1): 80-84. [16] 雍强,陈彪,林波,等.雷州半岛不同林龄尾巨桉人工林凋落物产量、养分归还及分解动态研究[J].桉树科技,2019,36(3):16-21. [17] XU Y X,DU A P,WANG Z C, et al.Effects of different rotation periods ofplantations on soil physiochemical properties, enzyme activities, microbial biomass and microbial community structure and diversity[J].Forest Ecology and Management, 2020,456:117683. [18] HASSELQUIST N J, HOGBERG P. Dosage and duration effects of nitrogen additions on ectomycorrhizal sporocarp production and functioning: an example from two N-limited boreal forests[J].Ecology and Evolution,2014, 4(15):3015-3026. [19] 贾雨,贾丽苑,黄建新.放线菌对植物病害的防治作用及应用[J].西安文理学院学报(自然科学版),2012,3(1):12-16. Short-term Effects of DifferentPlantationFertilization Treatments on Soil Bacterial Community Structure and Diversity LI Chao, XU Yuxing, WU Zhihua, FANG Liang, ZHANG Peijiang () In order to investigate the responses of soil bacterial communities to different fertilization measures inplantations, Illumina high-throughput sequencing was performed in this study. The soil bacterial community structure, diversity and their relationships with various impact factors were analyzed under different fertilization measures. The results showed the following: (1)The contents of available nitrogen, available phosphorus and available potassium in the soil were significantly increased by high rates of fertilizer application; with increasing fertilizer application, pH tended to increase but differences were not significant. (2)The dominant bacteria, at the phylum level, in soils ofplantations were Chloroflexi, Proteobacteria, Actinobacteria and Acidobacteria. The diversity and richness of soil bacterial communities differed significantly among different fertilization treatments, with higher rates of fertilizer being associated with significant increases in soil bacterial richness but decreases in soil bacterial diversity. (3)The relative abundance of dominant bacterial groups, such as Chloroflexi and Actinobacteria communities, inplantation soils differed significantly among different fertilization treatments. (4)Redundancy analysis showed that total nitrogen, total phosphorus and pH had a strong correlation with bacterial community structure, and these were the main environmental factors associated with bacterial community structure. Actinobacteria were found to be extremely sensitive to changes in environmental factors, and their abundance was negatively correlated with available phosphorus, organic matter, total phosphorus, total nitrogen, total potassium, pH, available potassium, and available nitrogen. plantations; soil bacterial community; fertilization measures;microbial community structure 10.13987/j.cnki.askj.2020.01.002 S154.3 A 中国林业科学研究院基本科研业务费专项资助人才项目(CAFYBB2018QA010);“十三五”国家重点研发计划课题(2017YFD0601202) 李超(1987- ),女,硕士,工程师,主要从事森林保护研究,E-mail:d.lichao@163.com 吴志华(1974- ),男,硕士,副研究员,主要从事林木逆境生理研究,E-mail:wzhua2889@163.com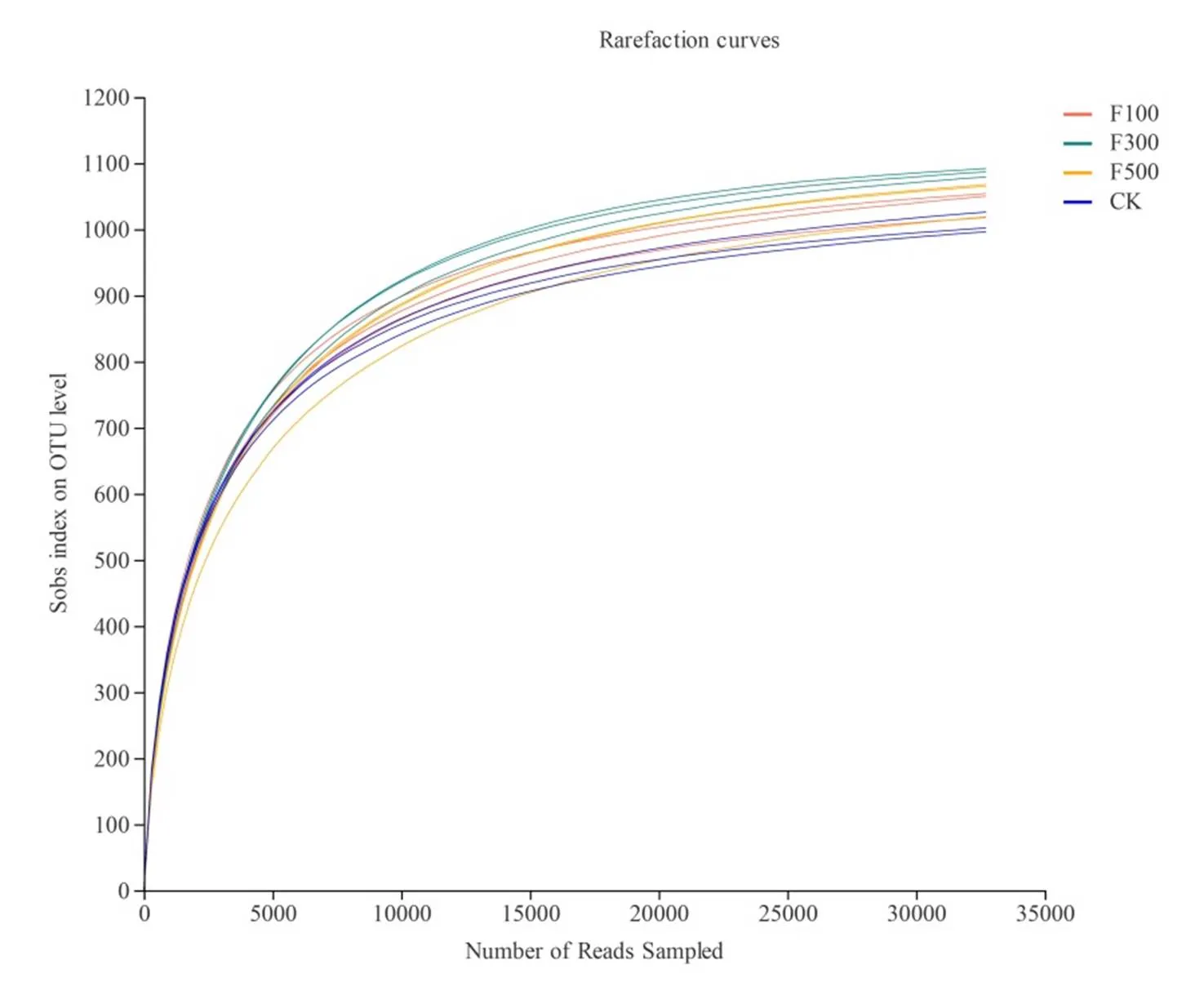

2.3 不同施肥措施土壤细菌群落结构特征
2.4 不同施肥措施桉树人工林土壤主要细菌门水平差异


2.5 不同施肥措施土壤化学性质与细菌群落结构特征的关系

3 结论与讨论

