低氘水联合富血小板血浆对大鼠糖尿病溃疡创面愈合的影响
王湘琦,赵超然,熊爱兵
西南医科大学附属医院烧伤整形外科,泸州 646000
糖尿病足溃疡(diabetes foot ulcer,DFU)是常见的糖尿病慢性合并症之一,是导致糖尿病患者截肢致残的主要原因。溃疡的发生被认为是截肢的前兆,而下肢截肢经常会导致糖尿病患者死亡,70%的患者在截肢手术后5年内死亡[1-2]。DFU的高截肢率和高死亡率,严重影响患者的生活质量,给家庭带来了经济负担。因此,预防和治疗DFU十分重要。富血小板血浆(platelet-rich plasma,PRP)属于血小板浓缩物,含有大量高浓度的生长因子,可促进软组织的修复。前期有学者研究发现,PRP对于糖尿病溃疡创面愈合有独特的优势和效果[3],在统计学上有更高的愈合率和更低的并发症发生率[4]。低氘水(deuterium depleted water,DDW)为氘体积分数低于0.015%的水[5],有一系列生物学效应,如抗氧化、防衰老、抗抑郁、抗辐射、保护心血管系统、降血糖、抗肿瘤等作用[6]。本实验拟观察DDW联合PRP在大鼠糖尿病溃疡创面中的作用。
1 材料与方法
1.1 动物
健康清洁级雄性 SD 大鼠120只,质量160~200 g,购自辽宁长生生物股份有限公司,生产许可证号为SCXK(辽)2015-0001,饲养于西南医科大学实验动物中心。
1.2 主要仪器与试剂
链脲佐菌素(streptozotocin,STZ)、柠檬酸、柠檬酸三钠、葡萄糖均购自北京索莱宝公司;水合氯醛(源叶生物);大鼠基质金属蛋白酶-9(MMP-9)、组织金属蛋白酶抑制物 -1(TIMP-1)Elisa试剂盒(上海酶联生物科技有限公司);高速冷冻离心机(Eppendorf);酶标仪(Rayto,RT-6100);洗板机(Tianshi,988洗板机);电热恒温箱(武汉-恒苏净科学仪器有限公司);移液器(Finnpipette,20~200 μL);罗氏血糖仪(活力型)、罗氏血糖试纸、飞科剃刀;高脂高糖饲料(67%大鼠维持饲料+10%猪油+20%蔗糖+2.5%胆固醇+0.5%胆酸钠,由北京科澳协力饲料有限公司提供);大鼠普通饲料(成都达硕生物科技有限公司);低氘水(泸州哈罗德健康科技有限公司)。本实验用水符合三级水标准。
1.3 动物分组及模型的建立
健康清洁级雄性SD大鼠120只,适应性喂养1周后,选100只随机分为正常对照组(n=20)和糖尿病组(n=80),分别称取2组大鼠体质量,测随机血糖。剩余20只大鼠用于制取PRP,普通饲料饲养,不参与造模与分组。
1.3.1 糖尿病大鼠溃疡模型的建立及分组 糖尿病组大鼠予以高脂高糖饲料饲养。饲养4周后,禁食12 h(不禁水),给予1% 的STZ 溶液(临用前用0.1 mol/L、pH4.5的柠檬酸 - 柠檬酸钠缓冲液配制,冰浴、避光操作)单次腹腔注射(30 mg/kg),7 d后采用尾静脉采血法测大鼠随机血糖,血糖≥16.7 mmol/L表示糖尿病模型大鼠建立成功[7]。成模后以7% 水合氯醛(0.5 mL/100 g)腹腔注射进行麻醉,备皮消毒,在背部制作约3 cm×3 cm的正方形创面,深达筋膜。拍照后医用纱布覆盖创面,胶带包扎固定。将造模成功[8-9]的72只大鼠随机分为糖尿病模型组(B组)、PRP组(C组)、低氘水组(D组)及低氘水联合PRP组(E组),每组各18只。
1.3.2 正常大鼠溃疡模型建立 正常对照组(A组)继续予普通饲料喂养4周后,禁食12 h,不禁水,在相同操作条件下注射等体积的柠檬酸 - 柠檬酸钠缓冲液,7 d后采用尾静脉采血法测血糖。以7%水合氯醛(0.5 mL/100 g)腹腔注射,备皮消毒,在背部制作约3 cm×3 cm的正方形创面,深达筋膜。拍照后医用纱布覆盖创面,胶带包扎固定。
1.4 PRP的制备
采用改良Landesberg法[10]制作。每次取2~3只大鼠,称重麻醉后,用预先装有1 mL柠檬酸葡萄糖溶液(ACD抗凝剂)的5 mL真空离心管及一次性静脉采血针,直视下从每只大鼠腹主动脉取血约10 mL(约5 mL血装一离心管),摇匀后,取1 mL全血进行全血细胞分析,测得血小板计数为646×109。第一次以200×g在4 ℃条件离心15 min,离心后管内全血分为3层,下层为红细胞,上层为上清液,中间交界层即富含血小板。在划分中层与下层两部分的线下方2 mm处标记,移取该点以上的全部内容物[11]至另一不装有抗凝剂的空白离心管,摇匀,再以500×g在4 ℃条件离心10 min,得到2个部分,上层即贫血小板血浆(platelet poor plasma,PPP),下层为含有少量红细胞、血浆和血小板混合物,即PRP。用移液枪吸取上份PPP,即获得PRP,经全血细胞分析测得血小板计数为 4 296×109。
1.5 各组干预方案
A组和B组:生理盐水灌胃,饮用普通水;溃疡局部常规消毒后涂抹生理盐水,然后无菌纱布覆盖。C组:生理盐水灌胃,饮用普通水;溃疡局部常规消毒后涂抹PRP,然后用无菌纱布覆盖。D组:低氘水灌胃,饮用低氘水;溃疡局部常规消毒后涂抹生理盐水,然后无菌纱布覆盖。E组:低氘水灌胃,饮用低氘水;溃疡局部常规消毒后涂抹PRP,然后用无菌纱布覆盖。各组灌胃量均为0.01 mL/ (g·d)[12]。每只大鼠均单笼饲养,于术后第1日开始换药,每日更换垫料1~2次,换药1次,并祛除创面硬痂。PRP每隔1 d使用1次,PRP及生理盐水每次每创面使用量均为100 μL。
1.6 样本获取及指标检测
分别于溃疡造模后的第3日、第7日及第14日,每组各随机选取6只大鼠,测血糖(早晨9时)后麻醉,照相并观察溃疡愈合情况。取创面及周围5 mm内组织,将一半肉芽组织进行苏木精-伊红染色(H-E染色),观察组织病理学改变;另一半立即置于液氮中冷却,随后-80 ℃保存,用于各组大鼠创面组织MMP-9、TIMP-1蛋白含量检测。
1.6.1 溃疡大鼠创面恢复情况 ①大体观察:观察创面的基本情况,拍照后用Image J图像软件进行溃疡面积的测量,以创面愈合率作为评价大鼠溃疡愈合情况的指标。创面愈合率= (创面初始面积-创面当前面积) /初始面积×100%。②组织病理形态学观察:取创面及周围5 mm内组织,进行H-E染色,使用光学显微镜观察创面的组织形态学变化,主要观察创面肉芽组织、新生毛细血管、成纤维细胞及胶原等的变化。
1.6.2 创面组织MMP-9和TIMP-1的检测 取创面及周围5 mm内组织,采用酶联免疫吸附法检测创面组织MMP-9和TIMP-1的含量。所有指标均按照试剂盒说明进行操作。
1.7 统计学方法
采用 SPSS 20. 0 软件进行统计学分析,定量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 大鼠一般情况
正常对照组大鼠皮毛光亮,精神良好,皮脂丰厚。糖尿病组大鼠在STZ注射后精神状态变得稍差,皮毛粗糙、萎黄,且易脱毛,饮水量、饮食量、尿量明显增加;随着时间变化,体质量较正常对照组明显减轻,皮脂变薄。
2.2 正常对照组及糖尿病组大鼠体质量及血糖结果的比较
在适应性喂养1周后,2组大鼠体质量无明显差异;糖尿病组大鼠经高脂高糖饲料喂养4周后,体质量增长略比正常对照组大鼠快;正常对照组大鼠在经柠檬酸-柠檬酸钠缓冲液注射7 d后体质量稍有增长,而糖尿病组大鼠在经STZ注射7 d后体质量反而降低(表1)。
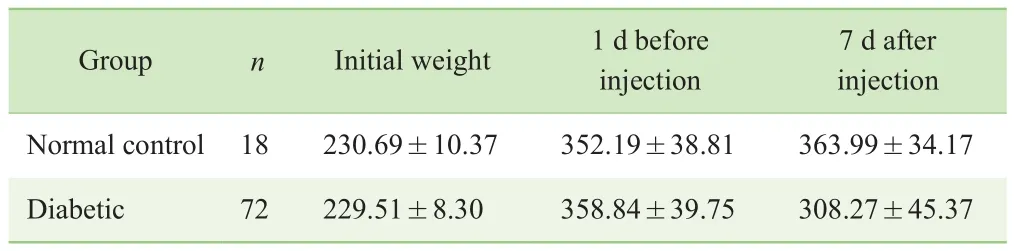
表1 造模前后大鼠体质量变化(x—±s,g)Tab 1 Changes in body weight of rats before and after modeling (x—±s, g)
初始状态下,糖尿病组大鼠的随机血糖与正常对照组比较,差异无统计学意义(P>0.05);糖尿病组大鼠经高脂高糖饲料喂养4周后,其血糖较正常对照组稍高,但差异不具有统计学意义(P>0.05)。在STZ/柠檬酸-柠檬酸钠缓冲液注射7 d后,糖尿病组大鼠血糖较正常对照组明显增高,差异具有统计学意义(P<0.05),说明高脂饲料喂养配合STZ诱导的2型糖尿病大鼠模型建立成功(表 2)。

表2 造模前后大鼠血糖水平变化(x—±s,mmol/L)Tab 2 Changes of blood glucose level in rats before and after modeling (x—±s, mmol/L)
2.3 各糖尿病组大鼠血糖变化
A、B、C组在各干预时间点的随机血糖水平与干预前相比,差异无统计学意义;在D组及E组可观察到,在低氘水干预后大鼠随机血糖开始缓慢下降,在干预第14 日后较干预前明显降低,差异具有统计学意义(P<0.05)(表3)。
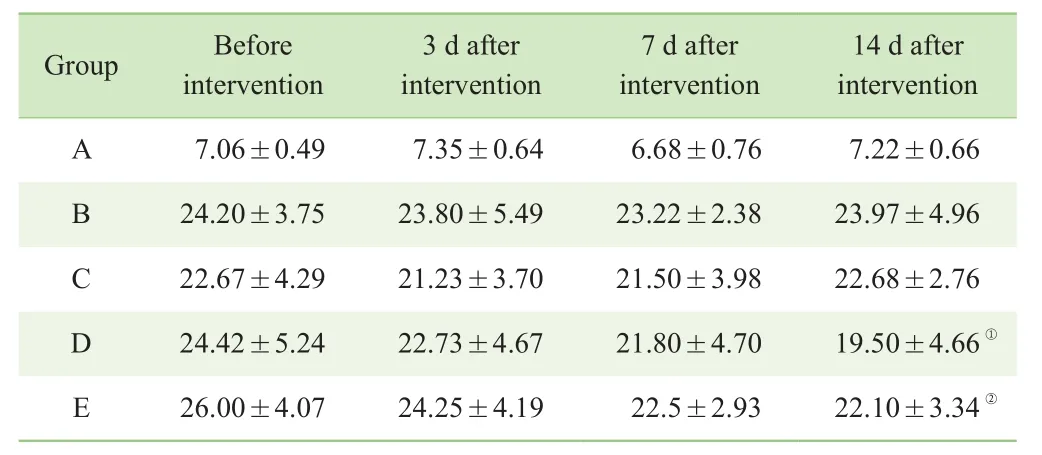
表3 干预后不同时间点各组大鼠随机血糖变化(x—±s,n=6,mmol/L)Tab 3 Random blood glucose changes in rats of different groups at different time points after intervention (x—±s, n=6, mmol/L)
2.4 各组大鼠创面恢复情况及组织病理形态学观察
各组大鼠创面均无明显感染,有不同程度渗出、水肿及少量出血,随着时间推移各创面均在逐步愈合(图1)。在干预第3日,H-E染色结果显示:A组炎症细胞浸润明显,可见少量新生毛细血管及成纤维细胞;B组可见少量炎症细胞、成纤维细胞及新生毛细血管;C组可见炎症细胞浸润,有少量新生毛细血管及成纤维细胞;D组可见炎症细胞浸润,有少量新生毛细血管及成纤维细胞;E组可见炎症细胞浸润,伴少量新生毛细血管及成纤维细胞。在干预第7日,H-E染色结果显示:A组可见大量新生毛细血管及成纤维细胞,有少量胶原纤维,仍可见较多炎症细胞;B组可见炎症细胞浸润,新生毛细血管较其他组少,有少量成纤维细胞;C组见较多的新生毛细血管及成纤维细胞,有少量胶原纤维;D组可见较多的新生毛细血管及成纤维细胞,有少量胶原纤维;E组可见成纤维细胞及新生毛细血管增多,有少量胶原纤维,炎症细胞减少。在干预第14日,H-E染色结果显示:A组可见大量胶原纤维,少量新生毛细血管、成纤维细胞及炎症细胞;B组可见胶原纤维,少量成纤维细胞及新生毛细血管;C组可见较多胶原纤维及新生毛细血管,伴少量炎症细胞浸润;D组可见较多胶原纤维及新生毛细血管,伴少量炎症细胞浸润;E组可见大量胶原纤维及较多的新生小动脉和小静脉。各糖尿病组创面炎症反应均较正常对照组慢;E组肉芽成熟效果较其余3个糖尿病组快,在各干预组中效果最佳,新生血管及成纤维细胞出现时间早且数量多,为创面修复提供了前提条件(图2)。
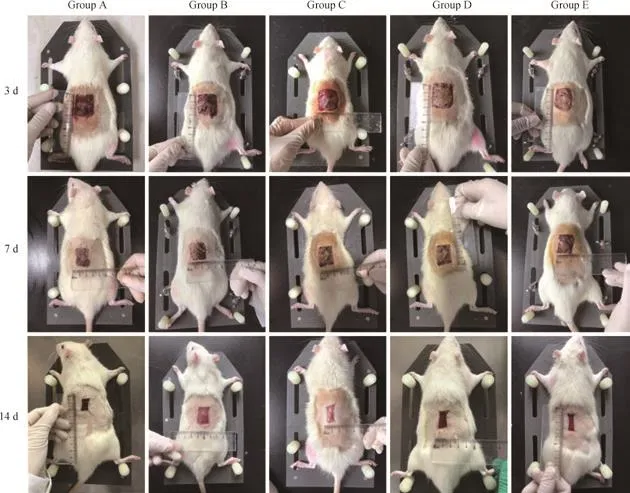
图1 各组大鼠创面愈合情况的比较Fig 1 Comparison of wound healing in each group of rats
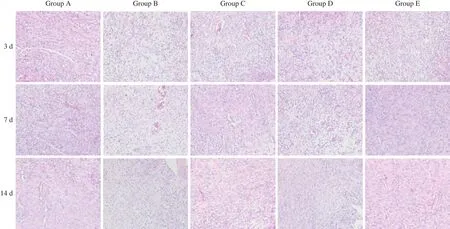
图2 各组大鼠创面组织H-E染色(×200)Fig 2 H-E staining of wound tissue in each group of rats (×200)
2.5 各组大鼠愈合率的比较
干预第3日:各糖尿病组大鼠创面愈合率均明显低于正常对照组(A组)(P<0.05);C组、D组及E组创面愈合率均高于B组(P<0.05),但两两之间的差异均无统计学意义;各组创面愈合率由高到低依次为A组>E组>C组>D组>B组。干预第7日:A组创面愈合率大于B组、C组及D组(P<0.05);E组愈合率虽低于A组,但2组差异无统计学意义;各组创面愈合率由高到低依次为A组>E组>D组>C组>B组。干预第14日:A组创面愈合率大于B组、C组及D组(P<0.05);E组愈合率虽低于A组,但2组差异无统计学意义;各组创面愈合率由高到低依次为A组>E组>C组>D组>B组(表4)。

表4 干预后不同时间点各组大鼠创面愈合率的变化(x—±s,n=6,%)Tab 4 Changes of wound healing rate in rats of different groups at different time points after intervention (x—±s, n=6, %)
2.6 各组大鼠创面组织MMP-9含量的比较
各糖尿病组大鼠创面组织中MMP-9含量在观察的各时间点均明显高于正常对照组(A组)。C组、D组及E组在干预3 d后,MMP-9含量较B组明显降低(P<0.05);干预3 d后E组MMP-9含量较C组及D组明显降低,7 d后差异有统计学意义(P<0.05)(表5)。
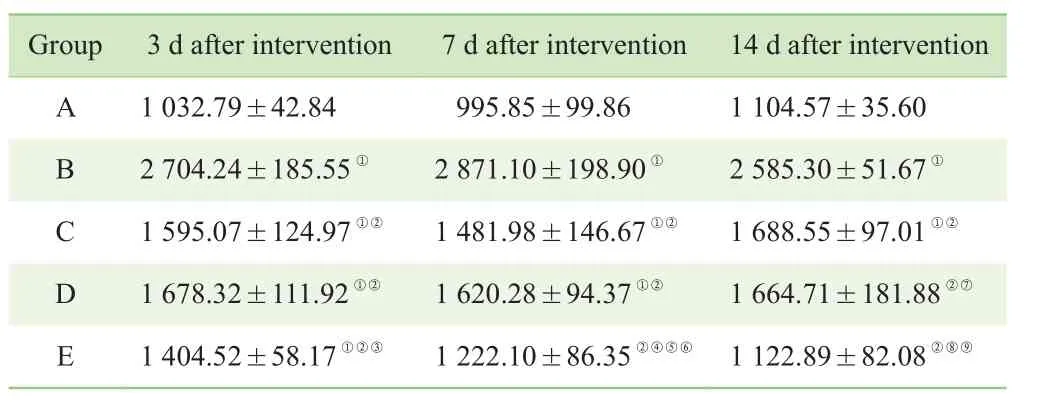
表5 干预后不同时间点各组大鼠创面组织MMP-9含量的变化(x—±s,n=6,ng/g)Tab 5 Changes of MMP-9 content in wound tissues of rats in different groups at different time points after intervention (x—±s, n=6, ng/g)
2.7 各组大鼠创面组织TIMP-1含量的比较
各糖尿病组大鼠创面组织中TIMP-1含量在各时间点均低于正常对照组(A组),而C组、D组及E组干预后TIMP-1含量均较B组升高(均P<0.05)。E组干预3 d后TIMP-1含量升高较C组及D组明显(P<0.05);在干预14 d后,与A组差异无统计学意义(表6)。
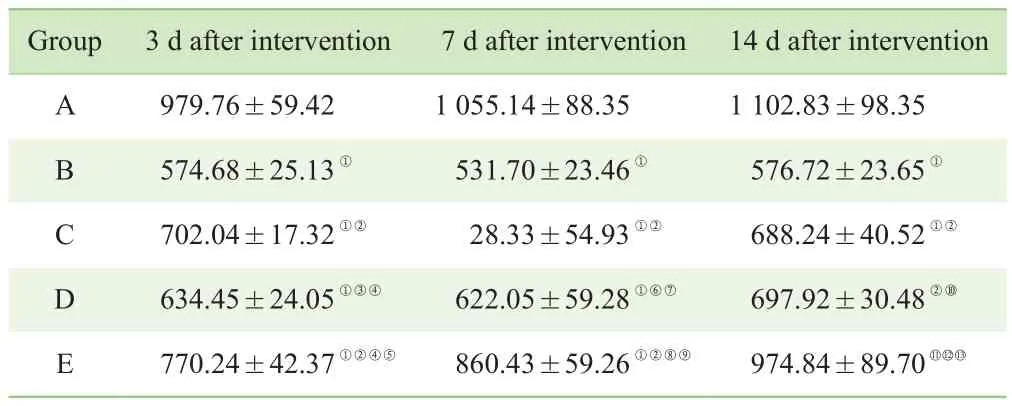
表6 干预后不同时间点各组大鼠创面组织TIMP-1含量的变化(x—±s,n=6,ng/g)Tab 6 Changes of TIMP-1 content in wound tissue of rats in different groups at different time points after intervention (x—±s, n=6, ng/g)
3 讨论
皮肤是人体最大的器官之一,主要有3个关键作用:屏障功能、感觉功能、代谢功能。皮肤受损时,会经历伤口愈合的过程。伤口愈合的4个阶段是炎症、血管生成、再上皮化和重塑。由于各种原因,一些伤口修复减慢或中断,这些伤口被称为慢性伤口[13]。糖尿病慢性足溃疡是糖尿病患者较严重且常见的并发症,是常见的慢性伤口之一,在糖尿病人群中的终身发病率高达15%[14]。尽管发病率很高,但目前的治疗方案仍然有限。常见的外科治疗方法主要是清创,随后换药、控制感染和血糖水平。尽管采用了各种综合方法,但患者并发症发生率和截肢率仍然很高[15]。
2型糖尿病大鼠模型已较成熟。有研究[16-17]表明,STZ对胰岛β细胞具有高度选择性毒性作用,通过自由基损伤胰岛β细胞,使其胰岛素的合成减少,进而引发糖尿病。通过高脂高糖喂养1~2个月诱导大鼠胰岛素抵抗后,再加小剂量一次性腹腔注射STZ来损伤胰岛功能,能引起血糖升高,模拟2型糖尿病发病的过程。张玉领等[18]发现高脂高糖喂养4周后,大鼠出现明显的肥胖及胰岛素抵抗,一次性腹腔注射STZ 30 mg/kg,可成功制备2型糖尿病大鼠模型,其成模率高,模型稳定,无动物死亡,更适用于2型糖尿病的相关研究。
PRP是全血经离心后获得的高浓度血浆,富含多种生长因子,可促进软组织的修复。研究[4,19-20]表明,PRP治疗DFU有较好的疗效。本次实验也发现,经PRP干预后的糖尿病大鼠创面愈合率较模型组高。低氘水能够降低胰岛素抵抗性、降低糖尿病患者血糖含量[12,21-22]。Wang等[23]报道,低氘水可促进醌氧化还原酶1(NADPH: quinone oxidoreductase-1,NQO1)的表达,从而抑制MMP-9的表达。本研究也发现,低氘水干预组大鼠随机血糖在干预14 d后明显下降,在各个时间点的创面愈合率较糖尿病模型组高;说明低氘水可降低糖尿病大鼠随机血糖,对糖尿病大鼠溃疡创面愈合有促进作用。
研究[24]表明,糖尿病患者足部伤口中,MMPs表达增加,其抑制因子TIMPs表达减少,导致伤口难以愈合。MMPs是一组具有共同生物化学性质的可降解细胞外基质(extracellular matrix, ECM) 的锌依赖性肽链内切酶, 是参与 ECM 降解的主要蛋白酶之一;TIMPs 是 MMPs的特异性抑制因子,能调节 MMPs的活性。MMP-9是金属蛋白酶家族中相对分子质量最大的酶,可作用较广泛的底物,包括 Ⅳ、Ⅴ、Ⅶ、Ⅹ 型胶原,明胶,纤连蛋白,玻连蛋白及层粘连蛋白等,对这些底物起着降解作用[25]。MMP-9通过分解ECM成分参与伤口的愈合过程。糖尿病患者动脉中高含量的MMP-9能使中性粒细胞和巨噬细胞表达增强,这2种细胞是主要的炎症反应细胞,因此导致DFU延迟愈合[26]。TIMPs是 MMPs 的内源性抑制剂,可抑制MMPs 活性,刺激细胞分裂,结合ECM,抑制血管形成,诱导细胞凋亡[25]。TIMP-1 对 MMP-9 有直接的抑制作用,是 MMP-9的特异性抑制剂。TIMP-1与活性 MMP-9 形成非共价复合物,通过抑制MMP-9活性来减少ECM的降解。郑洁等[25]的研究表明,MMP-9与糖尿病溃疡的愈合密切相关,且MMP-9/TIMP-1有望成为未来DFU治疗的新靶点。本实验研究发现,糖尿病组大鼠创面MMP-9水平高于空白对照组,而经PRP、低氘水、PRP联合低氘水治疗后MMP-9明显降低,且低氘水联合PRP治疗组干预14 d后效果最明显;糖尿病组大鼠创面TIMP-1水平低于空白对照组,而经PRP、低氘水、PRP联合低氘水治疗后TIMP-1明显升高,且低氘水联合PRP治疗组干预14 d后效果最明显。
综上所述,低氘水联合PRP对大鼠糖尿病溃疡创面愈合有显著的促进作用,其可能与调控MMPs的表达有关,即通过提高溃疡创面TIMP-1表达,从而抑制MMP-9的表达,减少ECM的降解。

