精制保和颗粒调控Bcl-2 和Bax 表达抑制大肠癌细胞移植瘤生长的作用机制研究
吴美珠,陈晓萍,褚剑锋,沈阿灵,刘丽雅,林晓英,陈友琴,3*
(1. 福建中医药大学中西医结合研究院,福建 福州350122;2. 福建省中西医结合老年性疾病重点实验室,福建 福州350122;3. 美国凯斯西储大学医学院,美国 克利夫兰44106)
大肠癌(colorectal cancer,CRC)是一种常见的消化道恶性肿瘤,根据美国癌症协会2019 年最新统计数据表明,CRC 的发病率无论在男性还是女性当中均位列前三,且逐年呈上升的趋势,严重威胁人类健康[1-3]。 目前大肠癌的治疗手段主要包括手术、放疗、化疗和免疫治疗等,但仍存在转移、复发、耐药和毒副作用等问题[4],严重影响患者预后和生活质量,因此寻求更加有效且低毒的抗肿瘤药物尤为重要。 中医学根据大肠癌发病及临床特点认为大肠癌应属“肠积”“积聚”“瘕”“肠风”和“锁肛痔”等范畴[5],其病位在肠、脾、胃,临床多表现为本虚标实之证[6],以腹痛、神疲乏力、纳差、黏液脓血便、腹胀痛、便溏、腰膝酸软、口渴、里急后重等为临床常见症状体征[7],因此,扶正驱邪是中医药治疗大肠癌的主要治法治则。 保和丸是中医经典处方,具有消食化积、养胃和中等功效,临床上常用于治疗食积停滞、嗳腐吞酸、不欲饮食等胃肠道症状[8-9]。 本研究采用的精制保和颗粒(refined baohe formula,RBF)为保和丸精简化裁而来,由红藤、神曲和炒麦芽组成,具有健脾和胃、化瘀解毒等功效。目前RBF对大肠癌生长的影响尚未见相关报道,因此,本研究通过建立皮下接种人结肠癌HCT116 细胞构建皮下移植瘤模型,并观察RBF 对移植瘤生长、细胞增殖和凋亡的影响,以期为RBF 的临床抗大肠癌应用提供实验依据。
1 材料与方法
1.1 细胞株与动物 人结肠癌细胞株HCT116 购自中国科学院细胞库。 无特定病原体(specefic pathogen free,SPF)级雄性BALB/c 裸鼠10 只,4~6 周龄,体质量(20±2)g,购自上海斯莱克实验动物有限公司,许可证号为SCXK(沪)2014-0017,饲养于福建中医药大学SPF 级医学动物房,许可证号为SYXK(闽)2014-0005。
1.2 主要试剂和仪器 RPMI1640 培养液、胰蛋白酶和胎牛血清(美国Thermo Fisher 公司);青链霉素混合液和磷酸缓冲盐(美国Hyclone 公司);基质胶(美国BD 公司);促凋亡基因Bax、抗凋亡基因Bcl-2和增殖细胞核抗体PCNA(美国CST 公司);免疫组化试剂盒和DAB 显色试剂盒(福州迈新生物技术开发公司);TUNEL 检测试剂盒(武汉博士德生物工程有限公司);伊红-苏木素染色液(北京索莱宝科技有限公司);CO2培养箱(美国Thermo Fisher 公司);超净工作台(中国苏净集团安泰公司);DM 4000倒置显微镜和病理切片机(德国Leica 公司);石蜡包埋机和生物组织自动脱水机(湖北孝感亚光医用电子技术有限公司)。
1.3 药物配制 精制保和颗粒由江阴天江药业有限公司生产,批号:1707310,研磨成粉,生理盐水溶解配成3 mg/mL,超声30 min,4 ℃保存备用。
1.4 人结肠癌裸鼠荷瘤模型的建立和药物干预人结肠癌细胞株HCT116 置于含10%胎牛血清的RPMI1640 培养基(含青霉素、链霉素)中培养,取对数生长期细胞用于实验。 细胞经消化、离心、计数后, 用无血清的细胞悬液和基质胶1∶1 混合后重悬,按0.1 mL/只(1×106个/只)接种于裸鼠腋窝处皮下,待瘤体生长至100 mm3左右,根据小鼠瘤体大小采用随机法将小鼠分为对照组和RBF 组,每组5 只,分别给予等体积的生理盐水和RBF 150 mg/(kg·d)溶液连续灌胃12 d。隔天分别采用电子天平测量裸鼠体重和游标卡尺测量瘤体的长径和横径,并计算瘤体的体积(V=1/2 长径×横径×横径)。
1.5 样本采集 动物实验结束后,剥离瘤块,拍照,通过电子天平测量瘤体的重量后,通过4%多聚甲醛固定,用于后续固定、包埋及HE 和免疫组化染色等相关指标检测。
1.6 HE 染色观察移植瘤组织形态变化 对经4%多聚甲醛固定后的移植瘤组织进行包埋、切片等处理,将石蜡切片依次放入二甲苯Ⅰ、二甲苯Ⅱ脱蜡,并通过梯度乙醇水化,双蒸水冲洗,苏木素染色1 min,分色脱水,伊红染色5 s,梯度酒精脱水,二甲苯透明,封片,通过倒置光学显微镜于200×下观察组织形态。
1.7 TUNEL 法检测组织细胞凋亡 按照TUNEL检测试剂盒说明书检测移植瘤组织中细胞凋亡情况。将石蜡切片脱蜡水化,滴加蛋白酶K 工作液,室温孵育15 min,经TBS 缓冲液漂洗后,加入含TdT酶和荧光标记的脱氧尿嘧啶核苷三磷酸(dUTP)反应液,于37 ℃孵育2 h;随后,经TBS 漂洗后用封闭液室温孵育30 min,生物素化地高辛抗体37 ℃孵育30 min;经TBS 漂洗干净后滴加链霉亲和素-生物素复合物(SABC),37 ℃孵育30 min;TBS 漂洗后滴加DAB 显色剂,室温反应5 min;PBS 漂洗后加苏木素复染1 min,冲洗后脱水封片,通过显微镜下观察拍照。 TUNEL 标记阳性细胞判断方法[10]如下:在光镜下细胞核被标记成棕黄色细胞即为凋亡细胞;每片于400×视野下随机选取5 个不同视野进行阳性细胞的计数,以同一视野内阳性细胞占总细胞的百分比表示细胞凋亡指数。
1.8 免疫组化法检测移植瘤组织中增殖细胞核抗原(PCNA)、Bax 和Bcl-2 蛋白的表达 将石蜡切片脱蜡、水化、抗原修复及封闭后,于4 ℃条件下孵育一抗(Bax、Bcl-2、PCNA,稀释比例均为1∶200)过夜;孵育结束后通过PBS 清洗3 次,每次5 min,并进行二抗孵育30 min,PBS 清洗3 次,每次5 min,再与SABC 反应,DAB 染色并苏木素复染,脱水后封片。每组标本随机采集5 个高倍镜视野(×400)拍照,采用Image-pro plus 7.0 分析系统,以细胞核呈棕黄色为阳性表达结果,以免疫组化评分代表蛋白相对表达水平。 按Fromowitz 综合计分法[11]进行判定如下:每张片子于400 倍视野下随机选取5 个视野,计算阳性表达细胞数量和总细胞数并计算阳性细胞百分数和阳性细胞百分数评分,阳性细胞百分数:<5%为0 分,5%~25%为1 分,26%~50%为2 分,50%~75%为3 分,>75%为4 分;细胞染色强度的评分以着色深度判定:基本不着色(阴性)为0 分,染色弱(浅黄色)为1 分,染色强度中等(黄色)为2分,染色强(棕黄色)为3 分。 按阳性细胞百分数评分和染色强度评分的乘积为免疫组化评分。
1.9 统计学方法 采用SPSS 22.0 统计软件进行统计学分析。 计量资料符合正态分布的以(±s)表示,两个独立样本均数比较采用独立样本t 检验。
2 结 果
2.1 RBF 干预对荷瘤裸鼠体质量的影响 以往研究证实裸鼠体质量的变化与药物疗效及毒性反应均有密切联系,荷瘤小鼠体质量测量实验结果如图1显示,实验结束时2 组裸鼠之间的体质量无明显差别,说明RBF 对裸鼠的体质量无明显影响。

图1 2 组裸鼠体质量柱状图
2.2 RBF 干预对裸鼠移植瘤生长的影响 如图2所示:与对照组比较,RBF 干预可以显著延缓裸鼠移植瘤体积的增加,并在第11 天,与对照组比较瘤体体积显著降低(P<0.05);从瘤体大体观(图3A)和瘤重(图3B)的结果所示,与对照组比较,RBF 干预组的移植瘤大小和重量也均显著减轻(P<0.05)。研究结果提示RBF 干预可明显抑制裸鼠移植瘤的生长。

图2 2 组裸瘤体体积比较

图3 2 组裸鼠瘤体大小(A)和瘤体重量(B)的比较
2.3 RBF 干预对移植瘤组织形态学的影响 HE染色结果如图4 所示。对照组瘤体组织生长旺盛,细胞结构完整,生长状态良好;而RBF 组瘤体组织坏死明显,多数细胞核结构被破坏,细胞固缩甚至碎裂:提示RBF 干预对移植瘤组织有一定的影响。
2.4 RBF 干预对移植瘤组织中PCNA 表达的影响采用免疫组化法检测裸鼠肿瘤组织中PCNA 蛋白表达,结果如图5 所示:对照组PCNA 的棕色阳性表达率、表达强度均高于RBF 组;进一步统计结果显示,与对照组比较,RBF 组移植瘤组织中PCNA 的表达明显下降 (P<0.05)。 研究结果提示RBF 干预具有抑制移植瘤细胞增殖的作用。

图4 2 组裸鼠移植瘤组织形态学比较(×200)
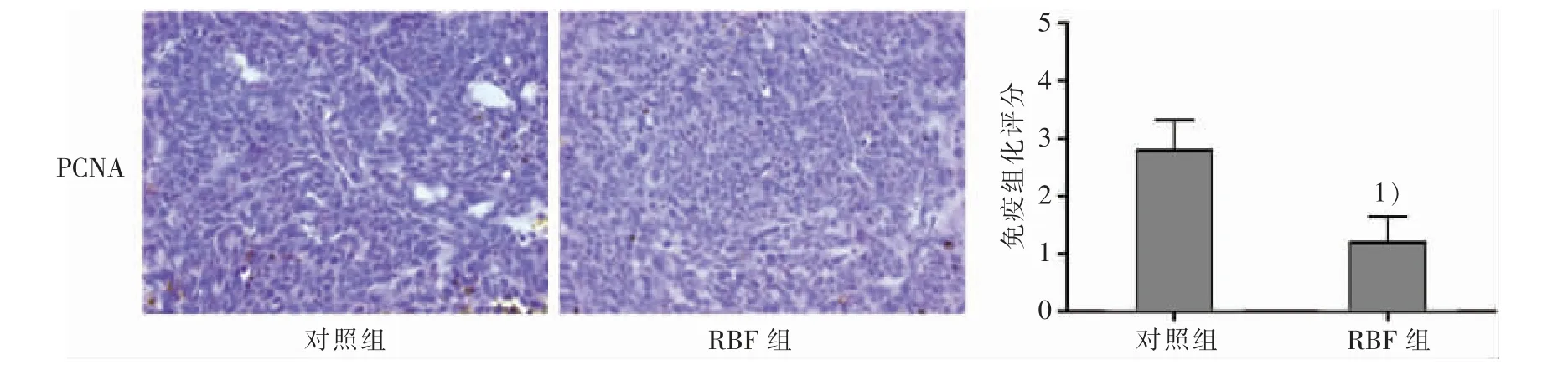
图5 2 组移植瘤组织PCNA 表达的比较(×400)
2.5 RBF 对移植瘤组织中细胞凋亡的影响 TUNEL染色法检测细胞凋亡结果如图6 所示:RBF 组中棕色阳性表达细胞数要明显多于对照组,与对照组比较,RBF 组移植瘤组织凋亡率明显增多(P<0.05):提示RBF 干预具有显著诱导移植瘤组织中细胞凋亡的作用。

图6 2 组裸鼠移植瘤组织凋亡细胞的比较(×400)
2.6 RBF 干预对移植瘤组织中Bax 和Bcl-2 表达的影响 免疫组化法检测移植瘤组织促凋亡蛋白Bax 和抗凋亡蛋白Bcl-2 表达的结果如图7 所示。RBF 组移植瘤组织中Bcl-2 未见明显棕色染色细胞,且数量也明显少于对照组,而Bax 棕色染色细胞数量和强度均较对照组高;与对照组比较,RBF组移植瘤组织中Bcl-2 表达明显降低,而Bax 表达显著升高(P<0.05):提示RBF 干预具有显著下调Bcl-2 和上调Bax 表达的作用,可能是RBF 干预发挥抗大肠癌的机制之一。
3 讨 论
大肠癌是机体在多种致癌因素共同作用下,引起细胞基因异常表达,细胞增殖和凋亡失衡,并最终表现为无限增殖的特征[12-14],因此,抑制肿瘤细胞生长是治疗大肠癌等恶性肿瘤的重要策略。 目前临床常用药物常存在化合物单一、靶点单一、途径单一以及存在不同程度的毒副作用等不足,严重影响了患者的疗效和生活质量。 而中医药治疗具有“多成分、多靶点、多途径作用与注重整体调节”等独特的优势[15-16]。 本研究以清代陈复正《幼幼集成》保和丸为基础,取该方的神曲、炒麦芽以健脾益气、消食和胃,另加红藤以奏健脾和胃、化瘀解毒的功效。近来研究表明红藤具有抗炎、抗肿瘤等作用[17],然而,目前精制保和颗粒对大肠癌的疗效尚未见报道。本研究通过瘤体体积、重量等指标检测证实精制保和颗粒能够一定程度的直接缓解移植瘤的生长。
增殖与凋亡失衡并呈现出无限增殖的特点是大肠癌等恶性肿瘤的重要特征。 PCNA 是一种非组织蛋白性的核蛋白,与细胞增殖和DNA 合成有关,可反映细胞增殖情况,是目前用于评估恶性肿瘤细胞增殖活性的重要指标之一[18]。本研究通过免疫组化检测发现精制保和颗粒干预能够显著降低PCNA表达。 相反,凋亡抵抗是包括大肠癌在内恶性肿瘤异常生长另一重要机制,这也使得促进细胞凋亡已成为防治肿瘤的重要途径。 本研究通过TUNEL 染色发现精制保和颗粒具有显著诱导移植瘤细胞凋亡的作用。 可见,通过抑制大肠癌细胞增殖和诱导细胞凋亡可能是精制保和颗粒发挥抗大肠癌的重要途径,然而,对血管新生、淋巴管新生等方面的影响和调控机制也有待进一步探讨。
Bcl-2 家族是对细胞增殖、凋亡具有重要调控作用的一类基因,同属该家族的抗凋亡蛋白Bcl-2和促凋亡蛋白Bax 可形成一个调节系统,Bcl-2 通过与Bax 竞争结合形成异源二聚体来抑制细胞凋亡,但Bcl-2 表达降低,Bax 表达升高时,细胞凋亡明显增加,可抑制肿瘤细胞的快速增长[19]。 本研究通过免疫组化检测精制保和颗粒干预对Bcl-2、Bax表达的影响,结果证实精制保和颗粒干预具有显著降低Bcl-2 表达和上调Bax 表达的作用。 可见,通过调控Bcl-2 和Bax 的表达可能是精制保和颗粒抑制大肠癌细胞增殖和诱导细胞凋亡并最终发挥抑制大肠癌细胞生长的重要机制之一。 本研究结果为精制保和颗粒的临床抗大肠癌应用提供了进一步的实验依据,然而,与其他复方相似,精制保和颗粒具有多成分、多靶点特点,本研究仅从Bcl-2 和Bax 表达探讨其抑制大肠癌细胞生长的机制仍有一定的局限性,仍有待进一步采用测序等组学技术开展深入的机制研究。

