鉴别MS-H疫苗株和MS野毒株的MAMA-PCR检测方法的建立与初步应用
李玉燕 巩新民 祝永华 张霞 彭晓艳 王海兰 曲秀娟 郭龙宗 崔治中


摘 要:根据Kreizinger Z等[1]已发表的研究,依据obg基因第367位和629位的核苷酸转换,我们建立了依托琼脂糖凝胶电泳(常规PCR)的错配扩增突变分析(MAMA)方法以区分ts+MS-H疫苗株、ts-MS-H再分离株以及MS野毒株。本研究对本实验室保存的客户送检的MS分离株的阳性病料,以及日常场区送检咽喉拭子MS通用引物检测的阳性样品进行MAMA-PCR扩增,用以比对各分离株目的片段的差别,建立MS-H疫苗株与MS野毒株的鉴别方法,这将为临床鸡群MS感染状态的评估提供参考依据,也为MS的净化和防控提供技术指导。
关键词: MS;咽喉拭子;MAMA-PCR
中图分类号:S858.324.4 文献标识码:B 文章编号:1673-1085(2020)2-0022-05
禽滑液囊支原体(MS)感染是鸡群中普遍存在的一种感染[2],在规模化养殖公司的集约化饲养的鸡群,MS感染尤为严重。MS感染可垂直和水平传播[3],其中种鸡的垂直传播会给下游企业带来持续不断的巨大经济损失,是可净化的一种重要的垂直传播性疾病[4]。目前鸡滑液囊支原体疾病的控制,一般会采用活疫苗或活疫苗和灭活疫苗结合免疫,MS支原体应用较为广泛的活疫苗菌株有MS-H株。MS-H株可在鸡的上呼吸道携带,会干扰临床样品MS的PCR的检测结果。另外,疫苗的应用过程中其回复突变导致一定的毒力,因此基于弱毒活疫苗的有效性及安全性考虑,建立鉴别MS疫苗株和野毒株的方法十分重要,可以了解鸡群在MS-H株活苗免疫后鸡群是否还存在野毒感染,为该病的净化控制提供参考。在本研究中,依据obg基因第367位和629位的核苷酸转换,我们建立了依托琼脂糖凝胶电泳(常规PCR)的错配扩增突变分析(MAMA)方法以区分ts+MS-H疫苗株、ts-MS-H再分离株以及MS野毒株。该方法将适用于肉种鸡场禽滑液囊支原体感染状况的监测和MS-H活疫苗免疫鸡群野毒感染风险的连续跟踪评估。
1 材料与方法
1.1 材料与试剂 定制110bp Marker、PCR引物由青岛英赛特生物科技有限公司合成;核酸自动提取试剂盒购自青岛英赛特生物科技有限公司和杭州博日科技有限公司;EasyPure Viral DNA/RNA Kit提取试剂盒、PCR反应试剂盒、2000bp Marker、500bp Marker、琼脂糖、TAE均购自北京全式金生物技术有限公司。MS-H疫苗株(批号为MSH 172452A),购自澳大利亚生物资源。鸡滑液囊支原体参考株WVU1853株购自中国兽医药品监察所。
1.2 采集样品 本实验室保存的客户送检的文登、铁岭、龙口等区域MS分离株的阳性病料,以及日常场区送检咽喉拭子MS通用引物检测的阳性样品(包括A、B、C、D、E五个场区),MS-H疫苗株和鸡滑液囊支原体参考株WVU1853株作为阳性对照,PBS作为阴性对照。
采集疑似支原体感染的鸡只的肺脏、气管、气囊等病料,加入灭菌生理盐水研磨,直至成匀浆液。将悬液移至离心管中充分摇震后,4℃,12000r/min离心5min,取上清液备用,用于提取核酸。
咽喉拭子样品的采集与处理参照郭龙宗等[4]发表的方法进行处理,将棉棒插入喉头口及上颚裂处来回刮3~5次取咽喉分泌液,将样品端插入离心管剪下或折断,放入含有0.8~1.0mL PBS的1.5ml离心管中,备用。
1.3 核酸提取 采集的咽喉拭子样品参照核酸自动提取试剂盒的使用说明,从咽喉棉拭子挤出并离心的上清液提取DNA;肺、气管、气囊等采集样品参照EasyPure Viral DNA/RNA Kit的使用说明提取DNA。
1.4 样品的鉴定
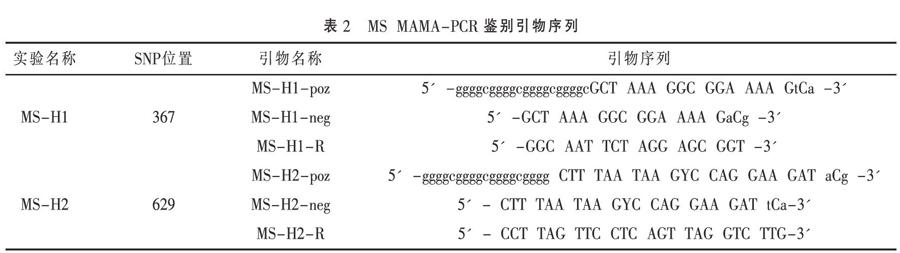
1.4.1 引物 根据张秀美等[5]已发表的针对MS序列的通用PCR检测引物,由青岛英赛特生物科技有限公司合成(见表1)。本研究参照Kreizinger Z等[1]已发表的研究,通过设计MAMA方法进而检测MS的obg基因第367位和629位核苷酸,基因组位置、引物序列见表2。
1.4.2 目的片段的扩增 MS通用引物PCR反应体系见表3;MS MAMA-PCR鉴别引物反应体系见表4。
MS通用引物PCR反應程序为:94℃预变性5min,94℃ 30s,50℃ 30s,72℃ 30s,35个循环,72℃延伸10min,于4℃保存,备用。
MS MAMA-PCR鉴别引物反应程序为:94℃预变性5min,94℃ 30s,58℃ 30s,72℃ 30s,35个循环,72℃延伸10min,于4℃保存,备用。
反应结束,取7μL MS通用引物PCR产物经1%琼脂糖凝胶电泳,取7μL MS MAMA-PCR产物经3%琼脂糖凝胶电泳,于凝胶成像仪中观察并记录结果。
1.4.3 结果判定 若MS-H1引物扩增出71bp的目的条带,MS-H2引物扩增出96bp的目的条带,则判定为MS野毒株,见表5;若MS-H1引物扩增出91bp的目的条带,MS-H2引物扩增出96bp的目的条带,则判定为MS-H疫苗株,见表5;若MS-H1引物扩增出91bp的目的条带,MS-H2引物扩增出77bp的目的条带,则判定为MS-H再分离株,见表5。
2 结果
2.1 MS通用引物PCR检测结果 A、B、C场咽喉拭子,文登、龙口、铁岭客户采集病料,MS-H疫苗株,鸡滑液囊支原体参考株WVU 1853株MS通用PCR检测均为阳性,见图1。
2.2 MS MAMA-PCR检测结果 检测结果见图2、图3。
由图2、图3可知,鸡滑液囊支原体参考株WVU1853株用MS-H1引物可扩增出71bp的目的条带,MS-H2引物扩增出96bp的目的条带。MS-H疫苗株用MS-H1引物可扩增出91bp的目的条带,MS-H2引物扩增出96bp的目的条带。
A、C场咽喉拭子用MS-H1引物可扩增出91bp的目的条带;文登、龙口、铁岭客户采集病料用MS-H1引物可扩增出71bp的目的条带;B场咽喉拭子用MS-H1引物可同时扩增出71bp和91bp的目的条带,见图2。6份采集样品用MS-H2引物均扩增出96bp的目的条带,见图3。结果判定:A、C场咽喉拭子MS分离株均为MS-H疫苗株;文登、龙口、铁岭客户MS分离株均为MS野毒株;B场咽喉拭子MS分离株同时存在MS-H疫苗株和MS野毒株的感染。
采集6份D场咽喉拭子和5份E场咽喉拭子阳性DNA(MS通用引物凝胶成像图省略)进行MS MAMA-PCR扩增,凝胶成像图显示:D场6份样品用MS-H1引物均扩增出91bp的目的条带,其中6号样品用MS-H2引物同时扩增出77bp和96bp的目的条带,其余样品仅扩增出96bp的目的条带,见图4、图5;E场11号样品用MS-H1引物同时扩增出71bp和91bp的目的条带,其余样品仅扩增出91bp的目的条带,MS-H2引物均扩增出96bp的目的条带,见图4、图5。
结果判定:D场咽喉拭子样品同时检测出MS-H疫苗株和MS再分离株;E场咽喉拭子样品同时存在MS-H疫苗株和MS野毒株的感染。
3 讨论
MAMA-PCR原理[1]:MAMA曾用于多种病原的单核苷酸多态性分型。简单的说,MAMA技术是基于3'端单核苷酸特异性的等位基因特异性引物,每个等位基因特异性引物3'端倒数第二个碱基前一个碱基的错配会增强本方法识别单核苷酸多态性的能力。其中一个等位基因特异性引物的5'端具有一个额外的15~20个碱基的GC-钳序列结构(序列为CGGGG),另一个等位基因特异性引物没有该额外序列结构。GC-钳序列结构能够增加PCR产物的熔解温度(Tm)3~5℃,这种变化能够在Real-Time PCR仪(熔解-MAMA方法)上通过荧光染料被检测到;并且它能够增加PCR产物的分子量大小,这一变化能够在3%琼脂糖凝胶电泳(琼脂糖-MAMA方法)中識别。临床禽滑液囊支原体(MS)检测常用的MS-207bp通用引物的PCR检测方法的灵敏性和特异性均较高[5],适合用于场区咽喉拭子样品大批量的筛选检测,但其无法区分MS疫苗毒和野毒感染。在免疫程序和实际应用中,区分MS-H疫苗株和野毒分离株是至关重要的,为了实行防控和净化,必须有可靠的能够区分MS-H疫苗株和MS野毒株的分子分型方法。
本实验将MS-H疫苗株和鸡滑液囊支原体参考株WVU1853株作为阳性对照,PBS作为阴性对照,进行MAMA-PCR扩增。结果显示:MS-H疫苗株和鸡滑液囊支原体参考株WVU1853株均扩增出目的条带大小,阴性对照无任何条带,验证了该引物的有效性,可区分MS-H疫苗株和MS野毒株。
本实验同时对实验室保存的客户送检的文登、铁岭、龙口等区域MS分离株的阳性病料,以及日常场区送检咽喉拭子MS通用引物检测的阳性样品(包括A、B、C、D、E五个场区)进行了检测。结果显示:A、C场咽喉拭子MS分离株均为MS-H疫苗株;文登、龙口、铁岭客户MS分离株均为MS野毒株;B场咽喉拭子MS分离株同时存在MS-H疫苗株和MS野毒株的感染;D场咽喉拭子样品同时检测出MS-H疫苗株和MS再分离株;E场咽喉拭子样品同时存在MS-H疫苗株和MS野毒株的感染。
临床采集样品实验数据证明该检测方法对临床样品中MS的检测具有指导意义,可有效鉴别MS-H疫苗株和MS野毒株的感染,这将为临床鸡群MS感染状态的评估提供参考依据,也为MS的净化和防控提供技术指导。
参考文献:
[1] Kreizinger Z, Sulyok KM, Pásztor A, Erdélyi K, Felde O, Povazsán J,et al.(2015) Rapid, Simple and Cost-Effective Molecular Method to Differentiate the Temperature Sensitive (ts+ ) MS-H Vaccine Strain and Wild-Type Mycoplasma synoviae Isolates[J].PLOS ONE,2005,10(7):e0133554. doi:10.1371.
[2] Y.M.Saif.禽病学[M]. 第十二版. 北京:中国农业出版社,2012,951-952.
[3] 刘金华,甘孟侯. 中国禽病学[M].第2版.北京:中国农业出版社,2015:216-234.
[4] 郭龙宗,李玉燕,崔治中,等.哈伯德曾祖代鸡支原体净化状态的维持和检测[J].中国家禽,2018,40(5):65-69.
[5] 张秀美,M.I.Khan.PCR技术在禽支原体诊断上的发展和应用[C].//中国畜牧兽医学会禽病学分会第十一次学术研讨会论文集.北京:中国畜牧兽医学会禽病学分会,2003:465-466.
Establishment and preliminary application of MAMA-PCR method for identification of MS-H vaccine strain and MS wild strain
LI Yuyan1, GONG Xinmin1, ZHU Yonghua1, ZHANG Xia1, PENG Xiaoyan1, WANG Hailan1,

