磷脂膜的相行为对氧化石墨烯与磷脂膜相互作用的影响
张晓菲,武 烈,李姗姗,朱曼毓,程晓伟,姜秀娥
(1.中国科学院长春应用化学研究所,电分析化学国家重点实验室,长春 130022; 2.中国科学技术大学应用化学与工程学院,安徽 230026)
生物体内的磷脂分子除了存在因极性头部基团差异引起的种类差别外,还存在因烷基链结构差异而引起的种类差别.其中,烷基链上的双键可显著改变磷脂分子的相变温度,并对磷脂膜的相态有显著影响.由于不同磷脂组分的相态不同,磷脂双层膜具有显著的相态异质性[1],而磷脂膜的相态异质性对维持细胞膜的基本功能至关重要.许多生物大分子,如DNA[2]、蛋白质[3]与磷脂膜的相互作用都具有相态选择性.研究还发现,膜的相态对纳米材料与磷脂膜的相互作用也具有显著影响,从而影响细胞反应和细胞毒性.如Holl等[4]报道了聚阳离子聚合物可选择性地破坏磷脂膜的流动相区域,而凝胶相区域则不受影响.Hamda等[1]发现纳米粒子能够以一种尺寸依赖的方式与具有两相分离的囊泡结合: 直径小于200 nm的纳米粒子结合到膜的有序相区域,而大于200 nm的粒子则结合到无序相区域.这些研究都表明纳米材料在磷脂膜上的吸附和作用具有相态选择性.Liu等[5]发现,与流动性较低的脂质体相比,金纳米颗粒与流动性较高的脂质体的相互作用更快,表明磷脂膜与纳米材料间相互作用的强度也受到磷脂分子相态的影响.Wang等[6]发现不同相态磷脂分子结构不同,且其分子定向也存在着差异,这可能是导致作用强度差异的原因.此外,负电性的纳米粒子可以引起流动相的磷脂膜局部凝胶化,而正电性的纳米粒子则引起凝胶相的磷脂膜局部流动化[6].这表明磷脂膜的相态及其与纳米材料的相互作用存在交互影响.然而,磷脂膜的两种相态(凝胶相与流动相)及不同相态间的比例在生命活动过程中不断改变,如肺膜在呼-吸循环的过程中,表面压不同时诱导肺膜中的磷脂分子处于不同的相态中.因此,探究磷脂膜相态的动态变化对纳米材料与磷脂膜相互作用的影响及其诱导的生物学效应具有重要意义,而且对理解生物膜的本质以及纳米生物界面相互作用具有重要价值.
作为代表性的二维纳米材料,氧化石墨烯(GO)由于具有较大的比表面积及易于表面功能化和表面改性的特性,已在生物成像、癌症治疗和抗菌等方面得到广泛应用[7].随着氧化石墨烯在生物领域的发展,揭示氧化石墨烯-生物膜界面相互作用对于阐明氧化石墨烯的生物学效应及保证氧化石墨烯的生物安全性具有重要意义[8].目前,在基于磷脂双层膜或磷脂囊泡的模型生物膜研究中发现,氧化石墨烯可以通过物理或化学机制引起生物膜的损伤[9~15].通过计算机模拟,Gao等[9]发现石墨烯材料可以通过其锋利的边缘插入细胞膜内部而破坏膜的结构; Zhou等[10,11]和Zeng等[12]进一步证实了氧化石墨烯可以抽提磷脂膜中的磷脂进而破坏生物膜的完整性.基于表面增强红外吸收光谱,本课题组[13]发现,氧化石墨烯与磷脂胆碱基团间的静电吸引和疏水作用及与磷酸基团间的氢键作用是其克服与磷酸基团间静电排斥作用而吸附在磷脂膜上的主要驱动力,而且氧化石墨烯对磷脂膜中磷脂分子的抽提作用需要这些弱作用力的协同配合[14].研究还发现,氧化石墨烯的碳自由基引起的磷脂过氧化也可以导致膜损伤,而且膜损伤的程度依赖于材料表面碳自由基的密度[13].由于生物膜相态异质性的存在,氧化石墨烯-生物膜界面相互作用必然会受到磷脂膜物理特性的影响.然而,磷脂膜的相行为对氧化石墨烯与磷脂膜间相互作用及其诱导生物学效应的影响尚未见报道.
本文通过应用不同相变温度的磷脂分子(1,2-二油酰基-甘油-3-磷酸胆碱和1,2-二棕榈酰-sn-甘油基-3-磷酸胆碱)制备了相分离的模拟生物膜,并通过调节二者的比例来模拟生物膜的动态相行为,结合表面增强红外吸收光谱(SEIRAS)和激光扫描共聚焦扫描显微镜(CLSM)研究了磷脂膜的相行为对氧化石墨烯和磷脂膜相互作用的影响.
1 实验部分
1.1 试剂与仪器
石墨粉、氯金酸钠(NaAuCl4),亚硫酸钠(Na2SO3)、硫代硫酸钠(Na2S2O3)、氯化铵(NH4Cl)、氟化铵(NH4F)和氟化氢(HF)购于上海阿拉丁生化科技有限公司; 氯仿(光谱纯)购于天津光复化学试剂公司; 十八烷基硫醇(ODT)、1,2-二油酰基-甘油-3-磷酸胆碱(DOPC)、1,2-二棕榈酰-sn-甘油基-3-磷酸胆碱(DPPC)均购于Sigma-Aldrich试剂公司; 罗丹明B标记的1,2-油酰-sn-甘油-3-磷酸乙醇胺(LR-DOPE)和硝基苯并-2-氧杂-1,3二唑标记的1,2-二棕榈酰-sn-甘油基-3-磷酸胆碱(NBD-DPPE)购于Avanti Polar Lipids试剂公司.实验所用试剂均为分析纯,实验用水为超纯水(电阻率18.25 MΩ·cm).
ESCALAB 250型X射线光电子能谱(XPS)仪,美国赛默飞世尔科技公司; LAMBDA型25紫外-可见光谱仪,美国Perkin Elmer公司; Multimode-V型原子力显微镜(AFM),美国Veeco仪器公司; VERTEX 70型傅里叶变换红外(FTIR)光谱仪,德国布鲁克公司; Autolab PGSTAT302N型电化学工作站,瑞士万通公司; H-600型透射电子显微镜(TEM),日本Hitach公司; 表面增强红外光谱(SEIRAS)电化学测试平台基于IFS 66s/v型傅里叶变换红外光谱仪(德国布鲁克公司)进行改造; TCS SP2型激光扫描共聚焦显微镜(CLSM),德国Leica公司.
1.2 实验过程
1.2.1 氧化石墨烯的制备 以商品化石墨粉为原料,基于Hummer法改良的“水增强的氧化”法[16]制备氧化石墨烯.
1.2.2 金纳米薄膜基底的制备 首先用氧化铝抛光粉(1 μm)对硅晶体表面进行抛光,然后用大量水冲洗以除去表面残留的抛光粉.将处理干净的硅晶体浸没于质量分数为40%的氟化铵溶液中,保持3 min以形成氢化表面,用超纯水冲洗表面并用洗耳球吹干残留水滴.将带有氢化层的硅表面置于60 ℃的热水中加热10 min,将0.03 mol/L的NaAuCl4溶液、0.3 mol/L Na2SO3+0.1 mol/L Na2S2O3+0.1 mol/L NH4Cl混合溶液和体积分数2.5%的HF水溶液等体积混合,并滴加于硅晶体表面,反应90 s 获得金纳米薄膜.最后用超纯水冲洗表面以终止反应.通过电化学方法将金膜表面潜在的污染物除去后,将其安装在自制的玻璃池上,进行温度控制的表面增强红外光谱实验(装置如本文支持信息图S1所示).
1.2.3 囊泡的制备 采用膜挤出法制备了荧光标记和未标记的磷脂囊泡.未标记囊泡的制备: 将DPPC磷脂与DOPC磷脂按照摩尔比分别为0∶,1,1∶,1,1∶,4,1∶,10及1∶,0混合于含有氯仿的玻璃瓶中,以获得具有不同相态的磷脂囊泡.荧光标记囊泡的制备: 使用LR-DOPE和NBD-DPPE荧光磷脂分别标记流动相的DOPC和凝胶相的DPPC磷脂,将荧光标记的磷脂和未标记的磷脂在氯仿中以摩尔比为1∶,100的比例混合.首先,在缓慢的氮气流下旋转玻璃瓶,以除去氯仿并在玻璃瓶壁上形成一层磷脂层薄膜.将玻璃瓶于真空干燥箱中放置10 h后,加入超纯水,水合30 min后超声处理3~5 min,用液氮和温水对溶液进行10次冻融循环.最后将磷脂浑浊液通过聚碳酸脂膜(孔径为100 nm)挤出以收集小的单层磷脂囊泡.
1.2.4 SEIRAS监测氧化石墨烯与不同相态的磷脂膜的相互作用 首先,利用原位SEIRAS实时监测不同相态的磷脂膜通过磷脂囊泡在疏水性自组装单层膜上展开融合的形成过程.将1 mol/L ODT乙醇溶液浸没于新制备的金膜中,以乙醇溶液为背景,采集ODT分子吸附的样品谱,每条谱线由512次扫描叠加.监测10 min后停止采集谱图.保持体系12 h,以获得致密的疏水性单层膜.然后用乙醇去除未吸附的分子并用氮气吹干表面,加入500 μL超纯水并采集背景谱线,再加入500 μL磷脂囊泡溶液(1 mg/mL),采集样品谱线,每条谱线由512次扫描叠加,持续监测3 h.最后用大量超纯水小心仔细洗涤金膜表面,除去未展开融合的磷脂囊泡,此过程必须保证磷脂双层膜浸没在水溶液中而非暴露于空气中.将在金膜上形成的磷脂膜在水中平衡一段时间,以此为背景溶液记录背景谱线.加入最终浓度为50 μg/mL的氧化石墨烯,立即采集样品谱线,每1 min采集一条样品谱线,每条谱线由512次扫描叠加.对于氧化石墨烯与在相变温度以上的DPPC磷脂膜的相互作用,通过外部循环水浴将浸没于水中的ODT自组装单层膜加热至46 ℃,以此为背景记录背景谱线.再加入预先加热至46 ℃的DPPC囊泡溶液,采集样品谱线.3 h后使用46 ℃的超纯水洗去多余的囊泡,并在此背景溶液中平衡一段时间,以此为背景溶液记录背景谱线.加入最终浓度为50 μg/mL的氧化石墨烯,立即采集样品谱线,每1 min采集一条样品谱线,每条谱线由512次扫描叠加.
1.2.5 CLSM实验装置的构筑 CLSM实验采用自制的液体流动池进行.实验装置图如图S2(见本文支持信息)所示.将石英片和载玻片在无水乙醇中超声10 min,然后用大量超纯水冲洗并在高纯氮气下吹干,再放置于含有质量分数为30%的H2O2和70%的H2SO4的100 ℃食人鱼溶液中加热清洗3 h.然后用大量超纯水彻底冲洗并在高纯氮气下吹干.最后将O形圈(直径1.2 cm)放在干净的石英片上,并将载玻片放在其上面并用胶水粘合,形成三明治结构的液体池.溶液通过载玻片上的两个小孔由与注射泵相连的聚乙烯管注入到流动池中.
1.2.6 CLSM监测氧化石墨烯与不同相态的磷脂膜的相互作用 氧化石墨烯与流动相的DOPC磷脂膜的相互作用: 首先,将DOPC囊泡在干净的石英片上融合展开形成磷脂双层膜,再用大量的超纯水除去未展开的囊泡,通过CLSM观察磷脂膜的形貌,然后将50 μg/mL的氧化石墨烯引入流动池,90 min后使用CLSM观察磷脂膜的形貌变化.氧化石墨烯与凝胶相的DPPC磷脂膜以及DPPC/DOPC磷脂膜的相互作用: 首先,在50 ℃下将囊泡在干净的石英片上融合展开形成磷脂双层膜,将体系冷却至室温,用大量的超纯水除去未展开的囊泡,通过CLSM观察磷脂膜的形貌.然后将50 μg/mL的氧化石墨烯引入流动池,90 min后使用CLSM观察磷脂膜的形貌变化.氧化石墨烯与流动相的DPPC磷脂膜的相互作用: 首先通过CLSM观察DPPC磷脂膜的形貌,将此体系升温至46 ℃后,将50 μg/mL的氧化石墨烯引入流动池,90 min后通过CLSM观察DPPC磷脂膜的形貌变化.
1.2.7 荧光光谱测量磷脂膜的相态 Laurdan是一种疏水性荧光染料,其最大发射波长依赖于磷脂膜的相态: 当磷脂膜从凝胶相转变为流动相时,Laurdan的发射波长从440 nm红移到490 nm.对于具有不同相行为的Laurdan标记的磷脂膜,其流动性可通过Laurdan的归一化极化(GP)值表示:
GP340=(I440-I490)/(I440+I490)
式中,I440和I490均为在波长为340 nm激发光下,Laurdan分别在发射波长为440和490 nm处的荧光强度.
将200 μmol/L磷脂囊泡和1 μmol/L探针分子Laurdan混合测定荧光光谱.
2 结果与讨论
2.1 氧化石墨烯的合成与表征

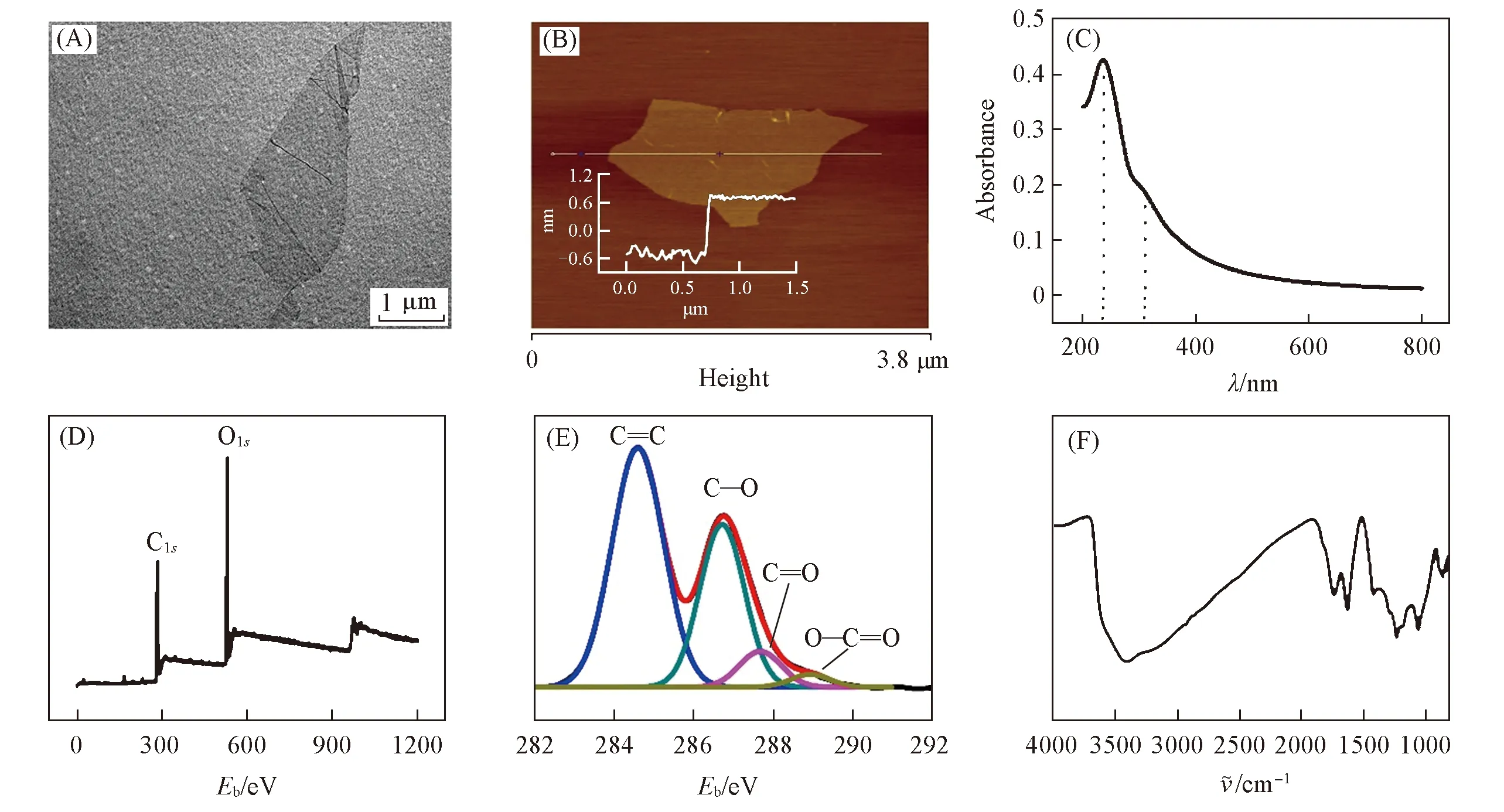
Fig.1 TEM image(A),AFM image(B,inset shows the height profile),UV-Vis spectrum(C),survey(D), C1s(E) XPS spectra and FTIR spectrum(F) of GO sample
2.2 氧化石墨烯与不同相态下的磷脂膜的相互作用


Fig.2 SEIRAS of GO interacting with lipid membrane in single phase state(A) DOPC lipid membrane in fluid state; (B),(C) DPPC lipid membrane in gel state and in fluid state in water,respectively.Sample spectra were obtained with the spectra of lipid membrane in water as reference.Curves a—f were recorded at 1,5,10,30,60 and 90 min,respectively.

Fig.3 Fluorescence images of the morphology change of GO interacting with lipid membrane in single phase state(A),(A′) DOPC lipid membrane in fluid state before(A) and after(A′) interacting with GO.(B),(B′),(C),(C′) DPPC lipid membrane in gel state(B,B′) and in fluid state(C,C′) before(B,C) and after(B′,C′) interacting with GO.

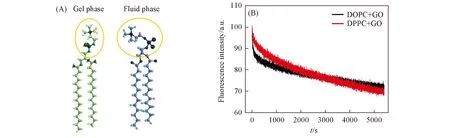
Fig.4 Cartoon schematic diagram of orientation of head group of PC lipids in gel phase and fluid phase(A) and fluorescence intensity change of fluorescence-labeled DOPC and DPPC vesicles after interacting with GO(B)

Fig.5 SEIRA difference spectra of GO interact with DPPC/DOPC(1∶,10)(A), DPPC/DOPC(1∶,4)(B) and DPPC/DOPC(1∶,1)(C) lipid membranes in two phase separation Sample spectra were obtained with the spectra of lipid membrane in water as reference,respectively.Curves a—f were recorded at 1,5,10,30,60 and 90 min,respectively.


Fig.6 Fluorescence images of the morphology change of DPPC/DOPC(1∶,10)(A,D), DPPC/DOPC(1∶,4)(B,E) and DPPC/DOPC(1∶,1)(C,F) lipid membrans interact without(A—C) and with(D—F) GO in two phase separation
凝胶相的DPPC和流动相的DOPC磷脂分子具有完全相同的头部基团,二者的结构差别仅是与烷基链区域是否存在双键.但二者混合的比例却对其与氧化石墨烯间的相互作用具有显著的影响.推测氧化石墨烯无法从DPPC/DOPC摩尔比为1∶,4和1∶,1的磷脂膜中抽提DOPC磷脂可能的原因是混合膜中凝胶相的DPPC磷脂分子对流动相的DOPC分子的相态产生了一定的影响.为了证实该结论,使用疏水性荧光分子Laurdan测试了3种混合磷脂膜的相态[6].如图7(A)所示,对于凝胶相的磷脂膜和流动相的磷脂膜,Laurdan探针的最大吸收值分别位于440和490 nm.对于两相共存的混合磷脂膜,随着膜中流动相DOPC磷脂含量的增加,Laurdan探针的最大吸收值逐渐红移,意味着膜的流动性逐渐增强.膜的相态变化可由GP340值定量表示.由图7(B)可见,随着膜中DPPC磷脂摩尔分数从0增加到100%,GP340值呈非线性增加的趋势.表明DPPC磷脂和DOPC磷脂的混合是一种非理想混合,DPPC磷脂的加入对DOPC磷脂分子的相态产生了影响.而且每种DPPC/DOPC磷脂膜的GP340值均大于理想混合DOPC和DPPC形成磷脂膜的GP340值,表明二元混合磷脂膜中凝胶相磷脂可以引起流动相磷脂一定程度的凝胶化.Pyrkova等[23]通过分子动力学模拟发现DPPC磷脂可以作为一种“有序性”调节剂,影响DOPC磷脂的行为.本文结果与其一致.因此,氧化石墨烯无法从DPPC/DOPC摩尔比为1∶,4和1∶,1的磷脂膜中抽提DOPC磷脂,是由于膜中大量的DPPC磷脂引起DOPC磷脂更大程度的凝胶化,使二元混合膜的相态行为更加接近凝胶相所导致.本研究结果表明,磷脂膜中磷脂分子所处的相态不仅影响其与氧化石墨烯间相互作用的强弱而诱导不同的生物学效应,而且磷脂的相行为对氧化石墨烯与磷脂膜的相互作用及对膜的损伤存在复杂的调控作用.这些发现对纳米生物界面相互作用研究及纳米医药的构建策略具有指导意义.
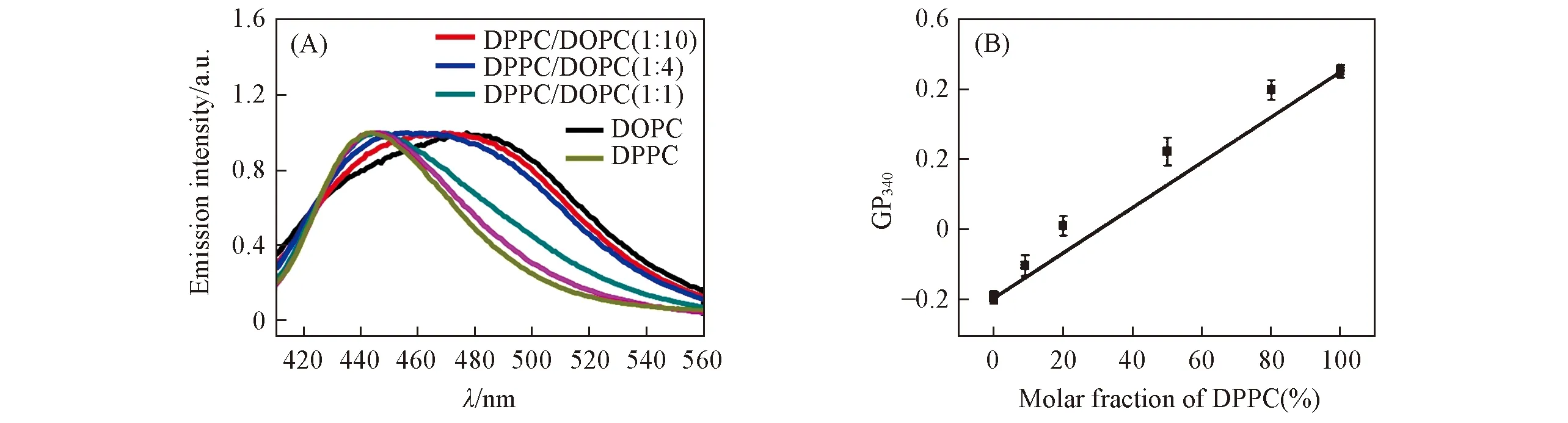
Fig.7 Normalized emission spectra(A) and generalized polarization GP340 value(B) of lipid vesicles mixed with different molar ratios of DOPC and DPPC lipids
3 结 论
通过表面增强红外光谱和激光共聚焦显微镜研究了氧化石墨烯与不同相态磷脂膜的相互作用,发现氧化石墨烯对磷脂的抽提作用受磷脂膜相行为的调控.相比于凝胶相磷脂膜,流动相磷脂膜的头部基团与氧化石墨烯间适度的吸引力以及较疏松的烷基链促使氧化石墨烯容易插入磷脂膜内部,并从膜中抽提磷脂分子.更重要的是,氧化石墨烯抽提流动相磷脂的能力受到膜中凝胶相磷脂对流动相磷脂凝胶化程度的影响.当凝胶/流动相共存的磷脂膜中仅存在一小部分凝胶相磷脂时,流动相磷脂可以被氧化石墨烯抽提; 当进一步增加膜中凝胶相磷脂的量时,由于流动相磷脂凝胶化程度显著增加,导致流动相磷脂无法被抽提.因此,磷脂分子的相态对氧化石墨烯抽提磷脂膜中磷脂的行为具有重要影响,且这种影响属于一种调控行为.该发现有助于理解生物膜的内在性质,并促进氧化石墨烯在生物医药领域的安全应用.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20190645.

