低分子肝素不同给药方式对急性重症胰腺炎并发急性肺损伤/急性呼吸窘迫综合征的疗效
邱艳,唐强
(1.信阳市第五人民医院 呼吸六病区,河南 信阳 464000;2.河南省人民医院 肝胆胰腺外科五病区,河南 郑州 450000)
急性重症胰腺炎是临床上常见的急性重症疾病,死亡率高达20%~30%[1]。急性重症胰腺炎发病急骤,并发症较多,其中最典型的并发症是急性肺损伤(acute lung injury,ALI),ALI是导致急性重症胰腺炎死亡率较高的原因之一。ALI可直接危及患者生命,其病理生理改变主要包括呼吸窘迫和进行性低氧血症,病情十分凶险,必须及时采取有效的治疗方法。研究表明,ALI发生时凝血系统与纤溶系统异常会使机体处于高凝状态[2]。低分子肝素(low molecular weight heparin,LMWH)作为一种临床常用的抗凝剂,在临床治疗中效果明显,但目前国内关于采用何种LMWH给药方式治疗急性重症胰腺炎并发ALI的报道较少。本研究观察LMWH不同给药方式对急性重症胰腺炎并发ALI/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的治疗效果。
1 资料与方法
1.1 一般资料选取2018年1月至2019年4月信阳市第五人民医院收治的45例肺损伤评分≥3分的急性重症胰腺炎并发ALI/ARDS患者,按照给药方式将其分为对照组(n=20)和观察组(n=25)。对照组:男11例,女9例;年龄24~57岁,中位年龄36岁;谷丙转氨酶(alanine aminotransferase,ALT)(73.0±7.4)μ·L-1;谷草转氨酶(aspartate transaminase,AST)(68.1±6.4)μ·L-1。观察组:男14例,女11例;年龄23~55岁;ALT(76.3±6.9)μ·L-1;AST(67.1±8.9)μ·L-1。两组患者性别、年龄、ALT及AST比较,差异无统计学意义(均P>0.05)。患者及家属自愿参与本研究并签署知情同意书。本研究经信阳市第五人民医院医学伦理委员会审批通过。
1.2 选取标准纳入标准:(1)符合急性重症胰腺炎诊断标准[3];(2)有呼吸抑制或呼吸窘迫等临床症状;(3)氧合指数(oxygenation index,OI)<200 mm Hg(1 mm Hg=0.133 kPa),并有低氧血症;(4)有ALI/ARDS影像学表现;(5)符合ARDS柏林诊断标准[4]。排除标准:(1)消化道出血及其他部位出血;(2)出血倾向(血小板<30×109L-1),凝血功能紊乱,1周内使用过抗凝药物;(3)妊娠和哺乳期;(4)既往有脑外伤、脑动脉瘤、动静脉畸形病史。
1.3 治疗方法两组入院后均接受常规治疗,主要包括给予患者抑制胰酶药物,充分扩容,维持水电解质平衡,早期给予足量广谱抗生素治疗等。观察组在常规治疗基础上雾化吸入LMWH(意大利阿尔法韦士曼制药公司,批准文号H20090248)5 000 U,每天1次,连续治疗10 d。
1.4 观察指标(1)OI:取患者清晨动脉血1 mL,用西门子血气分析仪 Rapidlab 1200进行血气分析,计算OI。(2)急性生理与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)评分:由具有正高职称专科医生评估。(3)肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β):取患者清晨静脉血2 mL,4 ℃离心,取上清,置于-80 ℃冰箱保存,采用酶联免疫吸附试剂盒(美国赛默飞公司)检测血清TNF-α、IL-1β水平。(4)C反应蛋白(C-reactive protein,CRP):采用罗氏cobas c501全自动免疫分析仪(美国罗氏公司)检测CRP水平。(5)白细胞(white blood cell,WBC):采用希森美康500i全自动血球仪(日本希森美康公司)检测WBC水平。(6)凝血酶原时间(prothrombin time,PT)、部分凝血活酶时间(partial thromboplastin time,APTT):采用血凝分析仪(法国STAGO公司)检测PT、APTT水平。(7)住院情况:机械通气时间、ICU入住时间、ICU住院花费、牙龈出血、皮下瘀斑及21 d死亡率。

2 结果
2.1 OI和APACHEⅡ评分治疗前,两组OI、APACHEⅡ评分比较,差异无统计学意义(均P>0.05)。治疗后,两组OI均较治疗前升高,APACHEⅡ评分均较治疗前降低,且观察组OI高于对照组,APACHEⅡ评分低于对照组,差异有统计学意义(均P<0.05)。见表1。
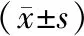
表1 两组患者治疗前后OI和APACHEⅡ评分比较
注:与同组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05;OI—氧合指数;APACHEⅡ—急性生理与慢性健康状况评分系统Ⅱ;1 mm Hg=0.133 kPa。
2.2 炎症反应指标和凝血功能治疗前,两组TNF-α、IL-1β、CRP、WBC、PT、APTT比较,差异无统计学意义(均P>0.05)。治疗后,两组TNF-α、IL-1β、CRP、WBC均较治疗前降低,且观察组TNF-α、IL-1β、CRP、WBC均低于对照组,差异有统计学意义(均P<0.05)。治疗前后两组PT、APTT比较,差异无统计学意义(均P>0.05)。见表2。
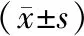
表2 两组患者治疗前后炎症反应指标和凝血功能指标水平比较
注:与同组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05;TNF-α—肿瘤坏死因子-α;IL-1β—白细胞介素-1β;CRP—C反应蛋白;WBC—白细胞;PT—凝血酶原时间;APTT—部分凝血活酶时间。
2.3 住院情况观察组机械通气时间、ICU入住时间均短于对照组,ICU住院花费低于对照组,差异有统计学意义(均P<0.05)。见表3。对照组牙龈出血、皮下瘀斑发生率及21 d死亡率分别为5.0%(1/20)、15.0%(3/20)、20.0%(4/20),观察组牙龈出血、皮下瘀斑发生率及21 d死亡率分别为0、8.0%(2/25)、12.0(3/25),观察组牙龈出血、皮下瘀斑发生率及21 d死亡率均低于对照组,差异有统计学意义(均P<0.05)。
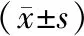
表3 两组患者机械通气时间、ICU入住时间及ICU住院花费比较
注:与对照组比较,aP<0.05。
3 讨论
急性重症胰腺炎是临床上常见的急性重症疾病,死亡率高达20%~30%[5]。ALI是急性重症胰腺炎患者易发生的严重并发症,也是导致急性重症胰腺炎患者死亡的重要原因[6]。其病理生理改变为急性胰腺炎时大量炎症因子和细胞因子释放入血,引起肺微血管内皮细胞损伤,进而导致肺水肿和肺透明膜形成,最终形成ALI[7]。目前临床上治疗方法主要是针对原发疾病进行相应的治疗,同时给予呼吸支持改善血液内低氧状态,并给予补液改善循环血量,维持水电解质平衡[8]。Park等[9]研究发现,对小鼠应用肝素,通过改善胰腺组织的微循环,减轻胰腺缺氧和损伤,从而减轻小鼠急性胰腺炎病理生理改变。另有研究表明,急性重症胰腺炎会导致机体处于高凝状态,机体凝血功能异常会导致炎症反应发生,引起肺部微血栓,进一步加重ALI,因此早期给予抗凝药物治疗至关重要[10]。LMWH是由普通肝素经过酶解或化学方法制得的分子量较小的肝素片段。临床研究发现,LMWH可以抗凝、抗血栓,防止血小板和红细胞黏附,同时对凝血时间不产生影响,且药物起效快、作用时间长,生物利用度高[11]。研究发现,LMWH皮下注射治疗ALI可以抑制炎症反应的发生,改善肺氧合功能,降低死亡率[12]。但由于急性重症胰腺炎引起的ALI同时伴有出血风险,临床关于LMWH的给药方式仍有争议,且相关临床研究较少。
本研究结果显示,两种LMWH给药方式都可以减轻急性胰腺炎引起的ALI,且用药前后PT和APTT水平均无明显差异,观察组机械通气时间、ICU入住时间均短于对照组,ICU住院花费低于对照组,牙龈出血、皮下瘀斑发生率及21 d死亡率均低于对照组。相较于皮下注射,雾化吸入的给药方式优势更明显,不需通过体循环可以直接进入肺组织,迅速到达肺损伤部位,药物作用局限且易维持药物高浓度。因为不是全身给药,安全性相对较高,临床医生可以根据病情调整雾化吸入的次数和剂量,从而达到对ALI更好的疗效。本研究一方面对LMWH治疗急性重症胰腺炎并发ALI提供了支持证据,另一方面发现通过改变LMWH的给药方式,能在住院时间、住院花费等方面获得更多益处。
综上,LMWH治疗急性重症胰腺炎并发ALI/ARDS效果显著,两组给药方式均能提高OI,减轻炎症反应,对凝血功能无明显影响。雾化吸入LMWH患者机械通气时间、ICU入住时间均短于皮下注射LMWH,ICU住院花费少于皮下注射LMWH,牙龈出血、皮下瘀斑发生率及21 d死亡率均低于皮下注射LMWH,值得临床推广应用。

