70株临床分离肠球菌的毒力基因检测与耐药性分析
白耀霞 任建元
重庆市渝东卫生学校,重庆 408300
肠球菌是一种常见的条件致病菌,可引起人类多种传染病。近年来,肠球菌导致的院内感染及死亡率明显增加[1],因此要对其引起的感染给予足够的重视。本研究收集临床感染的肠球菌,检测分离菌株的毒力基因及分离株对常用抗生素的耐药情况,然后分析肠球菌毒力基因与耐药性二者之间的相关性,旨在为肠球菌临床感染抗菌药物治疗提供重要指导,为肠球菌致病机制的进一步研究奠定基础。

表1 本研究所用引物
1 资料与方法
1.1 一般资料
试验菌株(70株非重复肠球菌)由苏州大学第一附属医院惠赠,分离自苏州大学第一附属医院2014年3月~2018年7月的临床标本。菌株均已经法国Bio-Merieux公司vitek 2 Compact 60生化鉴定或法国Bio-Merieux公司vitek MS质谱鉴定。药敏纸片为青霉素G、万古霉素、环丙沙星、利奈唑胺、替考拉宁、氨苄西林、庆大霉素120、四环素,部分菌株采用法国Bio-Merieux公司vitek 2 AST-GP67药敏卡药敏分析。
1.2 方法
1.2.1 药敏试验 采用纸片扩散法(K-B法)、AST-GP67阳性菌药敏卡对分离的70株肠球菌进行药物敏感试验。试验操作过程和结果判断参考CLSI M100 《抗微生物药物敏感性试验的执行标准》2017年版本标准。
1.2.2 制备肠球菌DNA模板 采用水煮法制备肠球菌DNA模板:刮取血平板上新鲜培养物,加入有200μL灭菌蒸馏水的1.5mL EP 管内,混匀,100℃煮沸15min,离心机12000rpm离心5min,取出上清液,即为DNA模板。于-20℃保存。
1.2.3 毒力基因的PCR扩增 反应体系25μL。组成为:T3 Mix 21μL,上、下游引物各1μL,模板2μL;反应条件为:94℃预变性5min,94℃ 30s,退火30s(退火温度见表1),72℃ 10s,30个循环,再72℃延伸1min。引物由重庆擎科生物有限公司合成,引物序列、产物片段大小见表1。PCR产物电泳后,根据片段大小进行判断。
1.3 统计学方法
应用SPSS21.0软件统计处理数据,计数资料以百分数表示,采用χ2检验。利用双变量相关性分析对分离株的多种耐药率和毒力基因数关系进行分析,P <0.05为差异有统计学意义。
2 结果
临床标本分离得到的70株肠球菌,其中粪肠球菌为39株,所占比例为55.71%,屎肠球菌为31株,所占比例为44.29%。
2.1 肠球菌对8种抗菌药物的敏感性结果
对肠球菌药敏试验研究发现,试验所用的8种临床常用抗生素中,均有肠球菌耐药菌株的出现(见表2)。肠球菌对环丙沙星、四环素、青霉素G、氨苄西林、高浓度庆大霉素的表现出较高的耐药 率,分 别 为70.00%、60.00%、48.57%、48.57%、47.14%;检测到万古霉素、利奈唑胺、替考拉宁的耐药菌株;除高浓度庆大霉素、四环素、利奈唑胺外,屎肠球菌对环丙沙星、青霉素G、氨苄西林、万古霉素、替考拉宁的耐药率分别为90.32%、87.10%、87.10%、16.13%、12.90%,明显高于粪肠球菌(P<0.05)。
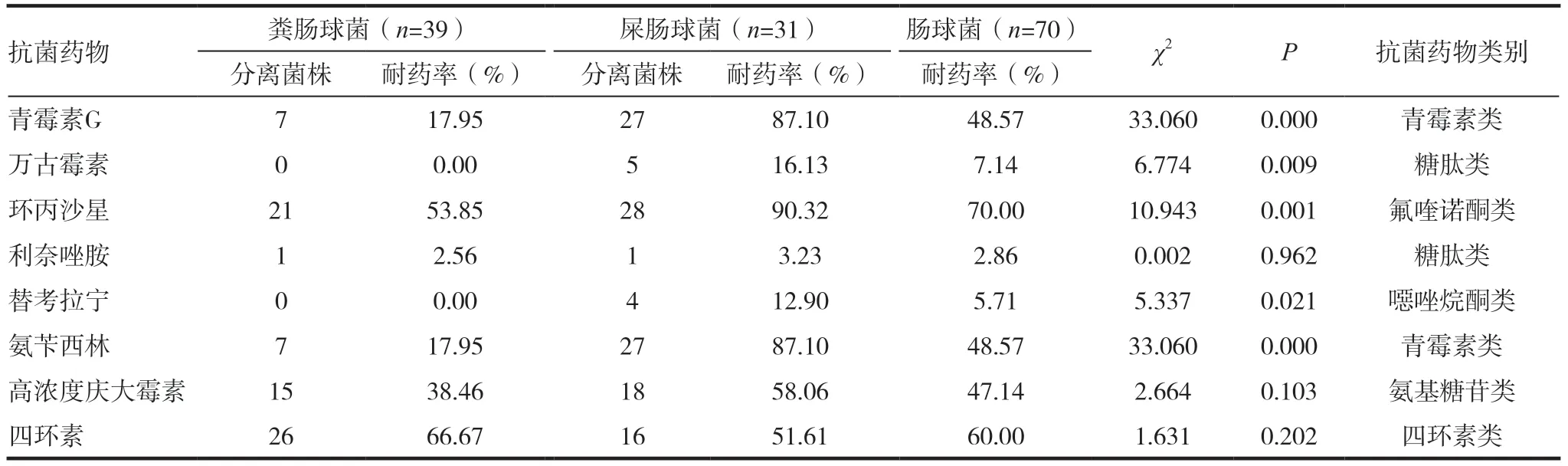
表2 粪肠球菌和屎肠球菌的耐药率
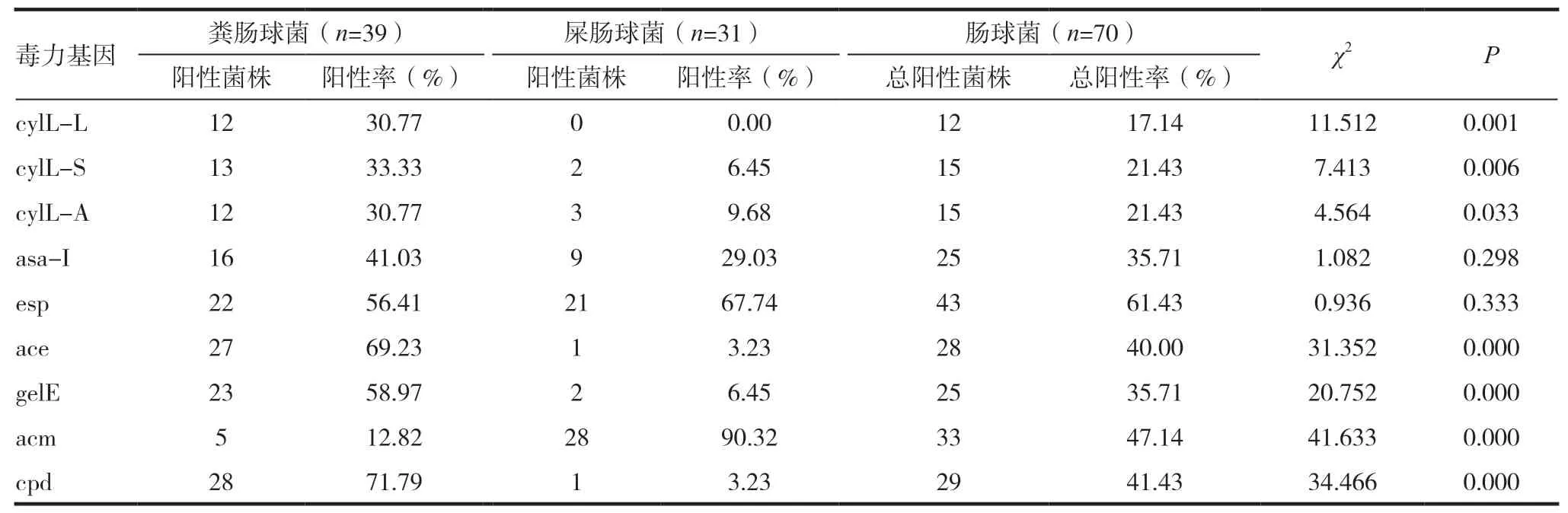
表3 分离菌株的毒力基因分布
2.2 PCR扩增9对毒力基因结果
PCR扩增分别检测每株肠球菌9个毒力基因的携带情况,如图1为1株屎肠球菌(编号为607)携带9个毒力基因的情况。如图1所示:ace、cpd、asa-I、esp、cyIL-A、cyIL-S、cyIL-L检测结果为阳性,gelE、acm检测结果为阴性。统计每个菌株的PCR结果(见表3)。结果显示,70株肠球菌对cylL-L、cylL-S、cylL-A、ace、asa-I、acm、cpd、esp、gelE 9个毒力基因的携带率最高的是esp(61.43%),其次是acm(47.14%);粪肠球菌和屎肠球菌对cylL-L、cylL-S、cylL-A、ace、cpd、gelE的携带率均为粪肠球菌高于屎肠球菌,差异有统计学意义(P<0.05)。
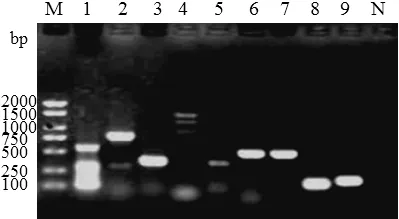
图1 菌株Efa607毒力基因PCR扩增产物电泳图上样顺序:
分别研究粪肠球菌与屎肠球菌的耐药性与所携带毒力基因的相关性,结果显示:粪肠球菌和屎肠球菌的毒力基因与耐药性之间无相关性(P>0.05)。
3 讨论
近年来,肠球菌的多重耐药性为医院感染治疗带来重重困难。世界卫生组织报道,万古霉素耐药肠球菌VRE(Vancomycin Resistant Enterococci)比例在近四年内呈显著升高趋势[2]。肠球菌感染已为全球感染控制带来严峻挑战。
本研究初步探索了苏州大学附属第一医院2014年3月~2018年7月肠球菌的菌株流行、耐药变迁及毒力基因分布情况。所用70株肠球菌来自门诊与住院患者不同感染类型。总体而言,粪肠球菌所占比例较屎肠球菌略高;粪肠球菌携带的毒力基因更多,而屎肠球菌对抗菌药物的耐药性更强,表现出的耐药问题更为突出。这与国内文献报道相似[3-4]。
从药敏试验结果来看,出现了5株对万古霉素耐药的屎肠球菌,这与本区域四年前的报道有所不同[4]。同时,这5株屎肠球菌对青霉素、环丙沙星、氨苄西林及高浓度庆大霉素均表现为耐药,而对利奈唑胺均表现为敏感,为此建议临床严格控制万古霉素的适应证,防止和减慢VRE的产生与传播。此外,分离菌株中粪肠球菌的耐药性与屎肠球菌存在差异,屎肠球菌对环丙沙星、青霉素G、氨苄西林显示出很高的耐药率,分别为90.32%、87.10%、87.10%;除高浓度庆大霉素和四环素外,屎肠球菌对其他7种抗菌药物的耐药率明显高于粪肠球菌,差异有统计学意义(P<0.05),这为临床科学合理选用抗生素提供指导。
由位于致病岛区域的溶血素基因cylL-L、cylL-A及cylL-S等编码的溶细胞素Cyl(cytolysin)是一种细菌外毒素。它通过溶解宿主的巨噬细胞和中性粒细胞而产生免疫逃逸[5]。有研究报道:cyl阳性的粪肠球菌对环丙沙星的耐药率明显高于cyl阴性的粪肠球菌[6]。Miyazakis等发现:cyl阳性的粪肠球菌对万古霉素敏感性明显高于cyl阴性的粪肠球菌[7]。这提示cyl的存在可能与粪肠球菌对万古霉素敏感有关。Miyazakis等及国内报道称:粪肠球菌cyl的阳性率明显高于屎肠球菌。本研究结果与其一致[2,7]。
粪肠球菌信息素诱导的质粒在液体培养基中的高频率转移与聚集物质的形成有关;聚集物质Asa1(Aggregation factor)由质粒编码的聚集体AS和由染色体编码的表面组分BS相互作用产生[6]。asa-I编码聚集体AS参与细胞之间的粘附作用而使致病质粒发生转移或感染[8]。Baylan等研究表明:asa-I和esp为尿路感染携带率最高的基因(阳性率分别为26.7%、25.6%),且发现asa-I阳性的粪肠球菌对环丙沙星、诺氟沙星、左氧氟沙星的耐药率高于asa-I阴性的分离株[9]。本研究结果显示粪肠球菌该基因携带率明显高于屎肠球菌,与国外报道结果一致[10]。
研究表明,表面蛋白Esp(Enterococci surface protein)与肠球菌在宿主细胞内定植及延长肠球菌在膀胱内的停留时间有关[10]。屎肠球菌胶原蛋白黏附素Acm(adhesin of collagen from E.faecium)是由acm基因表达的一种能够黏附在细胞壁上的黏蛋白,其黏附能力的高低被认为与屎肠球菌的临床感染能力密切相关[11]。在本研究中esp的阳性率最高,占61.42%,acm次之,占47.14%。这与国外报道结果一致[6]。Mete等研究发现esp在对万古霉素耐药的屎肠球菌中阳性率为24%,而在对万古霉素耐药的粪肠球菌中未检测到该基因[8]。
胶原蛋白粘附素Ace(Adhesin to collagen from Enterococci faecalis)介导肠球菌的表面黏附。ace位于肠球菌染色体上。本研究中,粪肠球菌ace的阳性率高达69.23%,而在屎肠球菌中该基因的携带率仅为3.23%,差异有统计学意义。这与国外类似报道结果一致[15]。近年ace的研究备受关注,报道显示:ace的表达受双组分系统GrvR(EtaRS)和转录调节因子PrfA的重要调控,利用ace缺失突变体和互补株研究表明ace与粪肠球菌的毒力有密切关系[12-13];Ace单抗在肠球菌感染的大鼠心内膜炎模型中,可降低粪肠球菌主动脉瓣感染[14]。
肠球菌明胶酶gelE(gelatinase)可以降解宿主细胞的胶原蛋白或组织蛋白,其降解机制与肠球菌或其致病因子向周围扩散感染有关[16]。文献报道gelE阳性率在19.6%到80.4%之间[17-19]。在本研究中,gelE基因阳性率为35.71%。国外研究报道粪肠球菌gelE基因阳性者对氨苄西林的抗性明显高于不含这些基因的菌株,与不携带该基因的分离株相比,粪肠球菌gelE阳性菌株对环丙沙星、替考拉宁和万古霉素的敏感性显著增加[6]。毒力基因cpd编码的肠球菌信息素是一种能够与供体菌发生结合而表达聚集物质的脂蛋白[20]。经PCR检测显示cpd携带率粪肠球菌相对屎肠球菌较低,这与国外一些报道结果一致[21-22]。
综上所述,由于肠球菌具有多种毒力因子及其细胞壁比较坚硬等特点,所以在医院感染中比较常见。本研究药敏试验结果显示:粪肠球菌和屎肠球菌对常用抗生素具有不同的耐药率,屎肠球菌对抗菌药物的耐药性更强,为临床合理利用抗菌药物提供了重要指导;分离出的5株耐万古霉素肠球菌均为屎肠球菌,这说明粪肠球菌所含毒力基因对万古霉素更敏感,提示对粪肠球菌毒力基因的研究可能成为治疗耐万古霉素肠球菌感染的关注点。毒力基因检测发现,粪肠球菌携带的毒力基因更多。毒力基因携带与耐药性之间相关性分析得出结论两者无相关性,但由于目前肠球菌的感染机制尚未明确,因此还需要进一步研究。

