血清NSE及aEEG动态变化早期预测窒息新生儿脑损伤的意义
刘小晓, 张晓英
(上海交通大学医学院附属第九人民医院儿科, 上海 200011)
新生儿窒息是引起新生儿死亡、脑性瘫痪及智力发育落后的重要原因之一。近年来,随着医疗抢救治疗措施不断完善,其病死率已不断下降,但重度窒息所致的脑损伤仍可留下不同程度的中枢神经系统后遗症,如脑瘫、癫痫、智力障碍、痉挛及共济失调等,严重影响新生儿的存活率及生活质量。早期诊断窒息所致脑损伤十分困难,尚无敏感性强、特异度高的检测标志物及影像学手段。虽然各种辅助检查方法,包括头颅CT、MRI、B超及脑电图等广泛应用于临床,但是尚缺乏适用于临床、较为确切的早期预测脑损伤的指标,尤其是在生后24 h之内,并且要在无须搬动患儿的情况下检测仪器容易迅速得到。早期治疗和干预最好起始于生后24 h,并且越早越好,最迟不要超过生后48 h,否则脑损伤会进一步发展加重[1]。因此,寻找窒息后脑损伤的早期生化指标及检测方法显得极为重要。如何寻找这个最佳的治疗窗口,一直是临床医师研究的热点。近年来,有研究报道缺氧缺血性脑损伤早期相关生化指标可发生异常变化,如脑红蛋白[2]、血清神经元特异性烯醇化酶(neuronspecific enolase,NSE)等相关指标升高。本研究通过测定窒息新生儿血清NSE水平,同时监测反映脑电活动的振幅整合脑电图(amplitude-integrated electroencephalography,aEEG)动态变化,联合头颅MRI结果,探讨血清NSE联合aEEG对早期预测新生儿窒息所致脑损伤的临床意义。
1 资料与方法
1.1 研究对象
1.2 方法
1.2.1 血清NSE检测 所有研究对象分别于出生后 24 h、 3 d、 7 d 在严格无菌操作下抽取静脉血 2 mL,均置于带促凝胶无菌真空管。采用瑞士罗氏全自动分析仪(电化学发光法)严格依照试剂盒说明立即测定血清NSE含量。正常参考值:血清NSE≤16.3 μg/L。
1.2.2 aEEG监测方法 采用CFM6000脑功能监护仪于患儿生后6 h内、3 d、7 d分别监测脑功能,均监测3 h。电极位置采用国际10~20标准的8导联法[4]。电极头放置时避开颅缝、前囟、血肿,相邻电极头间距>75 mm。要求在监测过程中阻抗不超过20 kΩ。将结果记录为半对数的形式,脑电活动的记录速度为6 cm/h[5],图形显示为振幅形式的波谱带,单位为μV。
1.2.3 aEEG结果判定 aEEG波形判断参照Hellström在2006年重新制定的标准[6],从背景活动、睡眠觉醒周期(SWC)、痫性活动(SA)进行分析。
1.2.3.1 背景活动 ① 连续正常电压:即规则宽带,连续电活动下边界电压7~10 μV,上边界电压10~25 μV;② 不连续电压:背景活动不连续,下边界<5 μV,上边界>10 μV;③ 连续低电压:背景活动连续,电压<5 μV或在5 μV上下波动; ④ 爆发抑制:不连续的背景活动,间歇期电压极低,间有高幅爆发,爆发波>25 μV; ⑤ 电静止:极低电压,可<3~5 μV。根据aEEG背景活动,其结果分为3种,① 正常:连续正常电压; ② 轻度异常:不连续电压; ③ 重度异常:连续低电压、爆发抑制、电静止。
1.2.3.2 SWC 主要是指下边界平滑的周期性变化,成熟的脑电图表现为振幅呈规律的正弦波变化,周期超过20 min,宽带为睡眠期,窄带为清醒期。① 无SWC:aEEG背景活动无正弦样改变; ② 不成熟SWC:下边界有周期样变化但不完全; ③ 成熟SWC:有明显的正弦样改变,且周期持续20 min以上。见图1。
1.2.3.3 SA ① 单次发作:单个发生的痫性放电; ② 反复发作:30 min 内痫性放电发作次数≥2次; ③ 癫痫持续状态: 连续发生的痫性放电,持续30 min以上。见图1。
1.2.4 头颅MRI检查方法及诊断标准 窒息组均在生后第7天行头颅MRI检查,采用Philips Achieva Nova Dual 1.5T超导磁共振成像系统,常规行轴位T1WI、T2WI、弥散加权成像(DWI)以及矢状位T1WI像。检查前20 min内,静推苯巴比妥钠5~10 mg/kg,待完全熟睡后,将患儿置于扫描床上,佩戴防噪声耳麦以减轻扫描过程机器噪音的影响,头部两侧及扫描线圈之间用海绵垫填塞,以固定待检查患儿的头部。
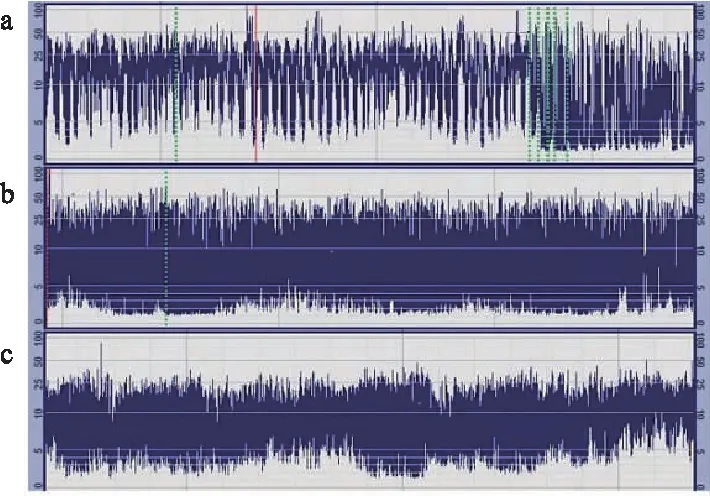
a:癫痫持续状态;b:不成熟SWC;c:成熟SWC
颅脑MRI评判标准参考文献[7],正常MRI: 脑实质未见异常信号灶,灰白质界限清楚,脑沟、脑裂、脑池未见增宽;轻度异常MRI:病灶散在,呈局灶性分布,范围仅限于三角部;重度异常MRI:病灶呈弥漫性分布,基底节及小脑正常,但灰白质界限消失。轻重度异常伴有颅内出血为颅脑MRI 阳性,余为 MRI 阴性。
1.3 统计学方法

2.2不良反应损害系统117例中,累计皮肤73例(占62.39%),消化系统16例(占13.68%),全身性损害11例(占9.40%),神经系统9例(占7.69%),呼吸系统4例(占3.42%),心血管系统2例(占1.71%),泌尿系统2例(占1.71%)。
2 结果
2.1 3组患儿一般资料比较
轻度窒息组、重度窒息组及对照组间分娩方式、性别构成、胎龄及出生体重的差异均无统计学意义(P>0.05)。见表1。
2.2 3组患儿血清NSE水平变化
如表2所示,生后24 h、3 d、7 d,3组患儿血清NSE水平均呈单峰分泌趋势,生后24 h达高峰,之后呈下降趋势。3个不同时间点重度窒息组血清NSE水平均明显高于轻度窒息组和对照组(P均<0.05)。至第7天,轻度窒息组及对照组血清NSE水平基本接近正常参考值上限16.3 μg/L。
2.3 不同时间点aEEG背景活动、SWC、SA与窒息程度相关性分析
2.3.1 背景活动与窒息程度的相关性 生后6 h、3 d、7 d 时aEEG背景活动异常程度与窒息程度存在相关性(r值分别为0.678、0.739和0.824,P均<0.05),背景活动异常程度随窒息程度的增加而加重。生后7 d 重度窒息组、轻度窒息组aEEG背景活动分别仍有11例及12例存在异常。见表3。

表1 3组患儿一般资料比较
表2 窒息组和对照组3个时间点血清NSE水平比较


组别例数24 h3 d7 dF值P值对照组 3019.40±5.79*19.38±5.18*16.55±5.15*49.370.087轻度窒息组4639.09±10.61*27.49±7.03*18.95±6.07*2.7790.068重度窒息组2060.40±12.3241.48±12.4823.00±7.4998.11<0.001F值132.0650.338.465P值<0.05<0.05<0.05
*:P<0.05,与重度窒息组比较

表3 背景活动监测结果 例(%)
2.3.2 SWC与窒息程度的相关性 生后6 h、3 d、7 d时 SWC成熟程度与窒息程度存在相关性(r值分别为0.621、0.863和0.869,P均<0.05),窒息程度越重,SWC越不成熟。生后7 d重度窒息组、轻度窒息组分别仍有5例无SWC。见表4。

表4 SWC监测结果 例(%)
2.3.3 SA与窒息程度的相关性 生后6 h、3 d、7 d时 SA发生率与窒息程度存在相关性(r值分别为0.437、0.746和0.847,P均<0.05),窒息程度越重,SA发生率越高。生后7 d重度窒息组SA的发生率仍高于轻度窒息组及对照组。见表5。

表5 SA监测结果 例(%)
2.4 窒息组患儿窒息程度与颅脑MRI的关系
重度窒息组20例中头颅MRI阳性16例,轻度窒息组46例中头颅MRI阳性24例,重度窒息组颅脑MRI阳性率明显高于轻度窒息组(χ2=4.521,P<0.05)。见表6。

表6 窒息组颅脑MRI阳性率比较 例(%)
2.5 血清NSE水平预测窒息患儿颅脑MRI阳性的价值
将所有窒息组患儿分为MRI阳性组和MRI阴性组,ROC曲线分析显示,生后24 h、3 d、7 d的曲线下面积(AUC)分别为0.896,0.882,0.735,即生后24 h血清NSE浓度早期预测窒息所致脑损伤的诊断价值明显高于3 d和7 d,且差异有统计学意义(P<0.05),当生后24 h血清NSE水平达48.7 μg/L,其诊断价值最大,对应的敏感度为0.875,特异度为0.885(图2)。
2.6 aEEG变化预测窒息患儿颅脑MRI阳性的价值
生后6 h依据aEEG的异常背景活动、成熟SW及SA预测MRI阳性所对应的AUC分别为0.643、0.550、0.521;生后3 d所对应的AUC分别为0.703、0.660、0.546;生后7 d所对应的AUC分别为0.536、0.522、0.495。可见生后6 h、3 d这两个时间点aEEG的变化所对应的AUC虽然都>0.5,但是只有生后3 d aEEG的异常背景活动对应的AUC>0.7,其余各项均<0.7,所以,6 h、3 d这两个时间点对应的aEEG的变化对早期窒息脑损伤的诊断价值较低,差异无统计学意义(P>0.05),而生后第7天监测aEEG对诊断窒息脑损伤几乎无诊断价值,差异无统计学意义(P>0.05)。见图3。

图2 血清NSE预测窒息患儿颅脑MRI阳性的价值
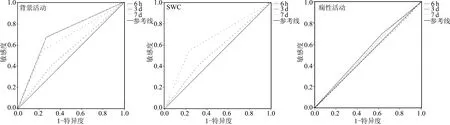
图3 aEEG变化预测窒息患儿颅脑MRI阳性的价值
3 讨论
窒息引起脑损伤的严重程度取决于大脑缺氧的程度,而缺氧最严重的后果就是导致窒息后脑损伤,可影响新生儿各个器官、系统的发育,尤其干扰神经系统的发育,可引起后期智力发育迟缓、甚至出现脑瘫、癫痫等神经系统后遗症,严重影响儿童生存质量[8]。有研究表明[9],窒息导致的脑损伤会随着日龄而增加,神经细胞会出现选择性坏死,第1个脑损伤高峰于窒息后6 h出现,随后第2个损伤高峰将于12~24 h到达;随着缺血缺氧时间的延长,可导致一系列生化反应“瀑布”式发生,最终导致神经细胞的坏死、凋亡,因此第2个脑损伤高峰所带来的神经系统损伤明显高于前一个高峰,若未能在此高峰到来之前对脑损伤做出诊断,早期干预,便会遗留不可恢复的神经病变。本研究中选取监测NSE及aEEG的首次时间点,恰好在大脑受损的两个最高峰。
血清NSE具有糖酵解同工酶的功能,是神经元及神经内分泌细胞区别于其他组织细胞的特异性物质。NSE可作为神经细胞的保护伞[10],当大脑出现缺氧缺血时,血清NSE浓度随即上升,这说明血清NSE是反映受损脑神经元的敏感指标[11]。本研究显示血清NSE判定大脑受损的最准确时间点为24 h,预测值为48.7 μg /L时,诊断价值最大,对应的敏感度为0.875,特异度为0.885。随着日龄的增加,NSE判断脑损伤的特异性逐渐降低,本研究中窒息脑损伤患儿在生后7天复查NSE,其浓度虽处于高值,但较24 h明显下降,故血清NSE判断窒息脑损伤的灵敏度高,特异性较低。这主要因为刚出生的婴儿血清NSE升高除了由窒息脑损伤引起外,还可见于以下疾病引起的脑损伤,如高浓度的胆红素血症、电解质紊乱、感染性疾病、遗传代谢病等。由此可见,单独采用NSE判断窒息所致脑损伤有可能导致过度诊断。
近年来aEEG与脑损伤的相关研究已成为新生儿领域热点,多项研究表明aEEG可用于评估新生儿脑功能状态、判断新生儿脑发育成熟度,可早期诊断脑损伤。许多研究表明,生后第7天aEEG严重异常,提示患儿神经系统近期恢复不好;而生后7~19天aEEG异常可预测脑瘫的发生及神经系统的发育迟缓等[12-13]。
本研究首次监测aEEG选择的时刻是窒息患儿生后6 h。在窒息后6 h,甚至可提早至生后3 h,aEEG图形便会有异常改变,而只有在生后早期确诊,并进行相应干预,才可能最大限度地降低远期神经系统后遗症。在患儿娩出1周内,MRI可准确定位新生儿脑白质、出血性脑损伤以及多发或普遍的囊性等受损处,与头颅CT、B超相比,可提供更多信息,故于生后第7天,对所有窒息患儿进行头颅MRI检查,可以获取更为真实的信息。本研究将头颅MRI结果作为脑损伤诊断的分组标准,对比了MRI阳性组与MRI阴性组3个不同时间点aEEG动态变化发现,虽生后6 h监测aEEG对应的AUC大于3 d和7 d,但诊断价值较低,且无统计学差异,这与既往研究不一致。而且aEEG存在范围较小的记录部位、较低的时间分辨率、简易的振幅等局限性,其用于判定新生儿惊厥发作或放电发作,易于漏诊,主要是因为容易忽略振幅降低、部位局限或发作时间较短的抽搐,同时也可能因为一些伪差误判为发作。因此,aEEG独自判定窒息脑损伤易增加误判率。生后第7天所有窒息患儿中有8例aEEG仍有癫痫样放电,但只有5例颅脑MRI提示有异常,3例颅脑MRI未见明显异常,但这8例患儿在生后2周做新生儿NBNA评分未见明显异常,而后期是否出现神经系统发育迟缓,需进一步随访。本研究以背景活动是否异常、SWC成熟度及SA来判定aEEG是否异常,发现生后6 h、3 d时aEEG的变化对早期窒息脑损伤的诊断价值较低,生后第7天aEEG的变化对窒息脑损伤无诊断价值,说明aEEG变化对于预测窒息早期脑损伤有一定的参考价值,但意义不显著。
综上所述,当生后24 h血清NSE>48.7 μg /L时,新生儿发生窒息后脑损伤的概率明显增高。但本实验中aEEG对诊断窒息脑损伤结果与头颅MRI阳性结果不一致,表明窒息所致脑损伤不能单凭aEEG的改变来判定,需后期随访神经系统发育情况,综合判定是否存在脑损伤。

