FeCl3和十六烷基三甲基溴化铵改性赤泥对水中铜离子的吸附性能和机理
刘江龙,郭焱,席艺慧
(西安交通大学环境科学与工程系,陕西西安710049)
全球环境污染日益严重,特别是由重金属引起的水污染问题已成为一个亟待解决的环境问题[1]。其中铜作为一种常见的重金属,主要通过工业废水排放污染地表水和地下水,被美国环境保护局分类为优先控制的环境污染物之一[2]。到目前为止,已经使用了化学沉淀、溶液萃取、离子交换、吸附等方法来处理含铜废水[3-6]。其中吸附法操作简单,且对重金属有较好的去除效果,因此在重金属废水处理中得到了广泛应用。
赤泥是氧化铝工业中铝土矿经强碱浸出时产生的固体矿渣,因含有大量氧化铁呈红色而得名[7-8]。生产1t 氧化铝,会产生1~2t(干重)的赤泥,全球每年约会产生7000 万吨赤泥。由于赤泥产量巨大,处理不仅会占用大量的土地、耗费维护费用,也会造成土壤污染、地下水污染以及形成粉尘污染空气,破坏周围环境,威胁人类健康[9]。因此,找到一种赤泥的无害化、资源化利用途径是解决赤泥难题最为有效的方法之一。因赤泥具有较好的化学稳定性、机械稳定性和结构属性,所以可经特定的物理、化学方法处理后成为非常具有潜力的水处理材料,如吴建锋等[10]采用溶胶-凝胶法,在赤泥基多孔陶瓷滤球上涂覆Eu-Ce共掺杂纳米TiO2膜,利用多孔陶瓷的吸附作用及稀土共掺杂TiO2膜的光催化剂强还原作用对电镀废水中的As(Ⅴ)离子去除率可达95.96%。Venkatesan 等[11]制备出一种利用Fe2O3涂覆的赤泥吸附剂,实验结果表明,改性可以提高赤泥的吸附能力,在初始浓度为50mg/L、pH 为7、反应时间为90min 的条件下,Fe2O3-CRM对As(Ⅲ)的去除率达到91.74%。Cui 等[12]利用稀土元素镧(La)使其负载在赤泥表面,复合吸附剂La-RM 对Cr(Ⅵ)最大吸附量为17.35mg/g。但是将赤泥不经处理直接改性,其比表面积小、组成成分复杂,对于处理高浓度的重金属废水有一定的局限性。
基于上述在改性赤泥中存在的问题,本研究采用十六烷基三甲基溴化铵(CTAB)和FeCl3对赤泥进行改性。首先,CTAB 是一种阳离子表面活性剂,由于它毒性低、易于生物降解且能与金属离子产生很强的亲和力,所以利用表面活性剂使吸附剂功能化,可以提高材料对水溶液中重金属离子的去除效率[13]。其次,羟基氧化铁(FeOOH)具有稳定的理化性质和较高的比表面积,可与环境中金属离子、有机质和微生物发生交互作用,从而净化环境介质中的污染物[14]。已有不少报道表明,利用化学合成的FeOOH 可作为吸附剂处理废水中的Fe(Ⅲ)、Cd、Pb(Ⅱ)[15-16]。但FeOOH 不具备良好的孔结构,机械强度低,需要将其浸渍附着在多孔载体,这些因素都限制了羟基氧化铁的广泛应用,并且利用表面活性剂和羟基氧化铁改性赤泥却少有报道。因此,利用二者使吸附剂表面官能化以提高材料在水溶液中对重金属离子去除效率是一种新颖的方法。
本文首先采用盐酸酸浸法制备大比表面积的多孔载体材料酸浸赤泥(RM-HCl),然后通过FeCl3的水解作用,使FeOOH 负载在RM-HCl 上,最后利用CTAB对盐活化赤泥进行改性以提高材料在水溶液中的分散性[17],并且经酸处理后赤泥的主要成分二氧化硅具有大量的化学活性羟基(Si OH)。因此负载了羟基氧化铁以及经CTAB改性后的赤泥可成为一种对高浓度Cu(Ⅱ)离子废水具有较强去除能力的吸附剂材料。本研究同时考察了溶液pH、反应时间、初始浓度、投加量等因素对去除Cu(Ⅱ)效果的影响,最终达到“以废治废”的目的。
1 实验部分
1.1 主要试剂与仪器
主要试剂:拜耳法赤泥,河南长兴实业有限公司;十六烷基三甲基溴化铵(CTAB),分析纯,国药集团化学试剂有限公司;硫酸铜,分析纯,天津市大茂化学仪器供应站;三氯化铁(FeCl3),分析纯,天津市北联精细化学品开发有限公司;浓盐酸,分析纯,成都市科隆化学品有限公司。
主要仪器:场发射透射电子显微镜(TEM),JEOL JEM-F200(HR)型,日本;CHNOS 全能元素分析仪,inductar EL cube 型,德国;ICPE-9000,日本岛津制作所;傅里叶变换红外光谱仪(FTIR),Spectrum one 型,美国P-E Com.;扫描电镜(SEM),EVO 18型,德国蔡司(ZEISS)公司;比表面积及微孔孔径分析仪(BET),BET-201A型,美国PMI 公司(中国);X 射线衍射仪(XRD),D8 Advance型,德国;纳米粒度与zeta电位分析仪,Zetasizer Nano ZSE型,英国;真空干燥箱,DZF-6090 型,上海景迈仪器设备有限公司;恒温摇床,ZWY-240型,上海智诚有限公司。
1.2 酸浸赤泥(RM-HCl)的制备
为了探究液固比(盐酸∶拜耳法赤泥)、盐酸浓度和反应时间对制得RM-HCl 的影响,从表1中筛选出一种反应条件最佳、合成比表面积最大、原料损耗最少的合成路线来参与后续的吸附剂改性实验。

表1 拜耳法赤泥与盐酸反应实验
从表1可以看出,液固比在5∶1、盐酸浓度为12mol/L 和反应时间在1h 所制得的RM-HCl 粒径最小,因此选择此反应条件制得的赤泥进行后续改性实验。并且根据图1可知,在最优反应条件下制得的RM-HCl 对比RM,粒径经酸处理后减少了1倍。
1.3 综合改性(FeCl3/CTAB/RM)的制备
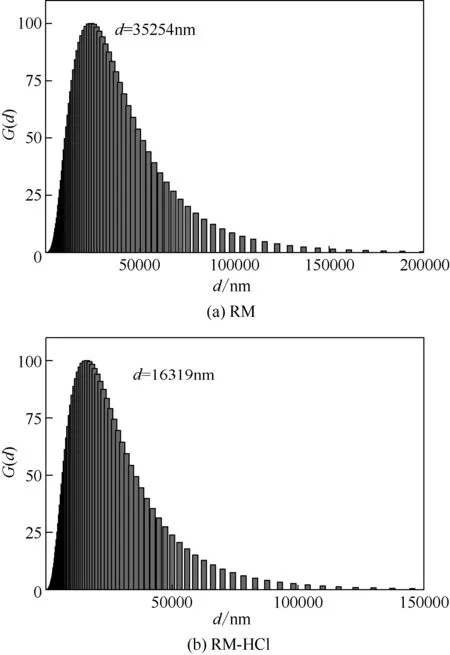
图1 RM和RM-HCl的粒径分布
取10g RM-HCl 在105℃烘箱中干燥2h 以除去赤泥中的少量水分,然后取出将材料研磨到粒度为0.18mm 过筛,再将赤泥加入到配置好的0.5mol/L的FeCl3溶液中,在液固比为10∶1、温度为25℃的条件下连续搅拌反应36h,经洗涤、烘干后得到盐活化赤泥。
取上一步骤盐活化赤泥加入到配置好的200mL质量分数为0.5%的CTAB 溶液中,在温度为120℃的高压反应釜中反应2h。反应完成后,使用少量无水乙醇、蒸馏水各洗涤2 次,然后抽滤。最后,将改性好的赤泥于105℃真空箱中干燥12h,制得FeCl3/CTAB/RM。流程如图2所示。
通过SEM、TEM、BET、FTIR、XRD、元素分析和热重分析等手段分析改性前后的材料。
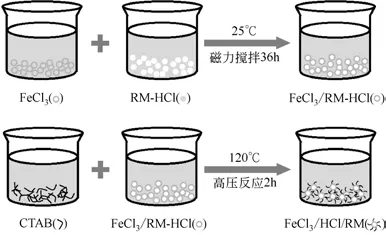
图2 FeCl3/CTAB/RM颗粒改性合成流程
1.4 改性赤泥吸附剂吸附Cu(Ⅱ)的实验
采用CuSO4和纯水配制含铜废水,分别用0.1mol/L HCl和NaOH溶液调节其初始pH。
取50mL 配制的一定浓度的含铜废水,加入0.1g FeCl3/CTAB/RM 吸附剂,放入恒温摇床中25℃振荡3h,经离心后取上清液进行膜滤,并采用电感耦合等离子发射光谱仪测定滤液中Cu(Ⅱ)的浓度。用式(1)和式(2)分别计算对Cu(Ⅱ)的吸附量和去除率。

式中,qe为平衡吸附容量,mg/g;C0为Cu(Ⅱ)的初始浓度,mg/L;Ce为Cu(Ⅱ)的平衡浓度,mg/L;η为吸附去除率,%;V为溶液体积,mL;m为吸附剂用量,g。
2 结果与讨论
2.1 材料表征结果
2.1.1 材料的SEM分析
(1)酸浸前后样品SEM 对比图 浓盐酸酸浸前通过扫描电镜观察到RM[见图3(a),放大5000倍]表面颗粒形态不规则,表面粗糙多孔且大小不同、形状多样,有很多晶状结构。由于一些矿物相(主要是方解石和方钠石)的存在[18],颗粒之间相互作用使其表面形成一些凝结体、集粒体和团聚体颗粒[19],三者之间又形成具有胶结的孔状结构,使赤泥表面拥有较大的孔隙。经过浓盐酸酸浸后的RM-HCl[见图3(b),放大5000 倍],从扫描电镜图中可以看出赤泥的表面结构紧密,胶结连接消失,出现较多致密的小孔,颗粒表面形成晶体结构。
(2)综合改性前后样品SEM对比图 对FeCl3和CTAB 改性前后赤泥进行电镜扫描,RM-HCl[见图4(a),放大12000 倍]表面出现许多致密的小孔,孔径变小,孔道变大;经综合改性后[见图4(b),放大12000倍],FeCl3/CTAB/RM 的表面结构疏松,出现较多的褶皱和分散均匀的片状层叠,此形态有利于改性材料与Cu(Ⅱ)之间的相互作用。
2.1.2 FeCl3/CTAB/RM吸附前后TEM分析

图3 酸浸前后赤泥的SEM图
图5(a)、(b)分别为FeCl3/CTAB/RM 吸附Cu(Ⅱ)前、后的透射电镜图。经过超声分散的FeCl3/CTAB/RM 滴在铜片微栅上呈现片层结构。这是由于加入的表面活性剂增强了材料表面的分散性使得FeCl3/CTAB/RM 表面具有较少的聚集形态。此形态与Cu(Ⅱ)有很强的亲和作用,对Cu(Ⅱ)的吸附更加有利;吸附实验后可从图5(b)观察到FeCl3/CTAB/RM片层表面吸附了很多Cu(Ⅱ)[20]。
2.1.3 材料XRD分析
采用X 射线衍射仪分析,Cu 作为靶材,工作电压、电流分别作为分别40kV 和100mA,测量衍射角为10°~80°,对比分析RM、RM-HCl、FeCl3/CTAB/RM的矿物成分和晶型。
由图6 可知,RM 主要矿物成分有方解石(CaCO3)、钙钛矿(CaTiO3)、硅酸二钙(Ca2SiO4)、水钙铝榴石[Ca3Al2(SiO4)(OH)8]、赤铁矿(Fe2O3)和锐钛矿(TiO2)等矿物成分;经盐酸处理后,RM-HCl 中的一些金属氧化物的衍射峰消失,如Fe2O3、TiO2和CaCO3等,只在2θ=26.56°出现了SiO2的衍射峰。说明经盐酸处理后去除了大量的金属元素,达到了对RM提纯的目的,对后续吸附剂的改性提供了实验基础。经综合改性后的FeCl3/CTAB/RM,对照α-FeOOH 和β-FeOOH 的JCPDS 标准数据卡29-0713和34-1266,样品的XRD谱图出现了α-FeOOH 的主要特征峰(020,021,121,220,131)和β-FeOOH的主要特征峰(301,620,521,611)[17]。并且对比XRD 图谱中RM-HCl 和FeCl3/CTAB/RM 的衍射峰发现,二者均出现SiO2的特征峰,说明FeCl3和CTAB仅改性RM-HCl的表面而不是掺入RM-HCl层中。

图4 综合改性前后赤泥的SEM图

图5 吸附前后FeCl3/CTAB/RM样品的TEM图

图6 RM、RM-HCl和FeCl3/CTAB/RM样品的XRD图
2.1.4 材料的BET分析
N2吸附-脱附实验研究常用于表征材料的比表面积(SBET)、孔体积(V)、平均孔半径(R)和孔结构。图7展示了3种材料的N2吸附-脱附等温线,并将它们的表面特性参数列于表2。
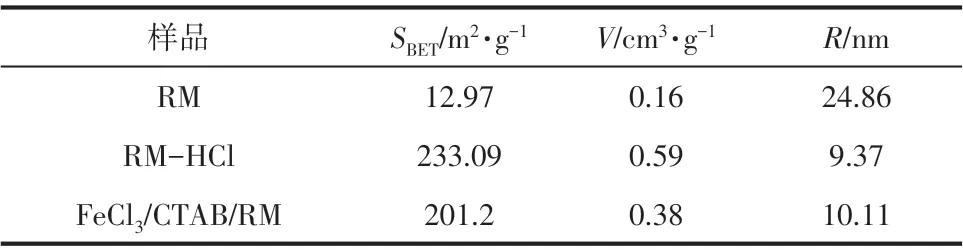
表2 RM、RM-HCl和FeCl3/CTAB/RM的表面特性参数
由BET 分析得,RM-HCl 的比表面积从12.97m2/g 增加到233.09m2/g,是由于经酸处理可以洗脱赤泥表面物质,去除分布于物质通道中的杂质,使赤泥中以凝聚体、集粒体、团聚体为主的结构变得疏松,进而孔道扩大,孔隙结构得到改善,有利于被吸附物质的扩散。此外,由于H+半径较小,较易置换出矿物层间离子半径较大的离子,如K+、Na+、Mg2+、Ca2+等,使孔隙容积变大,比表面积显著增大。但综合改性后比表面积有一定减小,这可能是由于大量的羟基氧化铁和表面活性剂接枝堵塞了赤泥表面孔道[21]。并且根据改性材料吸附分支的形状可将FeCl3/CTAB/RM 改性材料的吸附-脱附等温线分为Ⅱ型和H3 型滞后环[22],证实吸附剂表面存在尺寸与形状都很均匀的大中孔,吸附质与吸附剂间存在较强的相互作用,材料表面主要由片状颗粒和狭缝状孔隙的聚集体组成,这与SEM 表征结果一致。

图7 RM、RM-HCl和FeCl3/CTAB/RM样品的N2-吸脱附曲线图
2.1.5 材料的FTIR分析

图8 RM、RM-HCl和FeCl3/CTAB/RM样品的FTIR图谱
通过表征分析样品的红外图谱,研究改性前后RM、RM-HCl 及FeCl3/CTAB/RM 的化学结构及表面官能团。图8 展示了RM、RM-HCl 及FeCl3/CTAB/RM 的FTIR 图谱,从RM 的红外图谱可见,在3608cm-1和1632cm-1处的吸收峰对应于RM 表面的吸附水、结晶水和结构水中羟基的伸缩振动峰和结晶水的弯曲振动峰,可见RM中羟基水是以吸附水、结晶水和结构水三种形态存在;在1442cm-1、874cm-1和687cm-1处的单峰对应于碳酸钙中碳氧键的伸缩振动峰和弯曲振动峰,表明RM中存在大量的碳酸钙成分;在461cm-1和1113cm-1处分别对应于SiO2的Si O Si弯曲振动峰和Si O Si反对称伸缩振动峰,确定RM 中含有二氧化硅矿物成分。RM-HCl 图谱中在469cm-1、802cm-1和1107cm-1出现SiO2的Si O Si 弯曲振动峰、Si O Si 摇摆伸缩振动以及Si O Si 反对称伸缩振动峰,并且在962cm-1和3433cm-1处出现SiO2表面缔合态和游离态的Si OH 吸收峰,说明经酸处理后主要一些金属氧化物含量大幅减少,二氧化硅含量的有了明显提升,这与上述的XRD 图谱反映的一致。经FeCl3和CTAB 改性后,FeCl3/CTAB/RM 的图谱在469cm-1和1117cm-1左右分别出现Si O Si的弯曲振动峰、Si O Si 反对称伸缩振动峰,说明经过综合改性前后SiO2骨架并没有发生变化;在2941cm-1、2887cm-1和898cm-1、787cm-1、620cm-1、422cm-1处出现的新峰分别对应于CTAB的 CH 对称和反对称伸缩振动峰以及α-FeOOH和β-FeOOH的特征吸收峰。从而可以证明FeCl3/CTAB/RM 为FeCl3和CTAB改性的产物。
2.1.6 材料的元素分析
对改性前后的赤泥进行元素分析,如表3 所示,发现RM-HCl 中C、H 的含量较少且与RM 差别不大。综合改性后,由于大量的羟基氧化铁和表面活性剂的导入,对比RM-HCl,FeCl3/CTAB/RM中的C、H和N元素含量比例明显上升。

表3 RM、RM-HCl和FeCl3/CTAB/RM样品的元素分析单位:%
2.1.7 材料的热重分析
为了初步研究温度对材料热稳定性的影响,采用热重(TGA)对改性前后材料的热解性质进行研究。由图9 可知,RM 的热重曲线可以大致分为二个阶段:第一阶段为25~150℃的质量损失为3.5%,这主要由RM表面的吸附水蒸发引起;第二阶段为150~800℃,由于RM中的氢氧化铝物质脱水和方解石等矿物成分受热分解释放出CO2造成的质量损失[23]。RM-HCl 在25~100℃区域内有少量失重,是由于样品中残留水分的蒸发;在200~800℃区域内失重8%是由于经盐酸处理后的赤泥主要由SiO2构成,含碳化合物的比例低于RM,这就导致了在升温过程中RM-HCl的质量损失低于RM。FeCl3/CTAB/RM 在250~650℃区域内失重约13%,原因是少量的含碳化合物的热分解和不稳定的羟基官能团的分解导致了材料的质量损失。对比三种材料发现经改性过后的RM-HCl 和FeCl3/CTAB/RM 具有很好的热稳定性。

图9 RM、RM-HCl和FeCl3/CTAB/RM样品的TG图
2.1.8 材料zeta电位分析
为了研究3个样品的表面带电荷情况及在水溶液体系中的分散情况,分别测定了3 个样品的zeta电位随pH的变化情况(图10)。实际上,当zeta电位为零时,其所对应的pH即为样品的等电点pHzpc。当环境溶液的pH 小于pHzpc时,样品表面带正电荷,对阴离子有吸附作用;当环境溶液的pH 大于pHzpc时,样品表面带负电荷,对阳离子有吸附作用。
从图10 可以看出3 个样品的zeta 电位随pH 变化均不同,RM、RM-HCl、FeCl3/CTAB/RM 的等电点pHzpc分别为2.57、6.48、6.81。因CTAB 是一种阳离子表面活性剂,经表面活性剂修饰后改变了材料的电离度,使得其表面带上了更多的正电荷,所以FeCl3/CTAB/RM的等电点最高。特别值得注意的是,FeCl3/CTAB/RM 在pH<pHzpc(6.81)时仍能吸附Cu(Ⅱ),表明静电引力在整个吸附过程中为次要原因。
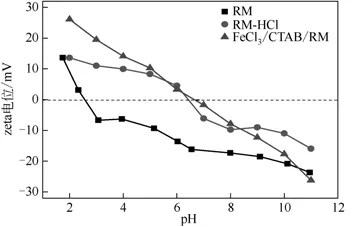
图10 RM、RM-HCl和FeCl3/CTAB/RM在不同pH下的zeta电位
2.2 改性材料吸附Cu(Ⅱ)性能分析
2.2.1 pH对Cu(Ⅱ)吸附的影响
水中的pH 会影响溶液中吸附材料的表面电荷和电离度。实验选择的pH 范围为1.0~6.0(消除铜沉淀对吸附的影响)。由图11可知,在同一温度下,FeCl3/CTAB/RM对Cu(Ⅱ)的吸附量随着pH的上升明显增强,这表明pH 对吸附Cu(Ⅱ)有很大的影响。这是因为在pH 较低的环境下,溶液中存在的大量H+会与Cu(Ⅱ)竞争结合电负性较高的原子,例如 OH 基团中的氧原子,导致重金属离子并没有被完全吸附,所以吸附率和吸附量相对较低;随着溶液中pH的升高,与吸附剂表面官能团结合的H+发生离解,从而使重金属离子被有效吸附,所以吸附率和吸附量是随着pH 的增大而增大的。因此,选择在pH=6.0的条件下进行后续实验。
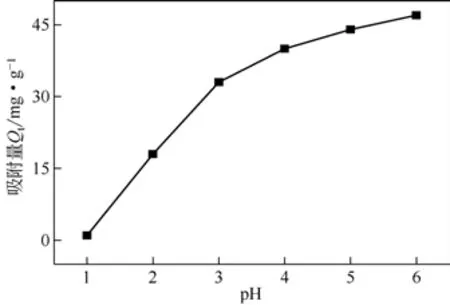
图11 不同pH对Cu(Ⅱ)吸附过程的影响
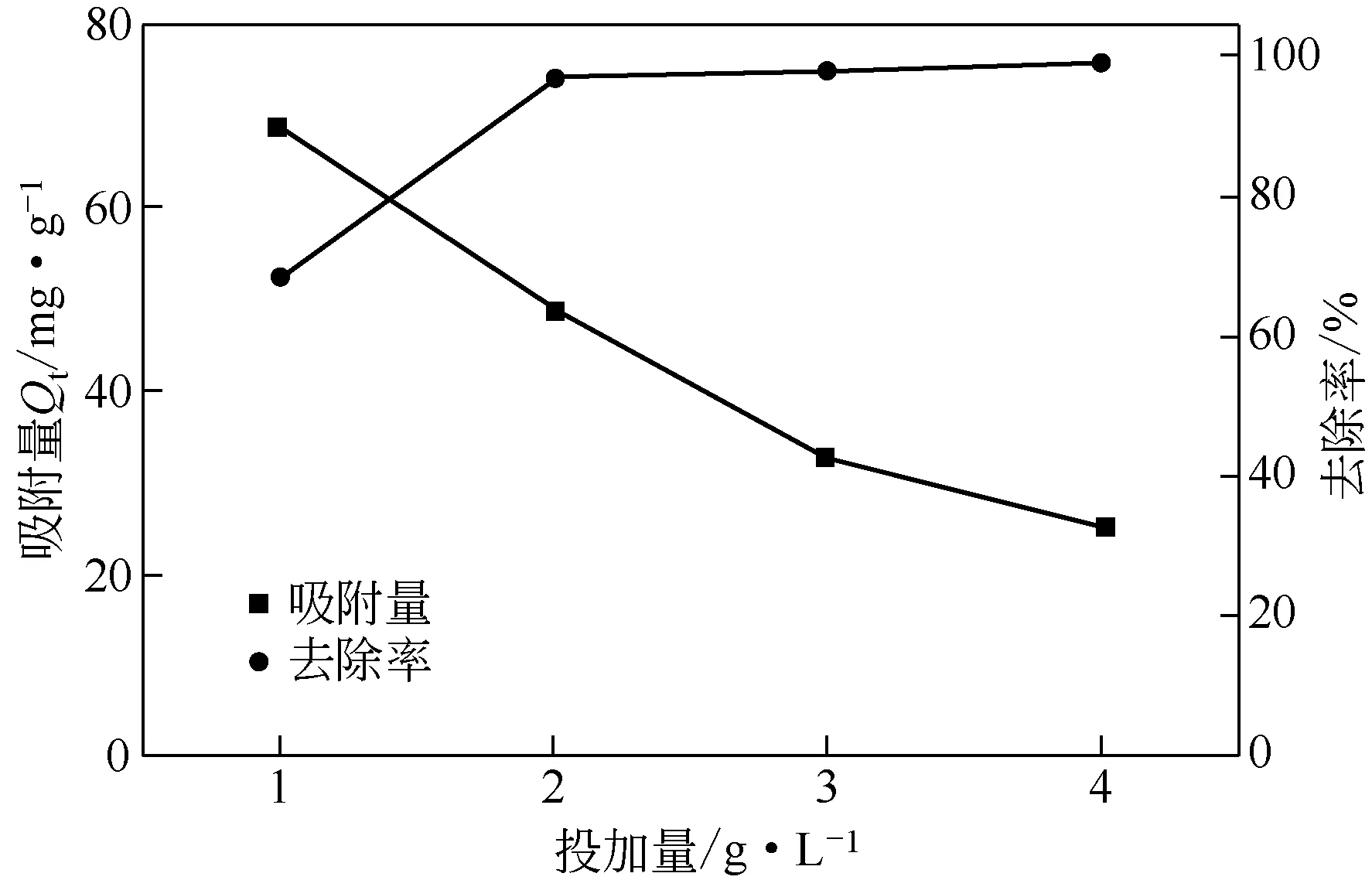
图12 吸附剂投加量对Cu(Ⅱ)吸附的影响
2.2.2 投加量对Cu(Ⅱ)吸附效果的影响取一系列10mL 初始浓度为100mg/L、pH=6 的Cu(Ⅱ)溶液,分别投加不同质量的吸附剂,在25℃下振荡3h,抽滤后分别测定滤液中Cu(Ⅱ)的剩余浓度,结果如图12 所示。在投加量为1g/L 时,去除率仅为64%;随着吸附剂投加量增大到2g/L 以上时,Cu(Ⅱ)的去除率基本保持在95%以上。这是因为吸附剂用量增加后,吸附剂总比表面积增大,材料表面吸附位点增多,从而能够吸附更多的Cu(Ⅱ)。因此,兼顾较高的去除效率和吸附量,后续实验设定投加量为2g/L。
2.2.3 温度和初始浓度对Cu(Ⅱ)吸附的影响
为了研究吸附过程中温度对吸附时间及吸附平衡的影响,在3 个温度水平研究了FeCl3/CTAB/RM对Cu(Ⅱ)的吸附去除率的变化。由图13 可知,温度对吸附效率影响不大,在180min 内随着温度的升高去除率略有增加;但对平衡时间有显著影响,平衡时间从288K 的120min 减少到308K 的90min。从而认为,升温有利于吸附且可以提高吸附去除率。

图13 温度对FeCl3/CTAB/RM吸附去除效率的影响
图14展示了不同初始浓度下,FeCl3/CTAB/RM对Cu(Ⅱ)的吸附去除率和平衡吸附量的变化。FeCl3/CTAB/RM 对Cu(Ⅱ)的吸附去除率随着初始浓度升高而降低,但是平衡吸附量逐渐升高,并且有饱和吸附的趋势。

图14 Cu(Ⅱ)初始浓度对FeCl3/CTAB/RM吸附去除率和平衡吸附量的影响
2.2.4 吸附动力学
利用准一级动力学模型、准二级动力学模型和Elovich 模型用于拟合三种不同初始浓度的Cu(Ⅱ)(200mg/L、300mg/L 和400mg/L)的实验动力学数据,其数据如图15和表4所示。对比拟合的三个模型可以看出准二级动力学方程更好地拟合Cu(Ⅱ)的吸附,拟合系数达到0.998,且该模型拟合出的平衡吸附量更接近实测值。而准一级动力学模型和Elovich 模型与实测值偏差较大。因此FeCl3/CTAB/RM 对Cu(Ⅱ)的吸附速率主要受化学吸附和物理吸附作用控制,但以化学吸附作用为主。
2.2.5 吸附等温线
利用Langmuir、Freundlich 和Temkin 模型对不同温度下实验数据进行等温线模型拟合,拟合数据如图16 和表5。对比实验数据和拟合曲线的吻合度、拟合线性度R2,3 种模型对FeCl3/CTAB/RM 吸附Cu(Ⅱ)过程的拟合度顺序为Langmuir>Freundlich>Temkin,该吸附过程最优符合Langmuir 等温线模型,属于单层化学吸附机制控制的吸附行为。并且Freundlich 等温模型在不同温度下拟合出的1/n在0.5 左右,表明吸附过程较易进行。KF值随着温度的升高而增大也表明温度升高有利于Cu(Ⅱ)去除,且整个吸附过程为吸热反应。
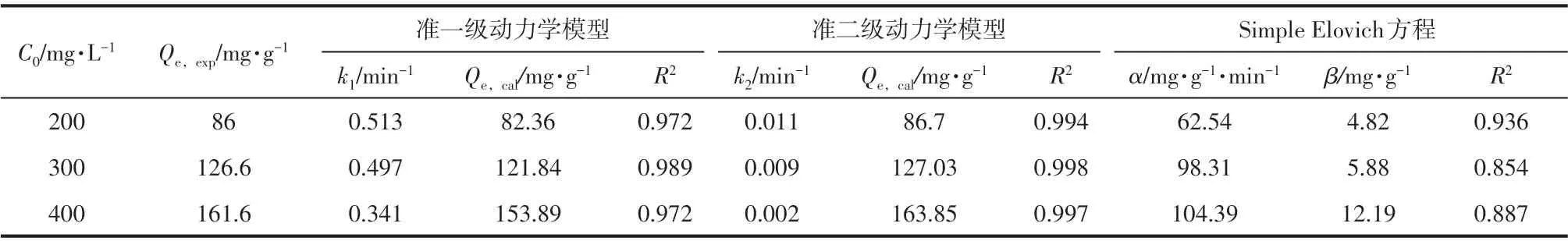
表4 不同初始Cu(Ⅱ)浓度下吸附的动力学参数

图15 不同初始浓度的Cu(Ⅱ)准一级、准二级和Elovich动力学模型拟合曲线

图16 不同初始温度Cu(Ⅱ)Langmuir、Freundlich和Temkin吸附等温线模型拟合曲线
2.2.6 吸附热力学
通过吸附热力学的研究可以了解吸附过程进行的程度和驱动力,也可以深入分析各因素对吸附影响的原因。热力学参数包括熵变ΔS0[J/(mol·K)]、焓变ΔH0(kJ/mol)以及Gibbs自由能变化ΔG0(kJ/mol)。这些参数之间的关系可通过式(3)、式(4)得出。

表5 在不同温度下Cu(Ⅱ)吸附的等温线参数

式中,Qe为平衡吸附容量,mg/g;Ce为Cu(Ⅱ)的平衡浓度,mg/L;T为热力学温度,K;R为气体常数,R=8.314J/(mol·K)。
通过等温线模型数据,结合式(3)、式(4)计算出的FeCl3/CTAB/RM 对Cu(Ⅱ)在不同温度下吸附的热力学参数如表6 所示。从表中数据可以看出,ΔG0均为负值,这表明FeCl3/CTAB/RM 对Cu(Ⅱ)的吸附过程是一个自发的反应,温度升高ΔG0值减小,说明升高温度更有利于吸附[24]。

表6 FeCl3/CTAB/RM吸附Cu(Ⅱ)热力学参数
2.2.7 FeCl3/CTAB/RM 与其他铜离子吸附剂的吸附性能比较
将合成的FeCl3/CTAB/RM改性吸附剂与其他改性赤泥吸附剂进行比较,结果见表7。
通过对比合成的FeCl3/CTAB/RM改性吸附剂与其他RM基改性吸附剂的吸附性能,可以发现:经FeCl3和CTAB 改性后,提高了材料FeCl3/CTAB/RM在水溶液中的分散性以及复合材料与Cu(Ⅱ)之间的亲和力,并且成功负载了更多的反应活性羟基使FeCl3/CTAB/RM 在吸附Cu(Ⅱ)过程中表现出较高的吸附容量。说明FeCl3/CTAB/RM是一种潜在高性能重金属铜离子吸附剂。鉴于此,研究该改性吸附剂对Cu(Ⅱ)的吸附机理尤为重要。
3 吸附机理和活性位点研究
3.1 吸附前后SEM表征分析
为了研究FeCl3/CTAB/RM 吸附Cu(Ⅱ)前后吸附剂表面形貌变化,对吸附前后的材料进行SEM 表征,同时对吸附剂中的氯元素(Cl)进行EDS-Mapping表征,结果如图17所示,EDS分析数据列于表8。
从图17可以看出,FeCl3/CTAB/RM 吸附Cu(Ⅱ)前后吸附剂表面形貌没有发生明显变化,但是吸附引起了FeCl3/CTAB/RM颗粒的团聚现象。为了确定吸附过程中是否存在静电引力作用,通过EDSMapping 分析吸附前后的氯元素含量。由图17 可知,吸附前的FeCl3/CTAB/RM 表面氯元素含量较多,分布均匀密集,吸附Cu(Ⅱ)后的Mapping 图中氯元素的含量依然均匀但密度明显降低,说明对Cu(Ⅱ)的吸附可能降低了FeCl3/CTAB/RM 中的氯元素含量,而这可能与静电引力有关。表8 展示了EDS 数据,FeCl3/CTAB/RM 在吸附后样品中检测到了Cu 元素,对比吸附前后样品的元素组成及含量可以看出,对Cu 的吸附引起了Cl 元素的明显降低。表明Cl 可能是吸附位点,重金属与Cl 成键,降低Cl元素的检出含量。
3.2 吸附前后XRD表征分析
为了研究重金属铜的吸附对FeCl3/CTAB/RM吸附剂的晶型结构的影响,对吸附前后的吸附材料进行了XRD表征,结果如图18所示。
从图18可以看出,FeCl3/CTAB/RM 吸附Cu(Ⅱ)前后本身的晶型结构几乎没有影响,吸附剂始终表现为无定形结构和SiO2的硅氧四面体结构,说明对Cu(Ⅱ)的吸附不会改变FeCl3/CTAB/RM 吸附剂的晶型结构;但特别注意的是,在吸附Cu(Ⅱ)后,FeCl3/CTAB/RM 中的FeOOH 峰的强度降低,表明一部分的活性位点主要位于改性材料表面负载的羟基氧化铁上。
3.3 吸附前后FTIR和XPS表征分析
为了研究吸附剂对Cu(Ⅱ)的吸附作用机理,对FeCl3/CTAB/RM 吸附Cu(Ⅱ)前后的红外谱图进行表征,以研究吸附前后的基团变化,FTIR 结果见图19。
根据图19可以看出,FeCl3/CTAB/RM吸附Cu(Ⅱ)前后红外图谱发生了位移。吸附铜后在3400~3600cm-1和950cm-1处的Si OH 振动峰以及位于400~900cm-1处的α-FeOOH 和β-FeOOH 的吸收峰在吸附后发生了偏移和峰强的减弱,可以认为在吸附前后发生了氢键或离子交换作用。这些变化反映了重金属离子铜与羟基之间的相互作用,说明吸附主要发生在羟基基团(Si OH、α-FeOOH 和β-FeOOH)的位点上。

表7 不同吸附剂材料对铜离子的吸附性能比较

图17 FeCl3/CTAB/RM吸附Cu(Ⅱ)前后SEM、氯元素EDS-mapping表征结果

表8 FeCl3/CTAB/RM吸附Cu(Ⅱ)前后EDS元素分析数据

图18 FeCl3/CTAB/RM吸附Cu(Ⅱ)前后XRD图

图19 FeCl3/CTAB/RM对Cu(Ⅱ)吸附前后样品FTIR图谱
XPS通常用于识别吸附物与吸附剂表面官能团的相互作用,因为它们之间产生化学键会改变相应原子周围电子的分布。图20(a)、(b)展示了吸附前后改性材料的O1s XPS光谱,在530eV、531.7eV和532.7eV 处的峰分别归因于Fe O、Si O 和 OH中的氧。吸附铜后在530.8eV处出现了一个新的Cu O峰,表明FeCl3/CTAB/RM 表面的羟基与Cu(Ⅱ)形成了复合物。
另外,观察图21 中吸附后FeCl3/CTAB/RM 的Cu2p电子结合能谱,发现在932.8eV和953eV处的结合能分别对应于Cu2p3/2和Cu2p1/2,在933.6eV 处对应二价铜氧化物,这与通过FTIR 研究得到的结论一致,即羟基(Si-OH、α-FeOOH和β-FeOOH)上的氧是主要的吸附位点。

图20 吸附Cu(Ⅱ)前后FeCl3/CTAB/RM材料的XPS的O1s图谱

图21 FeCl3/CTAB/RM对Cu(Ⅱ)吸附后的Cu2p的XPS分峰
3.4 反应机理
对FeCl3/CTAB/RM改性材料上的吸附活性位点进行研究,发现吸附位点是位于材料表面的羟基以及掺杂的氯原子和表面活性剂。其吸附机制涉及物理吸附(微胶束[28]、静电引力)和化学吸附(离子交换)。吸附过程主要是通过如式(5)~(8)。


式(5)~(8)中Composite为FeCl3/CTAB/RM。
改性材料对Cu(Ⅱ)的吸附行为和吸附机理总结如下:在废水中加入改性材料后,Cu(Ⅱ)离子被吸引并逐渐迁移到材料表面,然后与材料表面的吸附活性位点相互作用,其中包括位于改性材料表面的Si OH和负载的羟基氧化铁(α-FeOOH、β-FeOOH)通过离子交换或氢键作用以及掺杂的氯原子(静电引力)和表面活性剂(微胶束)有效地吸附Cu(Ⅱ)。在整个过程中,化学吸附作用控制了该过程的吸附速率。
4 结论
(1)采用水热合成法对拜耳法赤泥依次经过浓盐酸、三氯化铁和十六烷基三甲基溴化铵处理、改性,通过SEM、FTIR、TEM、BET 等手段对其表征。结果表明:经酸处理后,材料的比表面积显著增大并且通过FeCl3和CTAB对RM-HCl改性,改变了材料表面的结构和性质,使材料FeCl3/CTAB/RM对Cu(Ⅱ)具有很好的吸附效果。
(2)改性材料FeCl3/CTAB/RM 对铜的吸附在100min 达到平衡,其最佳吸附pH 为6、最佳吸附剂投加量为2g/L、饱和吸附量为221mg/g。吸附动力学和等温线模型拟合数据表明,FeCl3/CTAB/RM对Cu(Ⅱ)的吸附过程符合准二级动力学模型以及Langmuir吸附等温模型,说明该吸附属于单分子层化学吸附;从热力学参数表明该吸附剂对Cu(Ⅱ)的吸附是吸热、自发的过程。
(3)吸附机理研究表明,活性吸附位点主要是位于改性材料表面的Si OH 和负载的羟基氧化铁以及掺杂的氯原子和表面活性剂,通过物理吸附(静电引力、微胶束)和化学吸附(离子交换、氢键)有效地去除Cu(Ⅱ)离子。

图22 Cu(Ⅱ)的吸附机理
[3] BHATNAGAR A, VILAR V J, BOTELHO C M, et al. A review of the use of red mud as adsorbent for the removal of toxic pollutants from water and wastewater[J]. Environmental Technology, 2011, 32(3):231-249.
[4] SOYLAK M, MURAT I. A new coprecipitation methodology with lutetium hydroxide for preconcentration of heavy metal ions in herbal plant samples[J].Journal of Aoac International,2014,97(4):1189.
[5] BULGARIU L, BULGARIU D. Selective extraction of Hg(Ⅱ), Cd(Ⅱ)and Zn(Ⅱ) ions from aqueous media by a green chemistry procedure using aqueous two-phase systems[J]. Separation & Purification Technology,2013,118(43):209-216.
[6] PENG W,LI H,LIU Y,et al.A review on heavy metal ions adsorption from water by graphene oxide and its composites[J]. Journal of Molecular Liquids,2017,230:496-504.
[7] 文小年.氧化铝工业废渣(赤泥)的吸附特性及其环境修复材料制备[D].桂林:桂林理工大学,2006.WEN X N. Adsorption characteristics of alumina industrial waste(red mud) and preparation of environmental remediation materials[D].Guilin:Guilin University of Technology,2006.
[8] 潘嘉芬,李梦红.拜耳法赤泥陶粒改性及吸附废水中氟离子试验[J].有色金属(冶炼部分),2015(2):63-65.PAN Jiafen, LI Menghong. Modification of porous ceramsite with red mud of Bayer process and adsorbing fluoride from waste water[J].Nonferrous Metals(Extractive Metallurgy),2015(2):63-65.
[9] LI D, DING Y, LI L, et al. Removal of hexavalent chromium by using red mud activated with cetyltrimethylammonium bromide[J].Environmental Technology,2015,36(9):1084-1090.
[10] 吴建锋,方斌正,徐晓虹,等.用于去除电镀废水中As(V)的赤泥基环境修复材料的研究[C]//第7 届亚洲陶瓷技术研讨会, 中国,江西,2011.WU J F, FANG B Z, XU X H, et al. Study on red mud environmental remediation materials for removal As(V) ions in electroplating wastewater[C]//The 7th Asian Ceramic Technology Seminar. Jiangxi,China,2011.
[11] VENKATESAN G, NARAYANAN S L. Synthesis of Fe2O3coated and HCl treated bauxite ore waste for the adsorption of arsenic (Ⅲ) from aqueous solution: isotherm and kinetic models[J]. Chemical Engineering Communications,2017,205(1):34-46.
[12] CUI Y W, LI J, DU Z F, et al. Cr(Ⅵ) adsorption on red mud modified by lanthanum: performance, kinetics and mechanisms[J]. PloS One,2016,11(9):e0161780.
[13] JIE C, NING W, MA H, et al. Facile Modification of a polythiophene/TiO2composite using surfactants in an aqueous medium for an enhanced Pb(Ⅱ)adsorption and mechanism investigation[J].Journal of Chemical&Engineering Data,2017,62(7):2208-2221.
[14] 张多,张盼月,田帅,等.用于磷吸附的载铁(β-FeOOH)沸石制备及特性[J].环境工程学报,2014,8(2):499-504.ZHANG Duo, ZHANG Panyue, TIAN Shuai, et al. Preparation of β-FeOOH loaded-zeolite and its characteristics for phosphorus adsorption[J]. Chinese Journal of Environmental Engineering, 2014, 8(2):499-504.
[15] CUI H,YANG X,XU L,et al.Effects of goethite on the fractions of Cu,Cd,Pb,P and soil enzyme activity with hydroxyapatite in heavy metalcontaminated soil[J].RSC Advances,2017,7(72):45869-45877.
[16] 刘俊,楼跃丰,李军.石英砂表面负载铁氧化物的方法和特性[J].化工进展,2016,35(2):624-628.LIU Jun, LOU Yuefeng, LI Jun. Method and characteristics of iron oxides coated on quartz sand surface[J]. Chemical Industry and Engineering Progress,2016,35(2):624-628.
[17] WEI W, CONG Haibing, XIONG Huixin. The properties of FeOOH precipitates formed in CTAB-rich FeCl3solutions at various pH and ethanol contents[J]. Colloid & Polymer Science, 2018, 296(7): 1205-1212.
[18] SAHU M K, MANDAL S, DASH S S, et al. Removal of Pb(Ⅱ) from aqueous solution by acid activated red mud[J]. Journal of Environmental Chemical Engineering,2013,1(4):1315-1324.
[19] 高鹏杰.氧化铝赤泥改性及对废水中Cr(Ⅵ)的吸附研究[D].郑州:郑州大学,2016.GAO P J. Modification of alumina red mud and research on the adsorption of Cr(VI) in polluted water[D]. Zhengzhou: Zhengzhou University,2016.
[20] 徐翔丽.氨基功能化氧化石墨烯重金属吸附剂的制备与应用[D].长沙:湖南大学,2014.XU Xiangli. The preparation and and characterization of aminofunctionalized graphene oxide as heavy metal adsorbents [D].Changsha:Hunan University,2014.
[21] 石太宏,吕灿,左莉娜.硅烷化改性沸石对重金属离子的吸附性能[J].环境工程学报,2013,7(3):1045-1052.SHI Taihong, LÜ Can, ZUO Lina. Adsorption of heavy metal ions by silylation modified zeolite[J]. Chinese Journal of Environmental Engineering,2013,7(3):1045-1052.
[22] 柏珊珊.介孔分子筛的表面修饰及其对重金属离子的吸附性能研究[D].哈尔滨:哈尔滨工业大学,2010.BAI S S. Study on the modification of mesoporous molecular sieve and their adsorption properties of heavy metals[D]. Harbin: Harbin Institute of Technology,2010.
[23] 韩毅,王京刚,唐明述.赤泥氯化铁改性材料的制备及其表征[J].有色金属(选矿部分),2004(2):37-40.HAN Yi, WANG Jinggang, TANG Mingshu. Modification and characterization of red mud activated by FeCl3[J]. Nonferrous Metals,2004(2):37-40.
[24] LYU W, YU M, FENG J, et al. Highly crystalline polyaniline nanofibers coating with low-cost biomass for easy separation and high efficient removal of anionic dye ARG from aqueous solution[J].Applied Surface Science,2018,458:413-424.
[25] TSAMO C, DJONGA P N D, DIKDIM J M D, et al. Kinetic and equilibrium studies of Cr(VI),Cu(Ⅱ)and Pb(Ⅱ)removal from aqueous solution using red mud, a low-cost adsorbent[J]. Arabian Journal for Science&Engineering,2017,43(5):1-16.
[26] 李孟,刘丹,吴梓鸿.赤泥基多孔陶瓷材料及其改性物除Cu2+研究[J].武汉理工大学学报,2010,32(18):29-32.LI Meng, LIU Dan, WU Zihong. Research on the removal of Cu2+by red mud-based porous ceramic material and its modification[J].Journal of Wuhan University of Technology,2010,32(18):29-32.
[27] PELLERA F, GIANNIS A, ANASTASIADOU K, et al. Adsorption of Cu( Ⅱ) ions from aqueous solutions using biochar prepared from agricultural byproducts[J]. Journal of Environmental Management,2012,96(1):35-42.
[28] RUI F P P,VALENTE A J M,BURROWS H D.The interaction of long chain sodium carboxylates and sodium dodecylsulfate with lead(Ⅱ)ions in aqueous solutions[J]. Journal of Colloid & Interface Science,2014,414(414C):66-72.

