早期心肌缺血大鼠心肌中BNP的时序性表达
翟利琴,郭相杰,靳茜茜,刘明哲,郭华林,高彩荣*
(1山西医科大学法医学院病理教研室,太原 030001;2山西省人民医院病理科;*通讯作者,E-mail:gaocairong5175@163.com)
心源性猝死是法医病理学鉴定中最常见的死亡,然而,部分心源性猝死仅可见冠状动脉狭窄,无明确心肌缺血的组织学表现,但尸检排除其他死因,称为“冠状动脉性猝死”。冠状动脉性猝死的诊断一直是法医病理学的难题[1],尤其在死亡前有用药史时,其与药物过敏性猝死的鉴别更是难上加难。
脑钠尿肽(brain natriuretic peptide,BNP)是主要由心室肌细胞分泌的一种蛋白,在心衰的诊断中有重要价值[2]。早期心肌缺血时BNP表达是否发生变化,能否为缺乏传统形态学指标的早期心肌缺血提供辅助性诊断依据?为了探讨上述问题,我们结合生物信息分析学,观察大鼠心肌缺血时BNP随时间的序贯性表达变化。
1 材料与方法
1.1 主要试剂与仪器
Trizol裂解液(Invitrogen Corporation,美国),Revert Aid RT Reverse Transcription Kit(Thermo Fisher Scientific Corporation,美国),SYBR®Green PCR Master Mix(Thermo Fisher Scientific Corporation,美国),RIPA裂解液(杭州碧云天生物技术研究所),BCA蛋白浓度测定试剂盒(杭州碧云天生物技术研究所),兔抗鼠Anti-BNP antibody(ab19645,Abcam Corporation,英国),山羊抗兔IgG-HRP(BA1054,武汉博士德生物试剂公司),BNP ELISA试剂盒(上海西唐生物科技有限公司),BL-420S生物机能仪(成都泰盟科技有限公司),TC1000-S常规PCR仪(大龙兴创实验仪器有限公司),7500 FAST real-time PCR仪(Applied Biosystems Corporation,美国),JY300C通用电泳仪(北京君意电泳设备有限公司),RM2245型病理切片机(Leica Corporation,德国)。
1.2 实验动物
清洁级雄性SD大鼠,10-12周龄,体质量200-220 g,由中国医学科学院阜外医院动物实验中心提供,动物生产许可证号SCXK(京)2012-0001。
1.3 生物信息学分析
在GEO(Gene Expression Omnibus)数据库中输入检索词“acute myocardial infarction/ischemia”,检索得到编号为GSE4648的基因表达谱数据[3],对该数据进行分析,观察BNP在各组表达水平,然后进一步设计动物实验进行验证。
1.4 实验动物分组
SD大鼠随机分为正常对照组(n=6)、过敏性猝死组(n=6)、假手术组(n=6)及早期心肌缺血组(n=48)。早期心肌缺血组根据结扎左冠状动脉前降支后处死的时间点进一步分为0.5 h组、1 h组、2 h组、4 h组、8 h组、12 h组、24 h组和48 h组,每组6只。
1.5 大鼠心肌缺血模型制备
48只SD大鼠常规消毒、麻醉后经口气管插管。插管成功后,连接小动物呼吸机,调节潮气量3 ml/100 g,呼吸频率60次/min,呼吸比1 ∶1,四肢连接BL-420S生物机能仪导联,记录心电图。参照文献[4]的方法,沿胸骨中线左侧1 cm处纵向剪开皮肤,在第4、5肋间心尖搏动最强处钝性分离皮下组织及肌层,挤压两侧胸壁,挤出心脏。用棉签轻轻推开左心耳,在肺动脉圆锥与左心耳间距离主动脉根部3-4 mm处、沿左冠状静脉走行,用7-0号缝线结扎左冠状动脉前降支,进针深度约1.5 mm、宽度约2 mm,打结,缝合,关闭胸腔,复张肺组织,拔出气管内插管。根据文献[5]报道,出现以下条件之一者判断为大鼠心肌缺血造模成功:①心电图ST段向上偏移≥0.1 mV;②T波高耸超过同导联R波高度的1/2。同时肉眼观察大鼠左心室前壁结扎点下方心肌颜色由粉红变为苍白。
术后常规饲料及饮水,结扎冠状动脉后0.5,1,2,4,8,12,24,48 h脱臼处死大鼠,开胸取出心脏,生理盐水冲洗,取冠状动脉结扎点平面以下左心室前壁缺血区心肌,部分心肌液氮冻存,部分心肌10%中性甲醛固定、保存。
假手术组缝合线只穿过心肌组织,而不结扎冠状动脉,脱臼处死大鼠,开胸取出心脏,生理盐水冲洗,取左心室前壁心肌组织,部分心肌液氮冻存,部分心肌10%中性甲醛固定、保存。
1.6 大鼠过敏性猝死模型制备
参照文献[6]制备大鼠过敏性猝死模型。实验第1天6只SD大鼠腹腔内注射5%鸡卵清蛋白0.8 ml和4%氢氧化铝佐剂0.5 ml致敏。实验第18天经大鼠尾静脉注射10%鸡卵清蛋白2 ml,诱发过敏性休克,取左心室前壁心肌组织,部分心肌液氮冻存,部分心肌10%中性甲醛固定、保存。
1.7 实时荧光定量PCR检测
提取心肌组织总RNA,逆转录合成cDNA,设计并合成引物,根据说明书配置反应体系,反应条件如下:95 ℃预变性5 min,然后95 ℃变性10 s,60 ℃退火、延伸30 s,共40个循环。扩增反应结束后,反应体系温度按照每5 s升高1 ℃继续从60 ℃缓慢升高到95 ℃,采集PCR产物的熔解曲线。BNP及内参引物序列见表1。
表1 BNP引物序列
Table 1 Primer sequence of BNP
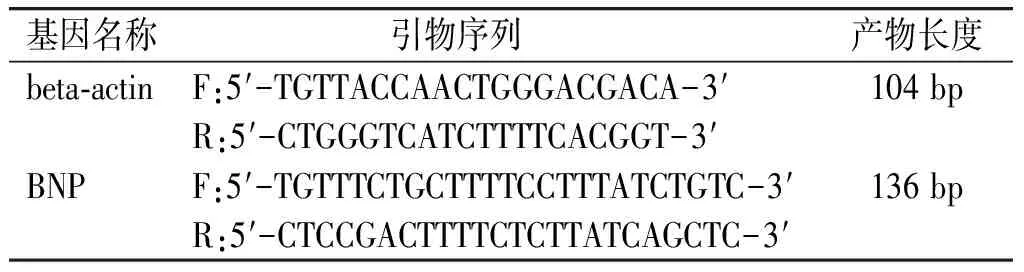
基因名称引物序列 产物长度beta-actinF:5′-TGTTACCAACTGGGACGACA-3′104 bpR:5′-CTGGGTCATCTTTTCACGGT-3′BNPF:5′-TGTTTCTGCTTTTCCTTTATCTGTC-3′136 bpR:5′-CTCCGACTTTTCTCTTATCAGCTC-3′
1.8 Western印迹分析
取50 mg心肌组织,采用裂解法提取总蛋白,SDS-PAGE凝胶电泳,然后转至硝酸纤维膜上,室温封闭2 h,用TBST缓冲液漂洗3次。加入兔抗鼠Anti-BNP单克隆一抗1 ∶500稀释液5 ml,4 ℃下摇床孵育过夜,TBST漂洗3次。加入山羊抗兔IgG-HRP二抗1 ∶500稀释液5 ml,室温下摇床孵育2 h,HRP-ECL发光法成像,并保存图像。以GADPH为内参,BNP蛋白条带光密度与内参蛋白条带光密度比值作为BNP蛋白表达水平的参数。
1.9 大鼠心肌组织免疫组织化学染色
大鼠心肌组织经10%中性甲醛固定24 h后沿水平面切取心肌组织,石蜡包埋,常规3 μm厚度切片,HE染色,光学显微镜下观察组织形态学变化。同时,切取2 μm厚度切片,采用EnVision二步法进行抗BNP蛋白单克隆抗体免疫组化染色。分别对每张免疫组化染色切片进行评分,评分标准如下:先分别计数阳性细胞百分比(A)及阳性着色程度(B)。阳性细胞百分比:无阳性细胞为0,阳性细胞比例1%-10%为1,阳性细胞比例11%-50%为2,阳性细胞比例51%-80%为3,阳性细胞比例81%-100%为4。阳性着色程度:阴性着色为0,弱阳性为1,中度阳性为2,强阳性为3。再以A×B作为综合评分,评分范围为0-12分,其中0-1分为阴性着色(-),2-3分为弱阳性着色(+),4-6分为阳性着色(++),7-9分为中度阳性着色(+++),10-12分为强阳性着色(++++)。
1.10 统计学分析

2 结果
2.1 GEO数据库生物信息学分析结果
在GEO数据库中查询到标题为“Earliest Changes in the Left Ventricular Transcriptome Post-Myocardial Infarction”的基因表达谱数据,该数据编号为GSE4648,采用结扎大鼠左冠状动脉前降支的方法造成大鼠急性心肌梗死模型,分别于造模成功后15 min,60 min,4 h,12 h,24 h,48 h取左心室前壁缺血区心肌、缺血区周围及室间隔心肌组织,每个时间点包含2个样本。另设立假手术组,分别于术后15 min,60 min,4 h,12 h,24 h,48 h取左心室前壁及室间隔心肌组织,每个时间点包含2个样本。正常对照组含6只未作任何处理的大鼠,取左心室前壁及室间隔心肌。心肌缺血组在缺血4 h时,BNP荧光信号强度上升,之后随缺血时间延长,信号持续上升,在缺血24 h信号强度达到峰值,缺血48 h信号减弱(见图1)。
2.2 大鼠心肌缺血模型观察
早期心肌缺血组48只SD大鼠在结扎成功后短时间内即出现ST段向上偏移,或T波高耸、尖锐,部分大鼠T波与R波融合(见图2)。假手术组6只SD大鼠均未出现上述改变。结扎左冠状动脉过程中,急性心肌缺血组13只、假手术组2只大鼠在手术线穿过心肌组织后数秒内出现一过性Q波变化,表现为Q波增宽加深,但这种变化出现短暂,持续数秒后恢复正常。

图1 BNP基因在不同分组、不同时间点荧光信号强度比较Figure 1 Fluorescence signal intensity of BNP in different groups at different time point after myocardial ischemia

图2 早期心肌缺血组SD大鼠左冠状动脉前降支结扎后心电图Figure 2 The electrocardiogram of SD rats in EMI group after the left anterior descending coronary artery was ligated
2.3 大鼠过敏性猝死模型观察
过敏性猝死组6只SD大鼠在接受抗原攻击后3-7 min内陆续出现躁动、竖毛、搔抓、口唇紫绀,12-15 min开始出现呼吸困难、鼻翼扇动、站立不稳等过敏性休克症状,30 min内死亡。
2.4 实时荧光定量PCR结果
与对照组相比,大鼠过敏性猝死组、假手术组左心室前壁心肌及缺血0.5 h组、1 h组缺血区心肌BNP mRNA水平差异无统计学意义(P>0.05);与对照组相比,缺血2 h组BNP mRNA水平升高(P<0.05);缺血4 h组、缺血8 h组BNP mRNA水平都较前更进一步升高(P<0.01);缺血12 h组BNP mRNA水平与缺血8 h组相比差异无统计学意义(P>0.05);BNP mRNA表达水平在缺血24 h时达到峰值(P<0.01);缺血48 h组BNP mRNA表达较缺血24 h组下降(P<0.05),但仍高于对照组及缺血1 h组、2 h组和4 h组(P<0.01,见表2)。以上结果表明,缺血区心肌BNP mRNA表达水平呈现缓慢上升,平台维持,然后缓慢下降的趋势。
表2 各组左心室前壁心肌组织BNP mRNA相对表达量的比较
Table 2 The relative level of BNP mRNA in left ventricular anterior wall myocardium in different groups
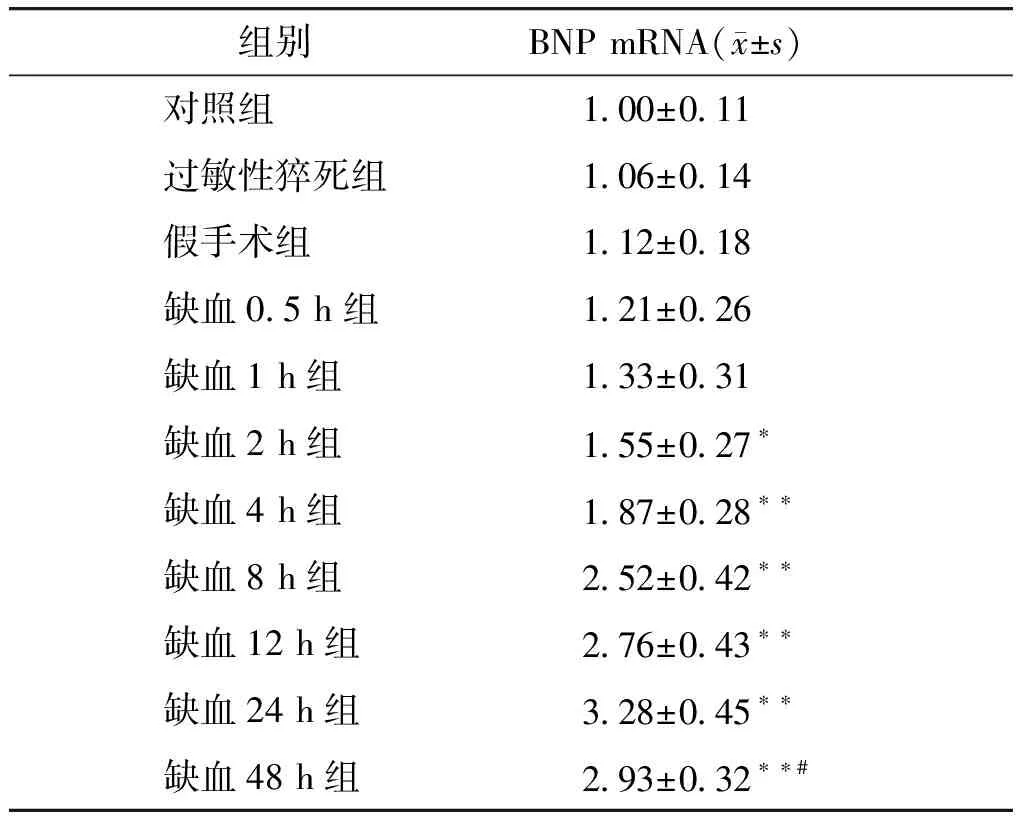
组别BNP mRNA(x±s)对照组1.00±0.11过敏性猝死组1.06±0.14假手术组1.12±0.18缺血0.5 h组1.21±0.26缺血1 h组1.33±0.31缺血2 h组1.55±0.27∗缺血4 h组1.87±0.28∗∗缺血8 h组2.52±0.42∗∗缺血12 h组2.76±0.43∗∗缺血24 h组3.28±0.45∗∗缺血48 h组2.93±0.32∗∗#
与对照组比较,*P<0.05,**P<0.01;与缺血24 h组比较,#P<0.05
2.5 Western印迹结果
Western blot显示,过敏性猝死组、假手术组BNP蛋白表达与对照组相比差异无统计学意义(P>0.05,见表3)。早期心肌缺血组BNP蛋白表达呈缓慢上升趋势,具体表现为:缺血0.5 h组、1 h组和2 h组BNP蛋白表达与对照组相比差异无统计学意义(P>0.05);缺血4 h组,BNP蛋白表达增高,高于对照组、缺血0.5 h组、1 h组和2 h组(P<0.05);缺血8 h组,BNP蛋白表达进一步增高,高于缺血0.5 h组、1 h组、2 h组和4 h组(P<0.01);BNP蛋白表达最大值出现在缺血12 h组和24 h组(P<0.01);缺血48 h组BNP蛋白表达下降,与缺血12 h组、24 h组相比差异有统计学意义(P<0.05),但仍明显高于缺血0.5 h、1 h、2 h、4 h、8 h组(P<0.01,见表3)。
表3 实验各组左心室前壁心肌组织BNP蛋白相对表达量
Table 3 The relative level of BNP protein in left ventricular anterior wall myocardium in different groups
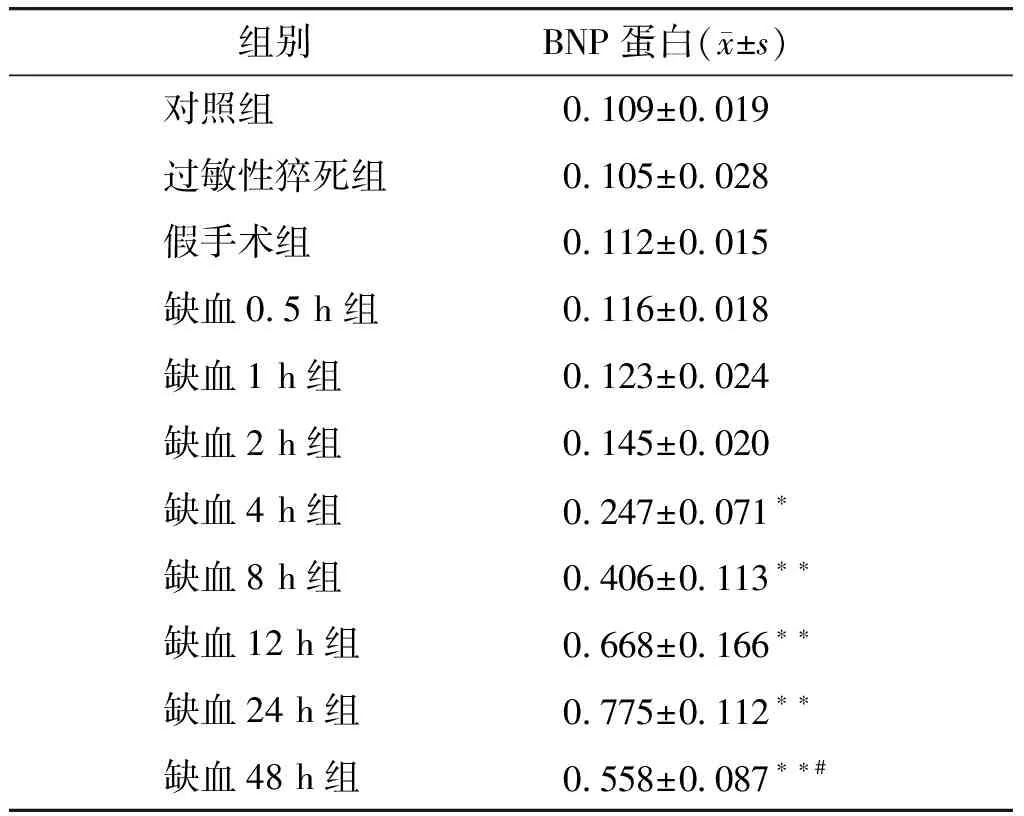
组别BNP蛋白(x±s)对照组0.109±0.019过敏性猝死组0.105±0.028假手术组0.112±0.015缺血0.5 h组0.116±0.018缺血1 h组0.123±0.024缺血2 h组0.145±0.020缺血4 h组0.247±0.071∗缺血8 h组0.406±0.113∗∗缺血12 h组0.668±0.166∗∗缺血24 h组0.775±0.112∗∗缺血48 h组0.558±0.087∗∗#
与对照组比较,*P<0.05,**P<0.01;与缺血12 h和24 h组比较,#P<0.05
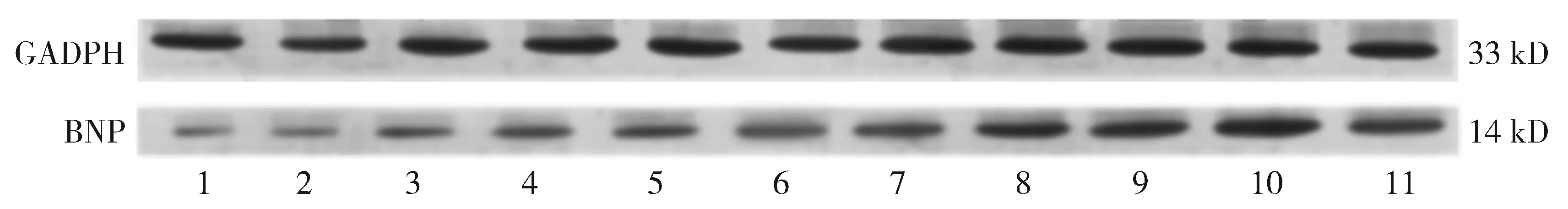
1.对照组;2.过敏性猝死组;3.假手术组;4.缺血0.5 h组;5.缺血1 h组;6.缺血2 h组;7.缺血4 h组;8.缺血8 h组;9.缺血12 h组;10.缺血24 h组;11.缺血48 h组图3 Western blot检测BNP蛋白在实验各组左心室前壁心肌组织中的表达Figure 3 BNP protein expression in left ventricular anterior wall myocardium in different groups by Western blot
2.6 免疫组化染色结果
对照组、过敏性猝死组及假手术组BNP左心室前壁心肌免疫组化染色均为阴性。心肌缺血组缺血0.5,1,2 h时BNP免疫组化染色阴性,缺血区心肌细胞胞浆内无或仅有极少量棕黄色颗粒(见图4),染色评分与对照组相比染色差异无统计学意义(P>0.05,见图5);缺血4,8,12 h缺血区少部分心肌细胞BNP免疫组化染色胞浆内出现淡棕黄色颗粒(见图4),染色评分高于对照组(P<0.01,见图5);缺血24 h缺血区大部分心肌细胞BNP免疫组化染色胞浆内出现强棕黄色颗粒(见图4),染色评分高于对照组(P<0.01,见图5);缺血48 h组,BNP免疫组化染色阳性减弱,但仍有部分心肌细胞胞浆内出现淡黄色颗粒(见图4),染色评分低于缺血12 h和24 h(P<0.01,见图5),但高于对照组(P<0.01,见图5)。

A.对照组;B.心肌缺血0.5 h组;C.心肌缺血4 h组;D.心肌缺血12 h组;E.心肌缺血24 h组;F.心肌缺血24 h组图4 SD大鼠左心室前壁心肌BNP免疫组化染色 (×200)Figure 4 The immunohistochemical staining of BNP in left ventricular anterior wall myocardium (×200)

与对照组比较,*P<0.05,**P<0.01;与缺血24 h组比较,##P<0.01图5 实验各组左心室前壁心肌组织BNP免疫组化染色评分Figure 5 The score of BNP immunohistochemical staining in left ventricular anterior wall myocardium in different groups
3 讨论
冠状动脉性猝死是心脏性猝死的一种,多发生在冠状动脉粥样硬化的基础上,由于冠状动脉粥样硬化并发血栓形成、斑块内出血等导致冠状动脉严重狭窄引起急性心肌缺血或相对供血不足,局部心肌电生理紊乱,最终引起心室纤颤等严重心律失常而死亡。可发生于某种诱因如劳累、情绪激动、饮酒和体力活动后。其发生属于早期心肌缺血,病理学上缺乏缺血的组织形态学改变,所以是法医病理学诊断的难点,尤其与过敏性猝死的鉴别更是难上加难,探寻形态学之外的客观诊断依据是法医病理学新的研究方向。
BNP于1988年首次从猪脑组织中提取得来[7]。后来逐渐证实人心室肌细胞是其主要来源,是心室在应对张力增大时分泌的一种心源性激素,在临床医学中具有重要价值,检测血BNP浓度可以帮助诊断充血性心力衰竭[8]。除了在心衰的诊断中有决定性作用外,逐渐有研究发现BNP在急性心梗时也存在表达变化[9]。作为主要由心室肌细胞分泌的蛋白,高通量研究发现BNP在早期心肌缺血中也有表达变化[3],但是并没有进一步通过其他实验手段进行验证。本研究主要观察、验证早期心肌缺血时BNP mRNA及蛋白表达是否存在变化,能否为冠状动脉性猝死与过敏性猝死的鉴别提供依据。
结果显示,大鼠左心室前壁心肌在缺血2 h时,缺血区心肌BNP mRNA表达开始升高,此后一段时间内随缺血时间延长,BNP mRNA表达量逐渐上升,并于缺血24 h时达到峰值,缺血48 h时缺血区心肌BNP mRNA表达量下降,但仍高于对照组。Western印迹法证实缺血4 h时BNP蛋白表达增高,之后随缺血时间延长,表达持续升高,并于缺血12 h、24 h时达到峰值,48 h时光密度值出现下降。免疫组化染色显示,缺血4 h时缺血区少量心肌细胞出现阳性,之后阳性逐渐增强,缺血24 h时出现强阳性,缺血48 h时阳性减弱,但仍有部分心肌细胞胞浆内出现淡黄色颗粒。以上结果证实急性心肌缺血时,心肌组织BNP mRNA及蛋白表达增高,呈现序贯性变化趋势,随缺血时间延长表达逐渐上升,达到峰值后平台维持一段时间,之后缓慢下降。与充血性心衰时心室壁张力变化刺激心室肌细胞分泌BNP不同,有研究[10]表明心肌缺血能够直接促进心肌细胞转录、合成BNP蛋白。对体外培养心肌细胞进行的一项缺血研究[11]发现,缺血缺氧刺激能够上调心肌细胞内TGF-β1/Smad2信号通路,通过增加炎症性细胞因子IL-6的表达来上调BNP蛋白的转录与合成。这可能是心肌缺血导致心室肌细胞分泌BNP的机制。本实验观察到大鼠心肌缺血48 h时,缺血区心肌BNP mRNA及蛋白表达下降,分析可能是由于当心肌缺血48 h时,心肌细胞已经出现坏死,结构已经破坏、功能已经丧失,因此BNP表达水平开始下降。在法医学实践中,当出现明显心肌缺血的组织学改变时,可以不依赖分子改变,而通过光镜下观察形态作出心肌缺血的诊断。
本实验观察到过敏性猝死大鼠左心室前壁心肌BNP mRNA及蛋白表达无变化,这可能是由于过敏性猝死不存在引起心肌缺血的机制。
本实验证实在心肌缺血早期,心肌组织BNP mRNA及蛋白表达增高,而过敏性猝死并不存在这一现象。检测心肌BNP mRNA及蛋白表达有助于鉴别冠状动脉性猝死与过敏性猝死。理论层面,BNP mRNA增高的时间点更早,对早期心肌缺血更为敏感。但是在法医学实践中,考虑到尸体保存条件及死后降解等因素的影响,检测蛋白mRNA并不是最佳方法,还有必要寻找更敏感、更稳定的指标。

