绿原酸与Ⅲ型细菌素复配对鸡肉中假单胞菌的抑菌机制
王虹懿 唐敏敏 吴海虹 诸永志 刘芳 孙芝兰 徐为民 彭景

摘 要:荧光假单胞菌是引起冷鲜鸡肉腐败变质的优势腐败菌,可降解肉品中的蛋白质、脂肪等物质,产生多种腐败代谢产物,进而使肉类食品风味和品质发生劣变。采用体外抑菌实验研究绿原酸(chlorogenic acid,CA)、Ⅲ型细菌素Helveticin-M及二者复配对荧光假单胞菌的抑菌效果;通过扫描电子显微镜观察不同处理对荧光假单胞菌外部形态结构的影响,通过激光共聚焦显微镜观察、测定胞外ATP含量、胞外蛋白和核酸外渗,研究CA或Helveticin-M对指示菌细胞膜渗透性的影响。结果表明:与CA或Helveticin-M单独作用相比,二者复配后抑菌作用显著增强(P<0.05);绿原酸与Helveticin-M复配处理可显著破坏荧光假单胞菌形态,增强细胞膜渗透性,加剧胞内物质外泄,最终加速荧光假单胞菌死亡。
关键词:绿原酸;Ⅲ型细菌素Helveticin-M;荧光假单胞菌;抑菌机制
Abstract: Pseudomonas fluorescein is the dominant spoilage bacterium in chilled fresh chicken, which can degrade protein, fat and other substances in meat, producing a variety of spoilage metabolites, which deteriorate the flavor and quality of meat. The objective of this study was to explore the antimicrobial effect of Helveticin-M, a class Ⅲ bacteriocin and/or chlorogenic acid (CA) against Pseudomonas fluorescens by in vitro experiments. The morphological structure of Pseudomonas fluorescens was observed by a scanning electron microscope (SEM). To evaluate the effect of Helveticin-M and CA on the cell membrane permeability of the indicator strain, confocal laser scanning micrographs (CLSM) were recorded and extracellular ATP and protein contents as well as leakage of ultraviolet absorbing substances were measured. The results showed that the combined antibacterial effect of Helveticin-M and CA was markedly increased compared with either agent alone (P < 0.05). Furthermore, the combined treatment significantly damaged the morphology of Pseudomonas fluorescens, increased the membrane permeability, promoted the leakage of intracellular substances, and finally accelerated cell death.
Keywords: chlorogenic acid; Helveticin-M (a class Ⅲ bacteriocin); Pseudomonas fluorescens; antimicrobial mechanism
DOI:10.7506/rlyj1001-8123-20191009-235
中图分类号:TS201.3 文獻标志码:A 文章编号:1001-8123(2020)02-0001-06
引文格式:
王虹懿, 唐敏敏, 吴海虹, 等. 绿原酸与Ⅲ型细菌素复配对鸡肉中假单胞菌的抑菌机制[J]. 肉类研究, 2020, 34(2): 1-6. DOI:10.7506/rlyj1001-8123-20191009-235. http://www.rlyj.net.cn
WANG Hongyi, TANG Minmin, WU Haihong, et al. Antibacterial effect and mechanism of chlorogenic acid combined with class Ⅲ bacteriocin on Pseudomonas fluorescens in chicken[J]. Meat Research, 2020, 34(2): 1-6. DOI:10.7506/rlyj1001-8123-20191009-235. http://www.rlyj.net.cn
鸡肉是人类日常膳食中优质蛋白质的主要来源之一,营养十分丰富,但其高营养成分和高水分活度使其在加工、运输、贮藏、销售等过程中极易腐败变质,品质迅速下降,影响其营养和风味[1]。而致腐微生物的生长是引起肉品腐败变质最重要的原因,其中假单胞菌通常被鉴定为肉类优势腐败菌之一,假单胞菌在冷鲜肉中的生长速率比其他细菌快1/3左右[2-3]。荧光假单胞菌(Pseudomonas fluorescens)为假单胞菌属嗜冷革兰氏阴性菌,能够在低温环境下生长繁殖,是引起低温贮藏条件下高蛋白和高脂肪食品腐败变质的优势腐败菌群[4-5]。此外,研究发现,荧光假单胞菌可形成对抑菌剂耐受性更强的生物膜结构[6],大大增加了肉品保存难度。然而,近年来化学抗菌剂的滥用导致众多食品安全事件,引起更多重视,因此开发研究新型天然防腐剂显得尤为重要。
目前已从中草药、果蔬、野生植物中分离出具有抗氧化活性、抑菌或杀菌活性的天然植物源防腐剂,如广泛存在于草本植物中的多酚类物质,其酚氧化程度越高,对微生物的抑制作用越强[7-8],将其应用在肉制品贮藏与保鲜中有延长肉品保质期的作用。绿原酸(chlorogenic acid,CA)是主要从杜仲科植物中提取出来的多酚类化合物[9],是具有生物抑菌活性的天然植物源抑菌剂[10]。研究发现,CA对铜绿假单胞菌[11]、大肠杆菌[12]、金黄色葡萄球菌[13-14]等均具有良好的抑制作用。
本课题组前期通过异源表达及提取纯化方法獲得高纯度的Ⅲ型细菌素Helveticin-M,并分析了该细菌素的抗菌活性和作用机理,但是Helveticin-M仍存在抑菌活性较低的问题。研究表明,将2 种抗菌性能互补的抗菌物质联合使用时二者的抗菌活性可显著增强[15]。例如,将聚赖氨酸与乳酸链球菌素在酸性条件下协同使用不仅降低了单独使用量,而且能够更加高效地抑制腐败菌生长[16]。
本研究将CA和Helveticin-M复配使用,对二者抑制
P. fluorescens的效果及协同抑菌机理进行深入研究,为CA联合Helveticin-M应用于P. fluorescens的控制提供参考。
1 材料与方法
1.1 材料与试剂
细菌素Helveticin-M 本课题组前期从大肠杆菌中表达分离纯化;供试菌株(P. fluorescens) 本课题组自主从冷鲜鸡肉中分离筛选得到;CA(杜仲提取物,纯度98%) 陕西慧科植物开发有限公司;LIVE/DEADTM BacLightTM荧光染色试剂盒 美国Invitrogen公司;增强型ATP检测试剂盒、Bradford蛋白浓度测定试剂盒碧云天生物技术公司。
1.2 仪器与设备
JY5002电子天平 上海良平仪器仪表有限公司;UniCenMR台式高速冷冻离心机 德国Herolab公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SPX-250B-Z生化培养箱 上海博讯实业有限公司医疗设备厂;Gen5全波长酶标仪 美国伯腾仪器有限公司;Ultra View VOX激光扫描共聚焦显微镜 美国珀金埃尔默公司;EVO-LS10扫描电子显微镜 德国Carl Zeiss公司;SW-CJ-1FD无菌操作台 苏州净化设备有限公司。
1.3 方法
1.3.1 细菌素Helveticin-M的克隆表达与纯化参照文献[17]。
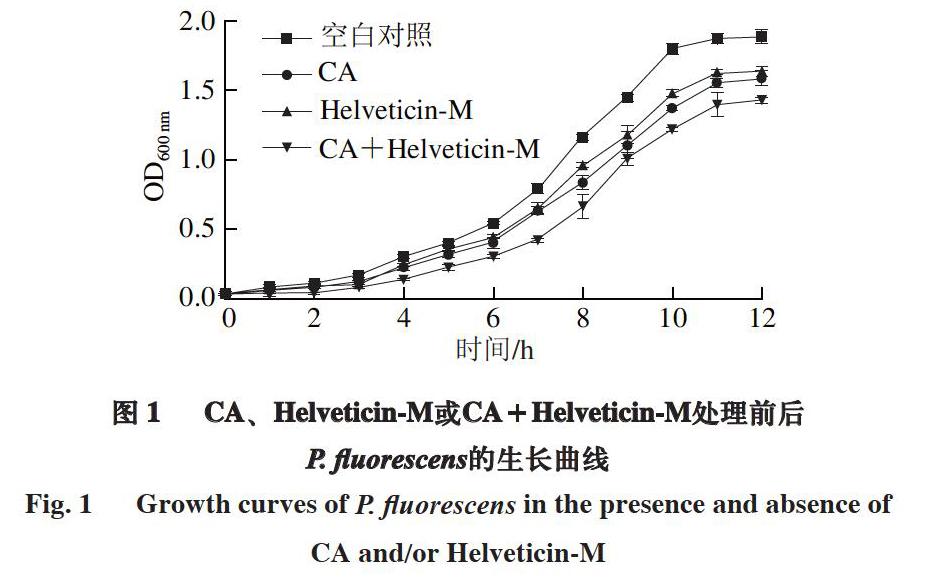
1.3.2 细菌生长情况测定
将过夜活化2 次的P. fluorescens以体积比2%的接种量接入LB培养基中,分别添加终质量浓度为2.5 mg/mL的CA、200 μg/mL Helveticin-M以及二者的混合物
(2.5 mg/mL CA+200 μg/mL Helveticin-M),添加相同体积的0.01 mmol/L PBS作为空白对照组,置于30 ℃、200 r/min摇床培养。每隔1 h测定600 nm波长处光密度(optical density,OD600 nm),绘制生长曲线,分析P. fluorescens经不同处理后的生长情况。
1.3.3 CA与Helveticin-M对细菌细胞形态的影响
采用扫描电镜法观察P. fluorescens经不同处理后细胞外部形态的变化。将过夜活化2 次的P. fluorescens以接种量2%接入LB培养基中,收集对数生长期的菌液,8 000 r/min离心10 min,用PBS洗涤重悬,制成107 CFU/mL的菌悬液;将菌悬液分装,分别加入终质量浓度为2.5 mg/mL的CA、200 μg/mL的Helveticin-M及二者复配溶液,加入相同体积PBS为空白对照,于30 ℃、200 r/min处理3 h后,6 000 r/min离心10 min,用PBS冲洗后在体积分数2.5%戊二醛溶液中固定,2 500 r/min、4 ℃离心10 min,加入1 mL超纯水,放置10 min后再次离心,重复3 次,将样品分别用体积分数50%、70%、80%、90%的乙醇溶液按顺序依次洗脱,每次放置15 min,离心,加入100%乙醇后放置30 min,最后将菌泥固定于镜片上,在通风橱中风干、喷金后在扫描电子显微镜下观察菌体形态变化[18-20]。
1.3.4 CA与Helveticin-M对细菌细胞膜渗透性的影响
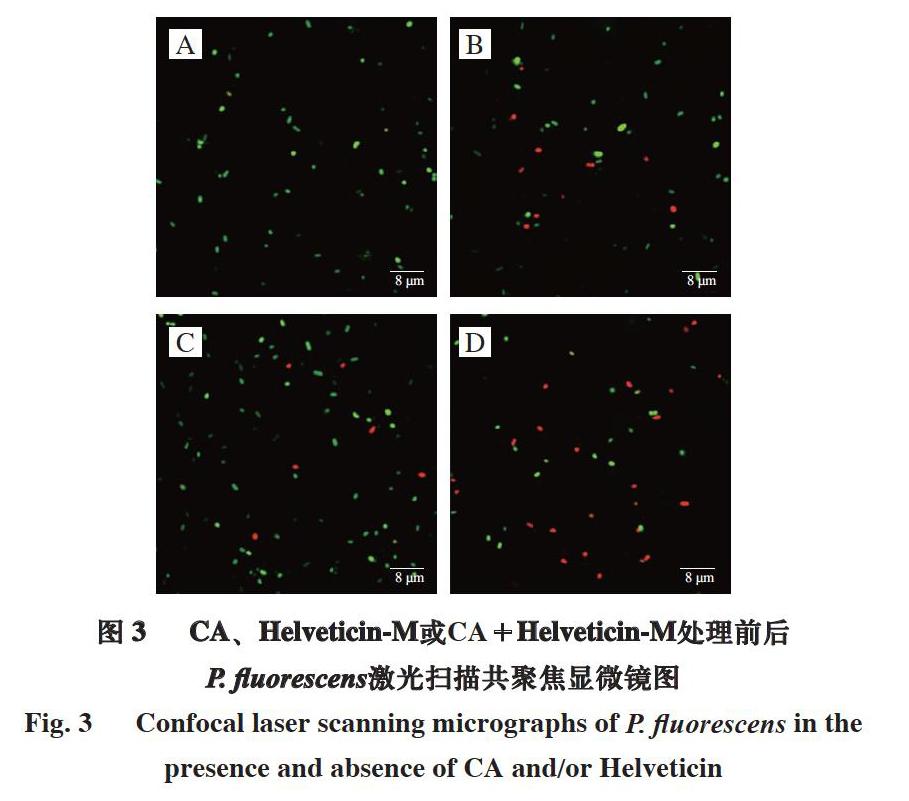
1.3.4.1 激光共聚焦显微镜观察
利用LIVE/DEAD试剂盒中的碘化丙啶(propidium iodide,PI)染料和SYTO-9染料进行活/死菌标记。按照1.3.3节中的方法制备菌悬液,并分组处理3 h。分别取菌悬液100 μL于10 000 r/min离心2 min,重悬在100 μL PBS中,加入LIVE/DEAD BacLightTM试剂盒中的荧光染料各3 μL进行染色,37 ℃黑暗条件下孵育30 min后离心,用PBS冲洗3 次,最终用200 μL PBS重悬菌体;吸取2 μL菌悬液于载玻片,观察并拍照[21]。
1.3.4.2 胞外ATP含量测定
取1.3.4.1节所述处理后的菌悬液于30 ℃、200 r/min摇床培养0、30、60、90、120、180 min后12 000 r/min离心,取上清液置于冰上待用。采用荧光标记法,具体操作步骤参照增强型ATP检测试剂盒说明书,用酶标仪通过检测荧光值确定ATP含量。
1.3.4.3 胞外蛋白质量浓度及核酸水平测定
收集对数生长期的P. fluorescens菌体沉淀,用5 mL PBS洗涤3 次,最后用5 mL PBS重悬制成菌悬液,将菌悬液分装为4 份,分别加入终质量浓度为2.5 mg/mL的CA、200 μg/mL的Helveticin-M和二者复配溶液,添加相同体积的PBS作为空白对照,30 ℃、200 r/min培养,分别于0、2、4、6、8、12 h取样,菌悬液8 000 r/min离心10 min,上清液用0.22 μm滤膜过滤,用考马斯亮蓝法通过检测595 nm波长处的吸光度对样品蛋白质质量浓度进行测定(添加Helveticin-M的样品需设置空白对照扣除蛋白质本底)[22]。核酸在260 nm波长处有较强的吸收值,因此通过测定260 nm波长处的吸光度(A260 nm)来推测胞外核酸水平的变化[23]。
3 结 论
为探究CA与Helveticin-M复配作用后对P. fluorescens的抑菌效果及损伤机理,研究不同处理对P. fluorescens生长情况、细胞形态和细胞膜渗透性的影响。结果表明:与CA或Helveticin-M各自单独作用相比,CA和Helveticin-M复配处理对P. fluorescens的抑菌效果最为显著,通过扫描电镜观察发现,P. fluorescens菌体形态受损最为严重,胞体扭曲凹陷甚至瓦解;由于CA与Helveticin-M互补作用于菌体细胞膜,细胞膜完整性遭到破坏,进一步增强了细胞膜的渗透性,加剧诱导胞内ATP、蛋白质和核酸物质的外泄,随着胞内物质释放,菌体细胞逐渐裂解,最终抑制P. fluorescens的正常生长代谢。
本研究采用抑菌剂复配作用于P. fluorescens,既降低了抑菌剂的最低有效剂量,又显著增强了抑菌效果,为天然防腐剂在肉品保鲜贮藏中的应用提供了理论支撑。目前,已有许多研究表明,不同抑菌物质联合作用时抗菌活性显著增强,但其抑菌机制尚未明了。本研究初步闡明CA与Helveticin-M对P. fluorescens的作用机制,但研究局限于纯菌条件下的影响,未来的研究期望能够进一步详细研究其对革兰氏阳性菌与革兰氏阴性菌的作用机制,扩大其在食品中的应用范围。
参考文献:
[1] ANANG D M, RUSUL G, BAKAR J, et al. Effects of lactic acid and lauricidin on the survival of Listeria monocytogenes, Salmonella enteritidis and Escherichia coli O157:H7 in chicken breast stored at 4 ℃[J]. Food Control, 2007, 18(8): 961-969. DOI:10.1016/j.foodcont.2006.05.015.
[2] KIM J S. The inhibitory effect of natural bioactives on the growth of pathogenic bacteria[J]. Nutrition Research and Practice, 2007, 1(4): 273-278. DOI:10.4162/nrp.2007.1.4.273.
[3] 章彬. 冷鲜鸡加工及贮藏过程中的微生物调查及气调保鲜技术应用研究[D]. 扬州: 扬州大学, 2017: 1-3.
[4] OLANYA O M, UKUKU D O, NIEMIRA B A. Effects of temperatures and storage time on resting populations of Escherichia coli O157:H7 and Pseudomonas fluorescens in vitro[J]. Food Control, 2014, 39(1): 128-134. DOI:10.1016/j.foodcont.2013.11.006.
[5] 张秋勤. 生鲜鸡肉中腐败菌群体感应信号分子研究[D]. 南京: 南京农业大学, 2014: 1-2.
[6] 孙晓佳, 李婷婷, 赫彬彬, 等. 富马酸钠对荧光假单胞菌群体感应现象及其腐败活性的抑制作用[J]. 食品科学, 2019, 40(11): 7-13. DOI:10.7506/spkx1002-6630-20180510-163.
[7] 张海玲. 植物源天然防腐剂来源及其抗菌物质基础[J]. 安徽农业科学, 2017, 45(33): 76-78; 80. DOI:10.13989/j.cnki.0517-6611.2017.33.025.
[8] SCALBERT A. Antimicrobial properties of tannins[J]. Phytochemistry, 1991, 30(12): 3875-3883. DOI:10.1016/0031-9422(91)83426-l.
[9] LOU Zaixiang, WANG Hongxin, ZHU Song, et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. Journal of Food Science, 2011, 76(6): M398-M403. DOI:10.1111/j.1750-3841.2011.02213.x.
[10] SUN Zhilan, WANG Xiaomeng, ZHANG Xinxiao, et al. Class III bacteriocin Helveticin-M causes sublethal damage on target cells through impairment of cell wall and membrane[J]. Journal of Industrial Microbiology and Biotechnology, 2018, 45(3): 213-227. DOI:10.1007/s10295-018-2008-6.
[11] 苏萌萌, 孙芝兰, 刘芳, 等. 绿原酸对鸡肉腐败菌的抑菌机理[J]. 江苏农业学报, 2018, 34(6): 1386-1391. DOI:10.3969/j.issn.1000-4440.2018.06.026.
[12] 屈景年, 莫运春, 刘梦琴, 等. 金银花中绿原酸一步提取法及绿原酸抗菌活性[J]. 化学世界, 2005, 46(3): 167-169. DOI:10.19500/j.cnki.0367-6358.2005.03.012.
[13] GOULAS V, EXARCHOU V, KANETIS L, et al. Evaluation of the phytochemical content, antioxidant activity and antimicrobial properties of mountain tea (Sideritis syriaca) decoction[J]. Journal of Functional Foods, 2014, 6: 248-258. DOI:10.1016/j.jff.2013.10.014.
[14] 伊文君. 杜仲叶提取物中绿原酸的纯化及其体外抑菌效果的研究[D]. 大庆: 黑龙江八一农垦大学, 2014: 29-33.
[15] 刘唤明, 张文滔, 吴燕燕, 等. 脂肽和茶多酚对副溶血弧菌的协同抑菌效应和机理[J]. 食品科学, 2017, 38(13): 14-19. DOI:10.7506/spkx1002-6630-201713003.
[16] BADAOUI N M, KASHTANOV D, CHIKINDAS M L. Epsilon-poly-L-lysine and nisin A act synergistically against Gram-positive food-borne pathogens Bacillus cereus and Listeria monocytogenes[J]. Letters Applied Microbiology, 2007, 45(1): 13-18. DOI:10.1111/j.1472-765X.2007.02157.x.
[17] 王筱梦. 细菌素Helveticin-M对熟制羊肉腐败菌的抑菌作用及其机理研究[D]. 南京: 南京师范大学, 2017: 27-33.
[18] LOU Miaomiao, ZHU Bo, MUHAMMAD I, et al. Antibacterial activity and mechanism of action of chitosan solutions against apricot fruit rot pathogen Burkholderia seminalis[J]. Carbohydrate Research, 2011, 346(11): 1294-1301. DOI:10.1016/j.carres.2011.04.042.
[19] LI Yingqiu, HAN Qing, FENG Jianling, et al. Antibacterial characteristics and mechanisms of ?-poly-lysine against Escherichia coli and Staphylococcus aureus[J]. Food Control, 2014, 43: 22-27. DOI:10.1016/j.foodcont.2014.02.023.
[20] 李光輝, 郭卫芸, 高雪丽, 等. 安石榴苷和绿原酸对金黄色葡萄球菌的协同抑制作用及机理研究[J]. 食品工业科技, 2018, 39(10): 17-21. DOI:10.13386/j.issn1002-0306.2018.10.004.
[21] 刘梅. Nisin与聚赖氨酸协同对腐败菌的抑制效果及在鸡胸肉中的应用[D]. 哈尔滨: 东北农业大学, 2016: 12-13.
[22] 张志涛, 刘金生, 许强, 等. Bradford法测定牛奶中蛋白质含量[J]. 食品与机械, 2011, 27(5): 128-130. DOI:10.3969/j.issn.1003-5788.2011.05.033.
[23] 李世超, 方华, 朱校适. 嗜酸乳杆菌产细菌素的生物学特性及抑菌机制研究[J]. 饲料研究, 2017(11): 20-26. DOI:10.13557/j.cnki.issn1002-2813.2017.11.007.
[24] TAO Rui, TONG Zhongchun, LIN Yuan, et al. Antimicrobial and antibiofilm activity of pleurocidin against cariogenic microorganisms[J]. Peptides, 2011, 32(8): 1748-1754. DOI:10.1016/j.peptides.2011.06.008.
[25] QIAN Liying, XIAO Huining, ZHAO Guanlei, et al. Synthesis of modified guanidine-based polymers and their antimicrobial activities revealed by AFM and CLSM[J]. ACS Applied Materials and Interfaces, 2011, 3(6): 1895-1901. DOI:10.1021/am200094u.
[26] 杜贺超, 李秀秀, 陆兆新, 等. Plantaricin 163对热杀索丝菌的抗菌活性及其作用机制[J]. 微生物学通报, 2018, 45(11): 136-145. DOI:10.13344/j.microbiol.china.171049.
[27] 刘国荣, 李雪, 王成涛. 双歧杆菌细菌素bifidocin A对大肠杆菌细胞总蛋白表达的影响[J]. 食品科学, 2018, 39(14): 85-90. DOI:10.7506/spkx1002-6630-201814013.
[28] WANG Yao, QIN Yuxuan, ZHANG Ying, et al. Antibacterial mechanism of plantaricin LPL-1, a novel class IIa bacteriocin against Listeria monocytogenes[J]. Food Control, 2019, 97: 87-93. DOI:10.1016/j.foodcont.2018.10.025.
[29] BENDALI F, GAILLARD-MARTINIE B, HEBRAUD M, et al. Kinetic of production and mode of action of the Lactobacillus paracasei subsp. paracasei anti-listerial bacteriocin, an Algerian isolate[J]. LWT-Food Science and Technology, 2008, 41(10): 1784-1792. DOI:10.1016/j.lwt.2008.02.010.
[30] TEETHAISONG Y, AUTARKOOL N, SIRICHAIWETCHAKOON K,
et al. Synergistic activity and mechanism of action of Stephania suberosa Forman extract and ampicillin combination against ampicillin-resistant Staphylococcus aureus[J]. Journal of Biomedical Science, 2014, 21(1): 90. DOI:10.1186/s12929-014-0090-2.

