维生素D治疗小鼠肺烟曲霉感染的机制研究
付启云,戴京京,周武碧,郑绍同
(南京医科大学附属淮安第一医院 1.检验科,2.病理科,江苏 淮安 223300)
烟曲霉是一种机会性致病真菌,当患者免疫功能低下,如白血病、实体器官移植等,可导致侵袭性曲霉病[1-3]。随着抗菌药物的大量使用,感染烟曲霉的病例数呈增加趋势,如何有效地控制烟曲霉感染,已成为临床一大难题[2]。目前有研究揭示炎症因子在烟曲霉对肺组织的损伤中扮演重要角色[4],也有研究显示,维生素D(Vitamin D,VitD)的血清含量与感染性疾病患者的预后有关,研究发现VitD 具有调控机体免疫的功能[5],传统认为VitD 具有增强骨质的作用,而其对机体免疫调控的影响研究甚少。因此,本实验通过检测VitD 充足和缺乏的小鼠感染烟曲霉孢子后的肺部真菌负荷、炎症因子水平及细胞感染后相关蛋白的表达,探究VitD 治疗小鼠烟曲霉肺部感染的机制,为临床治疗提供参考。
1 材料与方法
1.1 实验动物
30只BALB/c 小鼠(SPF 级),由安徽理工大学馈赠。小鼠4周龄,体重20~22 g。
1.2 材料与试剂
DMEM-H 基础培养基、胎牛血清(美国Gibco 公司),辣根过氧化物酶(HRP)标记的羊抗兔IgG、DAB染液、ECL 发光液、兔抗鼠IL-8、NF-κB(p50/p65)、IL-1β、IL-6 和TNF-α 单克隆抗体及IL-1β、IL-6和TNF-α、ELISA 检测试剂盒(英国Abcam 公司),VitD(上海依赫生物科技有限公司),沙保罗氏固体琼脂(河南安图公司),Trizol 提取液、蛋白裂解液、胶回收试剂盒、IPTG、DNA 标准参照物(日本TaKaRa公司),PVDF 膜(美国Bio-Rad 公司),Ni2~-NTA(德国Qiagen 公司),病理染色液(HE)(珠海贝索公司),烟曲霉菌株、PBST 基液、BSA、脱脂奶粉等本实验室保存配制。
1.3 仪器与设备
低温离心机(德国Eppendorf 公司),普通和荧光显微镜(日本Olympus 公司),莱卡切片机(上海企伟公司),凝胶成像系统(美国Syngene 公司),电泳仪(南京驰顺公司),超声破碎仪(宁波新芝生物),酶联检测仪(台湾Meter-tech 公司)。
1.4 方法
1.4.1 烟曲霉感染小鼠模型复制 取20只小鼠分成两组,一组喂食含VitD 的饲料,为VitD 充足组(VitD+组),另一组喂食不含VitD 的饲料,为VitD 缺乏组(VitD-组),每组10只,喂养7 d。将低温保存的烟曲霉接种于沙保罗氏固体琼脂上,28℃培养72 h。用含0.1% Tween 20 的PBST 液体清洗烟曲霉菌落并制成孢子悬液,用计数器计数孢子数为1×106个/ml,取悬液30 μl 注射VitD+组和VitD-组小鼠肺部。
1.4.2 烟曲霉感染小鼠肺组织病理形态学观察 随机取两组小鼠各3只,断头处死,解剖,取肺组织,分别经HE、革兰和糖原染色鉴别两组小鼠肺组织真菌载量。
1.4.3 烟曲霉感染小鼠血清和肺组织中炎症因子检测 随机取两组小鼠各3只,摘除眼球处死,采集血清,ELISA 检测小鼠血清中炎症因子IL-1β、IL-6 和TNF-α 的含量;解剖,取肺组织,免疫组织化学法检测IL-1β、IL-6 和TNF-α 的表达[6-8]。余下4只备用最后销毁。
1.4.4 荧光显微镜观察 健康小鼠10只,喂养饲料,7 d 后无菌取其肺组织,用无菌研钵进行研磨,加入5 ml 生理盐水充分混匀;将混匀的液体过100 μm/孔细胞筛,获得小鼠肺巨细胞悬液,调整浓度至1×105个/ml 备用;将分离的小鼠肺巨细胞悬液1.5 ml 与烟曲霉孢子悬液(1×104个/ml)0.5 ml于6孔板中共孵育,3 孔培养基加VitD 0.5 ml(终浓度20 ng/ml),3 孔培养基不加VitD,分别于培养1 和3 h 后荧光显微镜下观察小鼠肺巨噬细胞吞噬烟曲霉孢子变化[6-8]。
1.4.5 RT-PCR 和Western blotting 检测分别收集1.4.4 中共培养后的小鼠肺巨噬细胞,用Trizol 提取总RNA,RT-PCR 扩增IL-8 和NF-κB;收集1.4.4 中共培养后的小鼠肺巨噬细胞并裂解,进行SDS-PAGE电泳,转PVDF 膜并用封闭液4℃封闭过夜,加兔抗鼠IL-8、NF-κB,37℃孵育1 h,PBST 洗3 次,加HRP 标记的羊抗兔IgG,37℃孵育2 h,PBST 洗3 次,ECL 发光液孵育、曝光,Western blotting分析IL-8 和NF-κB 的表达[8]。
1.5 统计学方法
数据分析采用GraphPad Prism 6.0 统计软件,计量 资料以均数±标准差(±s)表示,比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 VitD 对烟曲霉感染小鼠肺组织病理形态学的影响
VitD+组的小鼠肺实变轻、载菌量少,而VitD-组的小鼠肺实变重、载菌量多。HE 染色烟曲霉孢子呈紫红色,革兰染色呈蓝色,糖元染色呈粉红色。见图1。
2.2 VitD 对烟曲霉感染小鼠肺组织和血清中炎症因子表达的影响
免疫组织化学结果显示VitD+组小鼠肺组织颗粒显色少而浅,表明VitD+组肺组织中IL-1β、IL-6 和TNF-α 的表达水平低,而VitD-组小鼠肺组织颗粒显色多而深,表明VitD-组肺组织中IL-1β、IL-6 和 TNF-α 的表达水平高(见图2);两组血清中IL-1β、IL-6 和TNF-α 的含量比较,差异有统计学意义(P< 0.05)。见表1。
2.3 VitD 对肺巨噬细胞吞噬有调控作用
VitD、烟曲霉孢子和健康小鼠巨噬细胞共培养后,VitD+组可调控肺巨噬细胞吞噬烟曲霉孢子在一个合理水平而不易引起细胞自噬性死亡。见图3。
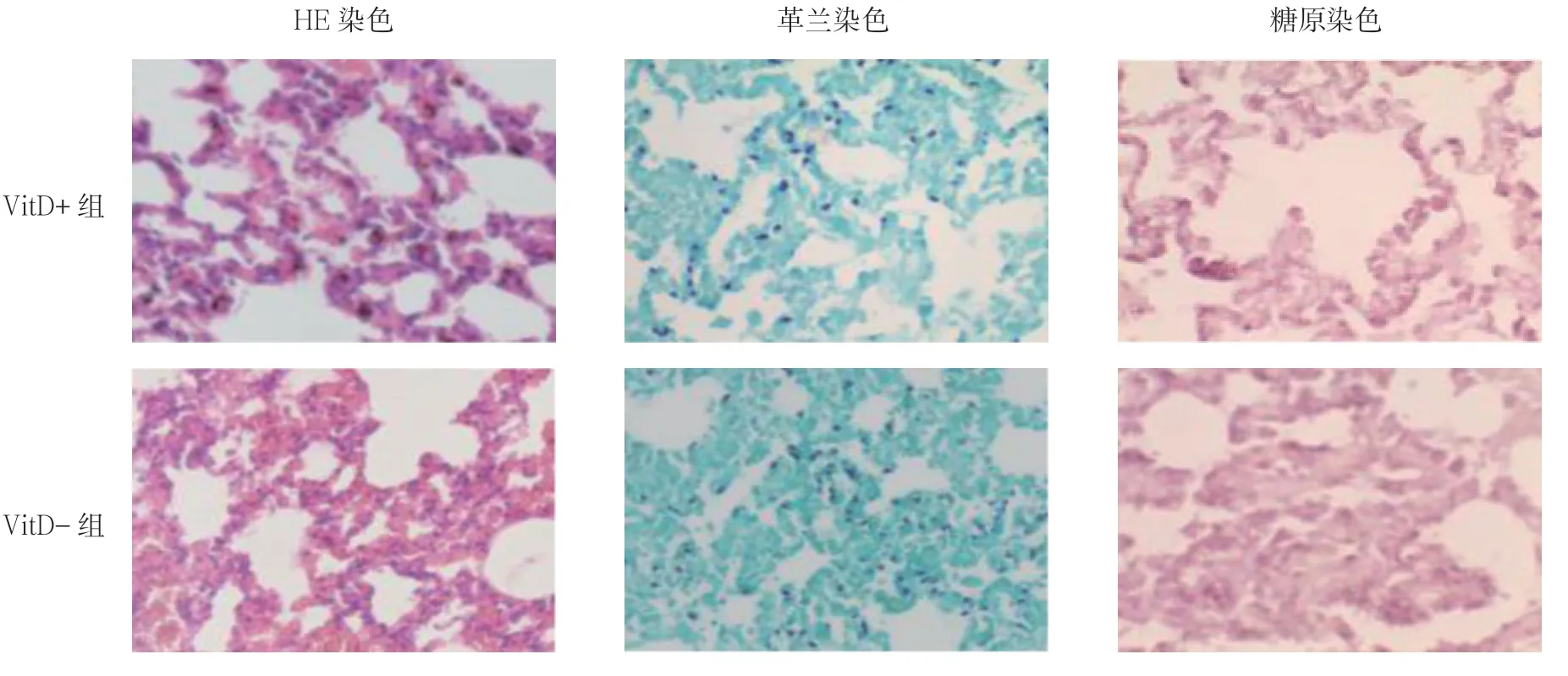
图1 烟曲霉感染小鼠肺组织病理形态(×400)


图2 两组TNF-α、IL-6 和IL-1β 在肺组织中的定位表达(免疫组织化学×100)
2.4 VitD 对烟曲霉感染肺部巨噬细胞炎症相关蛋白IL-8、NF-κB 表达的影响
VitD、烟曲霉和健康小鼠巨噬细胞共培养后,RT-PCR 结果显示,在基因转录水平上,VitD+组肺巨噬细胞IL-8 和NF-κB 的表达水平低;Western blotting 结果显示,在蛋白表达水平上,VitD+组肺巨噬细胞IL-8 和NF-κB 的表达水平低。两组基因转录水平和蛋白表达水平比较,差异有统计学意义(P<0.05)。见图4 和表2、3。
表1 两组小鼠血清IL-1β、IL-6 和TNF-α 含量的比较(n =3,pg/ml,±s)
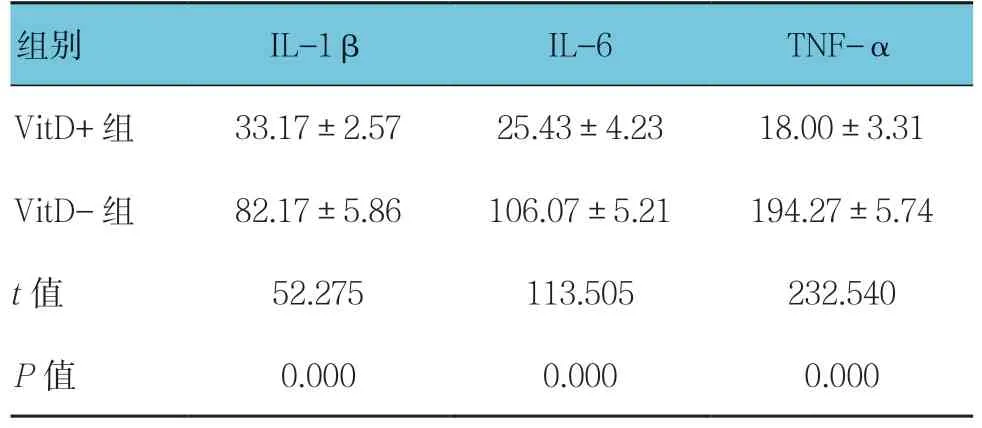
表1 两组小鼠血清IL-1β、IL-6 和TNF-α 含量的比较(n =3,pg/ml,±s)
?
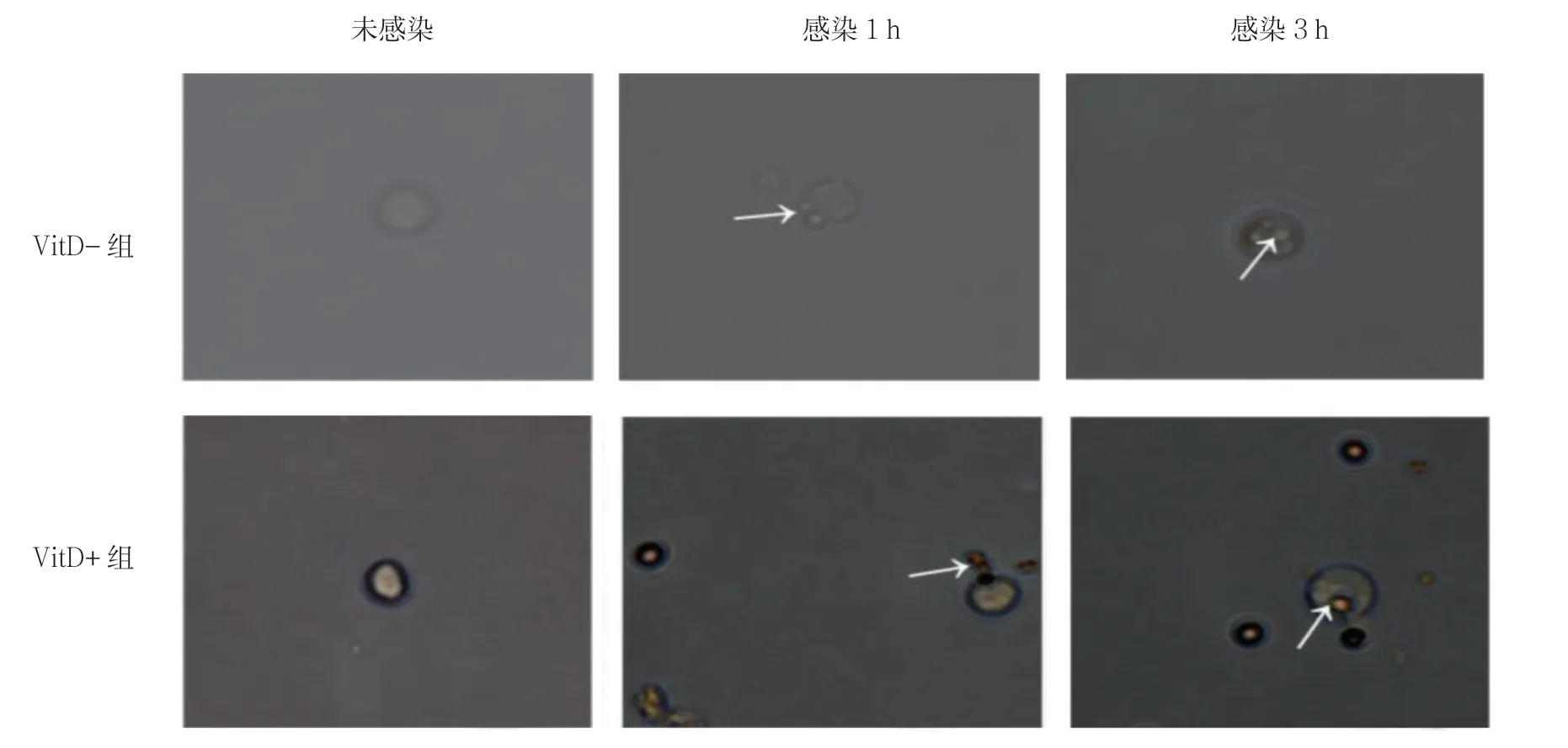
图3 VitD 对肺巨噬细胞吞噬的调控(未染色普通暗视野×800)

图4 VitD 对烟曲霉感染肺巨噬细胞的炎症相关蛋白IL-8、NF-κB 表达的影响
表2 两组小鼠肺巨噬细胞IL-8 和NF-κB(p50/p65)基因转录水平的比较(n =3,pg/ml,±s)
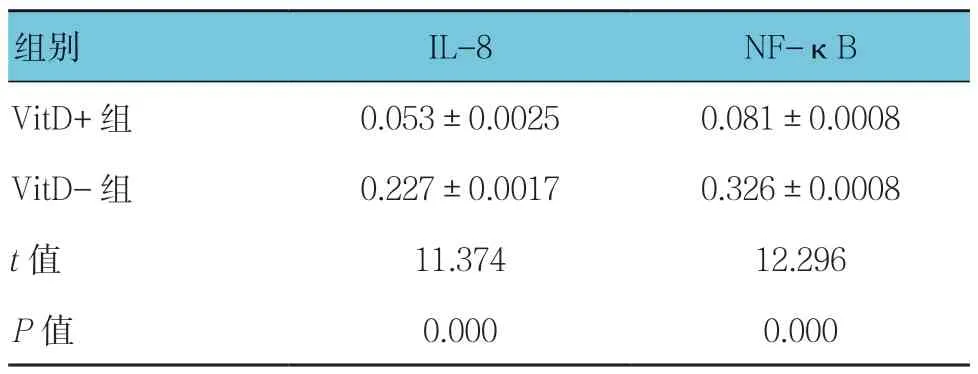
表2 两组小鼠肺巨噬细胞IL-8 和NF-κB(p50/p65)基因转录水平的比较(n =3,pg/ml,±s)
?
表3 两组小鼠肺巨噬细胞IL-8和NF-κB(p50/p65蛋白)蛋白相对表达量的比较(n =3,pg/ml,±s)

表3 两组小鼠肺巨噬细胞IL-8和NF-κB(p50/p65蛋白)蛋白相对表达量的比较(n =3,pg/ml,±s)
?
3 讨论
侵袭性曲霉病是由烟曲霉引起的一种疾病,最近研究显示,炎症因子在烟曲霉对肺的损伤中起重要作用,烟曲霉可诱导炎症因子浸润肺组织,从而诱导肺炎的发生,加重烟曲霉的侵袭损害[4]。曲霉病常导致免疫功能低下的患者死亡,对人类生命构成巨大威胁。目前临床烟曲霉感染率正逐年上升,临床常用药的耐药问题越来越突出[6-8]。且临床常用的抗真菌药,如唑类的氟康唑、酮康唑,丙烯胺类的特比萘芬、萘替芬,多烯类的两性霉素B、制霉菌素等多有耐药及不良反应的存在[9]。而VitD 目前已用于细菌感染的治疗,如果其用于抗烟曲霉感染,不仅减少烟曲霉的耐药,而且可从日常饮食及自身合成、摄取,具有来源广泛及易于获取的优点,不良反应小、价格便宜等特点,具有广泛的应用前景,值得研究推广应用。
本研究烟曲霉感染小鼠肺部后,从小鼠肺组织的载菌量、炎症因子的表达、实变及血清中炎症因子的含量结果可知,VitD+组小鼠比VitD-组小鼠肺部的真菌孢子数少且肺部的实变轻;炎症因子在组织和血清的表达VitD+组低于VitD-组。体外将健康小鼠肺巨噬细胞与烟曲霉孢子共孵育,结果显示,VitD 可调控肺巨噬细胞吞噬烟曲霉孢子在一个合理水平;缺乏VitD 调控,巨噬细胞不断吞噬烟曲霉孢子,易引起巨噬细胞自噬性死亡。结果还显示:VitD+组的巨噬细胞IL-8、NF-κB 基因和蛋白表达水平低于VitD-组。以上结果可以说明,VitD 可通过降低细胞和组织的炎症因子的表达来调控肺巨噬细胞抵抗烟曲霉的感染,从而提高小鼠的生存率和生存质量,为临床治疗提供参考。
本课题基于组织和血清中炎症因子的表达,研究VitD 对细胞感染烟曲霉后的调控作用,特别是对炎症相关蛋白调控的研究,将会帮助临床工作者更加理解VitD 对人体烟曲霉感染性疾病的治疗新作用,为临床提供辅助治疗方法,为临床耐药问题的解决提供一种方法。进一步研究VitD 抵抗真菌感染的机制具有重要意义,其在调控细胞炎症因子抵抗真菌感染方面的作用将日益受到关注。

