肺结核活动性判断规范及临床应用专家共识
国家感染性疾病临床医学研究中心 深圳市第三人民医院 《中国防痨杂志》编辑委员会
结核病是传染性疾病领域死亡人数第一位的疾病。中国肺结核疫情十分严峻,是全球第二大结核病高负担国家,2018年新发肺结核患者82.3万例[1-2]。结核分枝杆菌病原学检查阳性是诊断肺结核的金标准[3],但我国仍有大量病原学阴性的肺结核患者。《“十三五”全国结核病防治规划》[4]指出,到2020年,我国肺结核患者病原学阳性率要达到50%以上,这意味着即使在2020年完成了国家规划指标的情况下,仍可能有接近50%的病原学阴性肺结核患者。活动性判断作为肺结核诊疗工作中不可或缺的环节,主要解决肺结核“治不治疗”和“停不停药”的问题。对病原学阳性肺结核进行活动性判断相对容易,但对病原学阴性肺结核则需要结合临床表现、治疗史和影像学等多种手段,才能做出最终判断[5-7]。
背 景
一直以来,我国尚未建立肺结核活动性判断的科学评价体系,肺结核过诊过治和漏诊漏治的现象时有发生,影响了医疗质量,加重了医疗负担。
影像学在肺结核活动性判断中发挥着重要作用[8-10],但需要指出的是“影像学稳定”不能等同于“非活动性”或“陈旧性”[5]。特别是当患者具有典型的结核中毒症状,或并发艾滋病、糖尿病,以及存在耐药、治疗不规律和血药浓度不达标等因素时,虽然影像学判读为“稳定”或“陈旧”,但病变内的结核分枝杆菌仍可能处于复制状态[11]。片面依靠影像学诊断会导致一部分活动性肺结核患者失去早期治疗的机会,这反映了影像学评价的局限性,因此需要对影像学诊断标准进行规范[12]。胸部X线摄影(简称“胸片”)由于对微小病灶和隐蔽部位的病变检出率较低,在肺结核活动性判断上存在不足,近年来已经逐渐被胸部CT(computed tomography)所取代[13]。胸部CT具有较高的密度分辨率和空间分辨率,在肺结核活动性判断方面具有较为突出的作用[14]。有研究表明,约80%的活动性肺结核、89%的非活动性肺结核病变可由CT检查正确区别[15],但也有不足之处。近年来,基于肺结核征象演变与治疗随访研究的深入开展,以及影像学技术的普及应用[包括高分辨率CT(HRCT)、CT增强技术、MRI等],肺结核活动性判断的准确性得以大幅度提高。
另一方面,临床评价对于肺结核的活动性判断亦至关重要,判断依据包括临床表现、治疗史和实验室检查等。截至目前,在肺结核活动性判断方面还没有高效的生物标志物问世。γ-干扰素释放试验(interferon-γ release assays,IGRAs)和血清结核抗体检测不能直接用于肺结核活动性判断[16]。近年来,基于气管镜技术的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)联合分子生物学检测、肺组织活检,以及超声内镜引导下的经支气管针吸活检(endobronchial ultrasound-transbronchial needle aspitation,EBUS-TBNA)等,为肺结核活动性判断提供了精准的技术保证[17]。
综上,建立肺结核活动性判断的临床综合评价体系变成可行之事、当务之急。基于此,由国家感染性疾病临床医学研究中心、深圳市第三人民医院与《中国防痨杂志》编委会牵头组织国内结核病科、影像科、综合医疗机构相关学科和结核病防治领域等有经验的专家,依据临床经验和循证医学证据撰写了《肺结核活动性判断规范及临床应用专家共识》(以下简称“《共识》”)。考虑到《共识》的普遍适用性,同时邀请了综合医疗机构的关联学科专家及基层结核病防治机构的医生共同参与讨论与撰写过程。
活动性判断的对象
一、肺结核患者治疗前需要进行活动性评价
对于初诊,且仅有近期临床和影像学资料的肺结核患者,需进行活动性评价以决定是否进行抗结核治疗。病原学阳性肺结核可直接判断为活动性肺结核[3],病原学检测阴性肺结核则需要进一步进行活动性评价。
二、肺结核患者疗程结束时需要进行活动性评价
肺结核患者在疗程结束时,需要进行活动性评价以决定是否终止治疗。活动性评价需基于以下信息:(1)患者的临床症状是否改善、有无并发症及其治疗情况等;(2)在疗程结束前连续2个月痰菌检查阴性[18],获得连续的病原学检查阴性证据;(3)治疗第2个月末、第5个月末和疗程结束时分别进行3次影像学检查(胸片或CT检查,以CT检查为佳),这些序贯性资料是活动性判断的重要依据。
肺结核活动性评价方法
一、临床症状评价
1.初诊患者:出现临床症状是患者就诊的常见原因,可将其作为判断肺结核活动性的依据之一。咳嗽、咳痰≥2周,可合并有痰中带血或咯血;出现全身结核中毒症状,如盗汗、乏力、间断或持续午后低热,以及食欲不振、体质量减轻等,以上症状往往提示肺结核具有活动性[19]。部分患者可无症状而在体检时发现肺部病变[20],需要结合影像学及相关检查进行肺结核诊断及活动性判断。
2.疗程结束的患者:多数患者症状消失,细菌学检查阴转,影像学表现为肺部病灶持续稳定。少数患者由于肺部不可逆的组织损伤或并发其他肺部疾病,即便存在咳嗽、咳痰、喘息、咯血等症状,亦不能将其作为活动性肺结核的判断依据,需仔细甄别。
二、治疗史评价
1.疗程结束的患者:需要系统地进行治疗史评价,包括抗结核化疗方案的药物组成和疗程、患者依从性和耐受性、细菌学及药物血药浓度等。
2.化疗不彻底和治疗不规律的患者:需要调整治疗和管理方式,确保完成疗程后再行活动性评价,同时观察细菌学和影像学的动态变化。
三、实验室评价
(一)病原学评价
1.初诊患者:对于痰标本病原学检测(包括涂片、培养和分子生物学检测等)为阴性的肺结核患者,推荐采用BALF和支气管镜下活检技术,以进一步获取病原学和病理学证据。
2.疗程结束的患者:主要检测技术包括痰涂片、结核分枝杆菌培养等。由于基于结核分枝杆菌DNA检测的分子检测方法不能区分死菌和活菌,因此不推荐用于抗结核化疗的疗效评价[21-22]。有研究显示,结核分枝杆菌RNA检测技术有助于区分死菌和活菌[23-24]。
(二)血清学及免疫学评价
在判定结核病活动性方面,目前尚无可用的、有效的生物标志物。血清学检查在活动性判断上证据级别较低,存在疑似结果时需结合影像学和临床表现进行综合判断。以下几个指标仅供参考:
1.炎性指标:血红细胞沉降率(erythrocyte sedimentation rate,ESR)增快和C反应蛋白(C-reactive protein,CRP)升高常提示炎症反应的持续存在[25];贫血可作为活动性肺结核的慢性消耗性指标[26]。但这些指标应在排除其他疾病的基础上用于辅助判断肺结核活动性。
2.T细胞免疫学检查:结核菌素皮肤试验(tuberculin skin test,TST)和IGRAs仅能反映机体处于潜伏结核感染(latent tuberculosis infection,LTBI)状态,而在肺结核活动性判断中的价值有限。有研究发现,IGRAs对于新近感染的判断较TST具有一定优势,50%的活动性肺结核患者经治疗后可出现IGRAs阴转,提示IGRAs对肺结核转归判断可能具有一定意义[27-29]。由IGRAs技术衍生而来的结核分枝杆菌特异性抗原/植物凝集素比值(TBAg/PHA比值),在活动性肺结核患者往往高于LTBI者的水平,提示T细胞免疫反应可能与抗原载量有关[30]。目前,IGRAs尚不能对肺结核活动性做出精确判断。另外,T淋巴细胞标记物CD 27、 CD 38、人白细胞抗原(HLA)-DR和细胞内Ki 67表达最近被证明是有希望的生物标志物[31],但还有待进一步做深入研究证实。
四、影像学评价
(一)肺结核活动性、稳定性及不确定性征象
1.胸部X线检查:(1)活动性征象,包括多发性结节状病灶,片状、云絮状及大叶性肺实变,团块状阴影,以及肺门或纵隔淋巴结增大等。这些病灶具有密度不均、中间密度高周边密度低、分布不均、呈浸润性改变等特点;可伴有厚壁、薄壁、张力性空洞及多发虫蚀状空洞;还可伴有邻近“卫星灶”、支气管播散灶、引流性支气管、淋巴管炎、胸腔积液等。(2)稳定性征象,包括致密的结节及斑块状病灶、钙化灶、纤维条索状病灶、肺气肿,以及治疗后残留的净化性空洞等,这些病灶边界清晰锐利,可伴有胸膜和(或)纵隔淋巴结钙化。双肺尖的胸膜增厚也是既往肺结核感染的证据之一。(3)不确定性征象,包括毁损肺、肺不张、结核瘤、斑块状病灶等尚未完全钙化的病变,不能据此做出非活动性肺结核判断,需完善CT检查后做进一步分析。
2.胸部CT检查:对CT扫描所显示的各种征象分述如下。
1)活动性征象:包括小叶中心结节状病灶、树芽征、病灶边缘模糊、中低密度的结节及肿块状病灶、不同范围的肺实变、磨玻璃样密度影(GGO)、小叶间隔增厚、结节状病灶簇集征、空洞(厚壁、薄壁、张力性、虫蚀样)伴或不伴引流支气管、支气管壁增厚、反晕征、弥漫性分布的粟粒结节状病灶、淋巴结肿大、胸腔积液(含包裹性)等。活动性肺结核患者的肺野可检出多种形态的活动性病变,往往以“征象群”的形式存在[32]。其中,以小叶中心结节、树芽征、边缘模糊结节和大小不等的斑片状实变影在活动性肺结核中较为常见,这些征象在活动性判断上具有较高价值。虽然病原学阴性肺结核中空洞的检出率明显低于病原学阳性肺结核,但治疗前业已存在的肺部空洞是提示活动性的重要依据。反晕征与结节状簇集征较少见,多见于病原学阴性肺结核患者中,对“活动性”判断有一定提示意义[33-34]。值得注意的是,对于完成治疗并获得细菌学治愈的肺结核,有时病灶区域也可残留1~2种活动性病灶的CT征象,其中以树芽征、GGO、不规则实变影多见,为疗程结束后的病灶残留征象,并不代表疾病仍处于活动状态[35]。虽然GGO多代表渗出性改变,也是活动性判断的重要依据,但在治疗过程中长期存在的GGO可能反映肺泡壁的间质纤维化改变,与病变修复有关,即磨玻璃样影并非具有特异性,故需进行综合分析判断。
2)稳定性征象:包括发生钙化的结节或斑块状病灶、纤细锐利的线状及条索状影、支气管聚拢迂曲、支气管扩张、肺气肿、胸膜钙化、包裹性钙化或线样增厚、净化性空洞(具有规律治疗史)或空洞内容物钙化等。需要注意的是,由于肺结核的慢性病程特点,往往可出现“活动性”与“稳定性”征象并存的现象,因此在判读时需对全肺病变仔细观察,在排除活动性CT征象后方能做出非活动性判断。例如,支气管扩张通常为肺结核痊愈后残留的气道不可逆性损伤,为非活动性表现,但当并发支气管壁增厚、黏液嵌塞及周围结节状病灶呈树芽征样分布时,往往反映肺结核病变的活动性。此外,条带样实变、胸膜不规则增厚是活动性不确定的CT征象,部分仍可能具有潜在的活动性;如经过治疗后随访,出现纤细、锐利的条索状影,胸膜增厚逐渐变薄呈线样、伴钙化或出现胸膜下脂肪层增厚,则提示为非活动性。“肺尖帽”为肺尖部胸膜增厚的CT征象,可能为既往感染肺结核的证据。
3)不确定性征象:包括未发生钙化的结核瘤、斑块状或界限清楚的不规则实变、空气潴留征、肺不张、支气管闭塞或狭窄、胸膜不规则增厚与包裹等。这些征象往往提示肺结核病变主体稳定,但部分病变经治疗观察可获得不同程度的好转,提示部分仍具有潜在的活动性。例如,界限清楚的不规则实变、斑块状病灶或结核瘤,仍不能除外活动性,需要进一步行CT增强检查;如出现明显强化,边缘强化、环形强化或灶性低密度区则提示处于活动期。结核球周围卫星灶形态也有提示作用,呈小叶中心结节状病灶或为树芽征表现时,往往提示具有活动性。肺不张通常见于非活动性肺结核,多见于治疗后支气管不可逆损伤而导致陷闭和(或)毁损肺,但支气管结核也可继发肺不张,伴随征象多为支气管壁增厚、管腔不均匀狭窄,以及在其他肺野检出结核播散征象,此时则提示肺不张仍具有活动性。胸膜不规则增厚与包裹往往提示胸膜存在严重的炎性反应,CT增强扫描多呈明显强化,但对于完成疗程的胸膜炎患者,如胸膜包裹长期稳定,则可停药进行随访观察,或进行外科胸膜剥脱术以改善肺功能。空气潴留征反映小气道功能损伤,与气道炎症或瘢痕狭窄导致活瓣通气阀形成相关,本身不提示活动性,需要结合肺内病变状况区别对待[16]。对活动性不确定征象评价时需结合临床表现、治疗史,以及动态随访做出评价,必要时采用CT增强检查、支气管镜、经皮肺穿刺活检等进一步明确。
3.胸部MRI:胸部MRI具有无辐射性,因此可以作为特殊人群,如儿童、育龄妇女、孕妇(在妊娠的前3个月应避免做MRI检查),或行CT增强扫描时发生对比剂过敏的患者,肺结核活动性判断的替代性检查手段。胸部MRI也可以用于特殊人群肺结核治疗后的随访。随着快速成像序列的开发和高场强的应用,尤其是超短回波时间(UTE)序列的使用,胸部MRI在成像速度和图像质量方面均有显著的提升,已经在显示肺部病灶的部分形态学特征方面(实变、结节、空洞等)可与CT相媲美;但是,在显示树芽征、小磨玻璃样影等方面尚有欠缺[36]。胸部MRI具有较高的组织对比度和多参数成像的优势[T1WI、T2WI、扩散加权成像(DWI)、动态对比增强磁共振成像(DCE-MRI)等],对于评估结核病灶组织特征方面明显优于CT,可用于肺内结核病灶、纵隔淋巴结的活动性和治疗后评价。有研究显示,根据T2WI的病灶信号强度,可以预测不同的病理阶段或肺结核进程的演变[37]:(1)T2WI呈轻度高信号,提示渗出性炎症阶段;(2)病灶内T2WI呈现显著高强度,提示液化坏死形成;(3)中心区T2WI等信号伴周围T2WI高信号,提示干酪样坏死形成;(4)病变内T2WI呈相对低信号,提示病灶以纤维化为主;(5)T2WI 呈显著低信号,提示为钙化成分,为愈合阶段。胸部MR增强扫描也有助于评估肺结核的不同病理阶段:呈均一的显著强化时,提示急性期肉芽肿阶段;呈特征性环形强化、中央无强化区域时,提示为干酪成分,环形强化区域提示为纤维肉芽组织;未强化时,提示静止期或愈合阶段。
4.正电子发射体层摄影术(PET)-CT :PET-CT对于区分肺结核活动性与非活动性具有独特价值。研究表明,活动性肺结核病灶中含有大量类上皮细胞、朗罕细胞和淋巴细胞,这些细胞的葡萄糖代谢旺盛,其最大标准摄取值(SUVmax值)明显高于非活动性病变。因此,PET-CT在确定亚临床结核病患者、陈旧性肺结核的早期复发和评估治疗反应方面均有应用意义[14, 38]。有研究发现,经过抗结核药物治疗并获得治愈的肺结核患者行PET-CT显像时,尽管大多数残留病灶经过随访其大小和代谢强度有所改善,但仍有部分患者残留18F-氟代脱氧葡萄糖(18-fluorine flurode oxyglucose,18F-FDG)阳性病灶,主要原因是肺组织中可能仍有结核分枝杆菌残留所致的炎性反应,此时机体对结核分枝杆菌的免疫清除是病变修复的重要补充,但这一过程需要更长的时间[11]。该技术为活动性判断带来全新的思路,也进一步诠释了肺结核治愈后组织修复的进程要明显滞后于细菌学转阴的特点。PET-CT对肺结核活动性评价具有重要价值,但由于PET-CT价格昂贵,在我国尚不能常规用于肺结核活动性判断。
(二)肺结核活动性影像学判断的基本原则
1.治疗前活动性判断要坚持“排除法”原则:活动性征象对提示活动性肺结核有重要意义。治疗前活动性影像学判断应坚持“排除法”原则,即首先排除“活动性”征象,然后采取多种诊断技术提高对“不确定性病变”的精准评价效果。尤其注意不能仅根据“钙化”“纤维条索状影”等直接做出“陈旧性结核”的结论。对于复杂和多发的疑似“稳定性”病变的判断要持慎重态度,不能轻易作出“陈旧性”病变的诊断。必要时可行CT增强扫描、支气管镜检查及肺活检等检查手段以进一步明确诊断。
2.疗程结束后活动性判断要坚持“趋势评价”原则:由于肺结核的病理学与影像学转归多滞后于细菌学转归,故在疗程结束后仍会残留一些活动性征象,并在停药后的随访过程中,残留病变仍可继续修复和重塑[39]。故在疗程结束后进行活动性判断时,通过对连续性的影像学资料进行评价,掌握趋势变化尤为重要[40]。如病变进展、反复则提示仍处于活动期;如病变主体处于显著吸收或好转的趋势,未出现新发病变,则提示肺结核病灶趋于稳定。如病变吸收但不显著,或残留较多的活动性征象特点,则提示活动性不确定。总之,在疗程结束后的活动性判断上应注重转归趋势评价,而不是将重点放在具体残留征象的评价上,这与初诊肺结核的活动性判断有所区别。
(三)影像学“分类判断”原则
影像学推荐分类判断原则,判断意见一般分为活动性、稳定及不确定等3种情况,这符合病理-影像学演变的客观性原则。对于不确定的情况需要选择影像学手段(如HRCT、CT增强扫描)或支气管镜检查,并进一步获得病原学和组织学证据。同样对于影像学“稳定”也推荐进行临床综合评价,以利于最终做出“治”与“不治”的临床决策。
总之,在影像学活动性判断上应坚持客观性原则,初诊患者以排除活动性征象为主;疗程结束的患者活动性判断则以观察病变的趋势变化为主。
五、病理学评价
肺结核病理学检查包括常规病理学、抗酸染色及分子病理学检测等。结核病的基本病理变化主要为渗出性病变、增生性病变和坏死性病变,这3种类型的病变可以共存,随机体抵抗力、对结核分枝杆菌的变态反应强度、结核分枝杆菌的菌量及毒力强度的变化而相互转化[40]。肺结核的组织病理学改变通常为坏死性肉芽肿性炎,但亦可为非坏死性肉芽肿性炎,典型病变是肉芽肿伴干酪样坏死及结核结节形成,外周有纤维结缔组织和慢性炎性细胞浸润,周边可见朗罕细胞[41]。结核病病理诊断仅凭组织形态学观察只能做出提示性诊断,如符合结核等;抗酸染色查病原菌有重要意义,但阳性检出率相对较低。近年来,应用荧光定量聚合酶链式反应技术检测石蜡组织中结核分枝杆菌脱氧核糖核酸(TB-DNA),越来越受到重视。多项研究表明,该技术检测敏感度明显高于抗酸染色法,对确诊结核病有重要意义[42- 43]。
结核病经过抗结核药物治疗,病变可吸收、缩小甚至消散,也可出现纤维化及钙化(称为纤维钙化性病变)。因此,病理学评价肺结核的病变活动与否,主要有以下表现:(1)外科手术切除标本判断较易,较稳定的病变表现为病变周围纤维化、钙化和纤维包裹性坏死病变,如局灶型结核和结核瘤;活动性病变主要为坏死性肉芽肿及渗出改变,如浸润性肺结核、干酪性肺炎、空洞性肺结核等。(2)支气管镜下活检标本,或经皮肺穿刺活检的组织标本,若病变为坏死性肉芽肿性炎,或见病变旁肺组织渗出性改变,提示活动性肺结核;如仅为坏死、少许肉芽肿病变,同时纤维组织增生变性及伴钙盐沉积时,则判断为活动性较困难,需结合临床、影像及其他病理检查结果进行综合判断。(3)在病变组织内找到抗酸杆菌,且细菌的数量较多,TB-DNA含量增高提示活动性肺结核。
肺结核活动性的临床综合评价
病原学阳性是肺结核活动性判断的金标准。对于痰病原学阴性的患者,推荐采用BALF进行结核分枝杆菌培养,必要时进行肺活检,尽可能获得病原学证据。在进行临床综合评价前,需要结合详细的临床表现、影像学及实验室检查资料,还需要考虑到免疫学等检测技术、患者的不典型症状对活动性判断的影响,全面客观地评价各项指标以争取做到准确判断。
一、肺结核治疗前的活动性评价
病原学阳性的肺结核患者可直接判断为活动性。但是对于病原学阴性的患者,在进行抗结核药物治疗前的活动性评价需要综合影像学、临床和实验室等方面进行判断。如经过影像学、临床症状和实验室评价仍不能明确活动性者,推荐使用支气管镜下肺活检、BALF、分子生物学检测获得病理学和病原学诊断依据,进行精准的活动性判断。如仍不能明确,可以采用经验性抗结核药物治疗(一般2个月疗程),通过观察疗效来评价活动性。如影像学判断为“稳定”,又无支持活动性的临床症状及实验室证据,推荐对患者进行随访观察。活动性判断的临床决策应由结核科诊疗小组最终做出,其成员由3名以上医师组成,其中应包括结核科/呼吸科、检验科和影像科医生。病原学阴性肺结核治疗前活动性临床综合评价流程见图1。
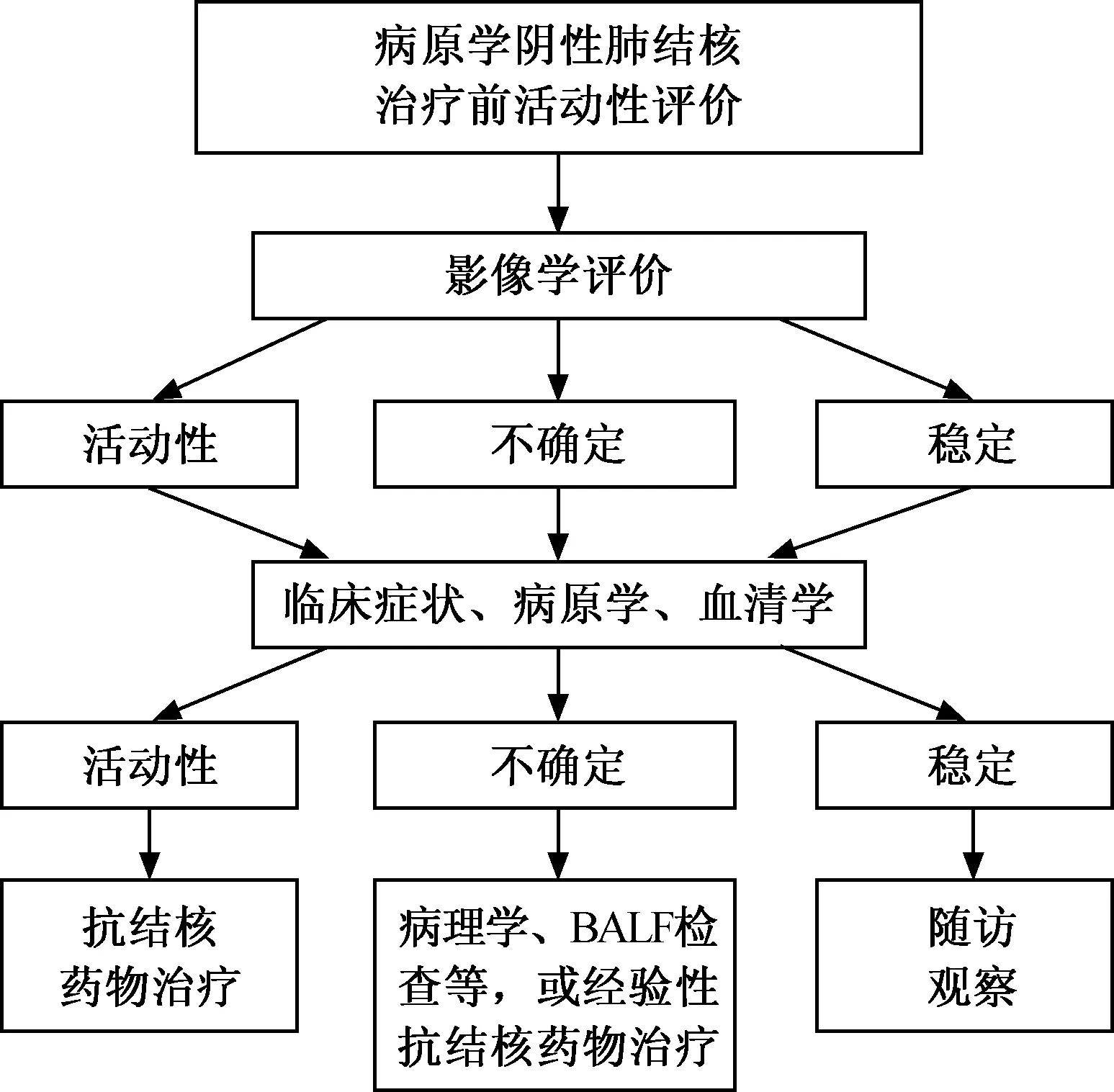
图1 病原学阴性肺结核治疗前活动性临床综合评价流程
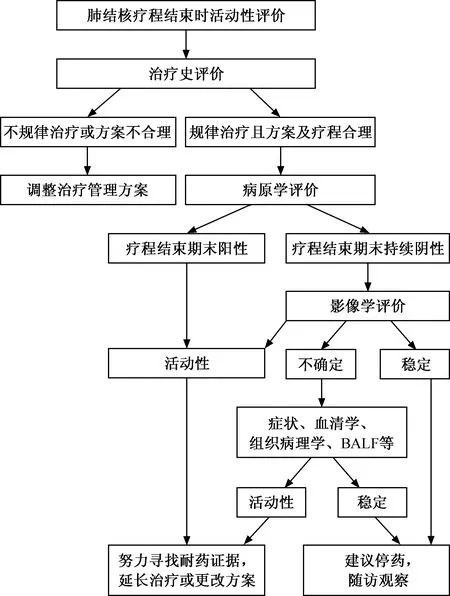
图2 肺结核疗程结束时活动性判断的临床综合评价流程
二、肺结核患者疗程结束时的活动性评价
疗程结束时肺结核的活动性评价原则与治疗前评价不尽相同,推荐优先进行治疗史和病原学评价,而影像学评价的重点应放在趋势变化上。对于病原学阴性、规律治疗、影像学呈持续吸收好转的患者,一些活动性征象的残留并不代表患者需要继续治疗[44]。对于影像学活动性不确定的患者,需要结合临床进行评价:(1)借助肺活检、BALF获得活动性的证据;(2)对患者的药物敏感性试验结果、服药规则性、方案合理性、基础疾病做出评价。如排除各项不利因素,且临床评价和影像学判断一致时,可给予终止治疗、定期随访;如临床评价和影像学判断互相矛盾时,应尽可能获得新的证据[45]。具体流程见图2。
展 望
肺结核活动性判断是临床医疗实践中的热点难点问题,本《共识》为其提供了基本原则和方向,未来尚有许多问题有待解决,包括:(1)研发高效的生物标志物应用于肺结核活动性判断,不断提升肺结核活动性判断的准确度;(2)开展针对肺结核患者亚临床及自限状态化疗方案的随机对照研究,建立科学的活动性判断技术体系和用药原则;(3)肺结核患者的并发症、残留损坏和结构性肺病也不容忽视,其不仅影响肺结核活动性的判断,还降低了患者的生存质量,甚至可能威胁其生命安全[40]。
肺结核治疗后的并发症主要包括:(1)实质并发症,主要为残存空洞内曲霉菌球,肺结核瘢痕癌或与原发肺癌共存;(2)气道并发症,主要表现为支气管扩张、支气管结石、继发性淀粉样变、肺气肿等;(3)血管并发症,主要有肺动脉高压、与肺结核相关的肺血栓栓塞症、Rassmussen动脉瘤或支气管扩张引起的咯血;(4)胸腔并发症,包括慢性脓胸、脓胸相关肿瘤、支气管-胸膜瘘、气胸等;(5)纵隔并发症,主要有纵隔纤维化、缩窄性心包炎等[11, 46-47]。
上述问题在肺结核活动性判断中需要同时进行临床评估,需要建立整合医学模式、制定精准治疗计划,以保障患者的生活质量。
执笔人邓国防(518112 深圳市第三人民医院);路希维(116033 大连市结核病医院)
参加讨论与撰写本共识的主要单位和专家(排名不分先后):福建省福州肺科医院结核科(陈晓红);首都医科大学附属北京胸科医院(陈效友、初乃惠、黄海荣、张海青、周新华);深圳市第三人民医院(刘磊、王召钦、邓国防、付亮、王立非);太原市第四人民医院结核科(段慧萍);同济大学附属上海市肺科医院结核科(范琳);大连市结核病医院(路希维);北京,解放军总医院第八医学中心 全军结核病防治研究所(王仲元);哈尔滨市胸科医院结核科(王莲芝);大连大学附属中山医院(伍建林);广州,广东省结核病控制中心(温文沛、吴惠忠、陈瑜晖、陈亮);《中国防痨杂志》期刊社(薛爱华);首都医科大学附属北京地坛医院影像科(谢汝明);南京市第二医院(张侠、曾谊);大连医科大学附属第一医院影像科(李智勇);武汉市肺科医院影像科(余辉山)
利益冲突:无利益冲突。
志谢兰州大学循证医学中心/GRADE中国中心陈耀龙课题组对本共识提出了宝贵意见和建议。

