miRNA参与植物胚和胚乳发育调控的研究进展
邢利娟, 刘悦萍, 王磊, 徐妙云*
1. 中国农业科学院生物技术研究所,农业农村部农业基因组学重点实验室(北京),北京 100081;2. 北京农学院生物与资源环境学院,北京 102206
籽粒发育主要包括胚和胚乳的发育以及贮藏物质的积累[1]。籽粒的灌浆、形态发育直接影响着作物的产量和质量。以玉米为例,玉米籽粒的发育是由典型的双受精开始,一个精子与卵细胞结合形成胚,另一个与2个极核结合形成胚乳[2]。胚、胚乳和母体组织经历精密、协调的发展,可以分为3个阶段:早期发育、灌浆期和脱水成熟期[3]。在授粉后15 d(day after pollination,DAP),胚和胚乳从一个单细胞迅速发展成为分化组织。在15~45 DAP,胚乳积累了大量的贮藏物质,籽粒开始脱水成熟。在籽粒发育的过程中,受到多种机制的调控,包括各种环境因子、内源调控激素以及各种微小RNA(microRNAs,miRNAs)等。
miRNAs是一类内源性非编码小分子RNA,其通过靶向mRNA在转录后水平上负调控基因的表达[4]。多项研究表明,植物miRNA参与调控细胞分裂、形态发生、器官发育和激素信号转导等多个生物学过程[5-6]。本文概述了植物miRNAs的生成及作用机制,综述了近年来miRNAs参与植物籽粒发育调控的主要研究进展,并探讨和展望了miRNAs在玉米籽粒发育中的调控功能,以期为进一步鉴定与玉米籽粒发育相关的miRNAs并解析其调控功能提供更好的研究方向。
1 植物miRNA的形成及作用机制
miRNA是调控真核生物基因表达的重要调控因子,通常只有21~24 nt的长度,植物中21 nt的miRNA数量最多[7]。植物中,21 nt miRNA的生物形成包括4个步骤:①编码miRNA基因的转录,细胞核中编码miRNA的基因在RNA聚合酶Ⅱ(RNA polymerase Ⅱ)的作用下转录形成长度约为几百个nt、具有茎环结构的初级转录产物pri-miRNA (primary miRNA)[7-8];②双链miRNA的形成,转录产物经RNase Ⅲ蛋白Ⅰ(Dicer-like 1,DCL1)切割产生前体miRNA(miRNA precursor,pre-miRNA),该前体长度一般为64~303 nt,随后DCL1继续作用于pre-miRNA而形成双链miRNA;③双链miRNA的释放;④双链miRNA甲基化、输出及组装,双链miRNA在miRNA甲基转移酶(Hua enhancer 1,HEN1)的作用下,使3′端最后一个核苷酸发生甲基化后[9-10],进入细胞质,与效应蛋白(argonaute proteins,AGOs)结合,然后整合到RNA介导的沉默复合体(RNA-induced silencing complexes,RISCs)中进一步靶向互补RNA或DNA,使其编码基因发生沉默[4,11]。在不同物种中,DCLs、AGOs以及RNA依赖的RNA聚合酶(RNA-dependent RNA polymerases,RDRs)蛋白的数量存在差异。如拟南芥中,鉴定出了4个AtDCLs、10个AtAGOs和6个AtRDRs,DCL蛋白在植物体内的作用主要表现在2个方面:加工体内的单链RNA产生miRNA、剪切外源双链RNA成为小干扰RNA(short interfering RNA,siRNA),DCL1蛋白主要参与miRNA的合成,其他3种DCL蛋白都与siRNA合成相关;在拟南芥的10个AGOs蛋白中,具有切割活性的有AGO1、AGO4和AGO7[12];RDRs能以RNA为模板,从5′到3′进行延伸合成互补RNA链[13]。水稻中,有8个OsDCLs、19个OsAGOs和5个OsRDRs[14];玉米中,共鉴定到5个ZmDCLs、17个ZmAGOs和5个ZmRDRs基因[15-16]。
植物miRNA抑制基因表达的主要途径是降解与其高度互补的目标转录物[17-18]。也有研究表明植物中miRNA通过翻译抑制发挥调控功能[19],主要取决于植物miRNA与其靶mRNA序列的互补程度。目前己知的植物miRNA的功能主要表现在调控植物发育的各个方面,包括生长发育、逆境应答和种子形成等生物学过程,甚至1个miRNA可以通过靶向多个不同下游基因而发挥多种调控功能,其靶基因60%以上是植物发育模式和细胞分化中相关的转录因子[20-21]。
2 miRNA对籽粒胚乳发育的调控
2.1 胚乳的发育过程
胚乳主要为胚的萌发和生长提供营养。胚乳的发育分为3种类型:核型(nuclear type)、细胞型(cellular type)和沼生目型(helobial type)。在这3种方式中,细胞型胚乳发育的特点是从初生胚乳核的第一次分裂及其后的分裂都是紧跟着形成细胞壁,多集中于双子叶植物,如烟草、番茄等。沼生目型比较少见,只出现在沼生目植物的胚乳发育中。核型方式最为普遍,核型胚乳的典型特征是受精极核的第一次分裂以及其后一段时间的核分裂,不伴随细胞壁的形成,各个细胞核保留游离状态,分布在同一细胞质中。以玉米为例,其胚乳发育是典型的核型,在胚乳发育早期为游离核时期,各个胚乳核呈游离状态分布在胚囊中。待发育到一定阶段,开始出现细胞壁,并且由四周逐渐向中央液泡推进,直至6 DAP左右,胚乳全部细胞化[22]。细胞化后,依据细胞的不同形态以及其功能将胚乳分为4种细胞类型:淀粉胚乳(starch endosperm)、糊粉层(aleurone,AL)、淀粉基部胚乳转移层(base endosperm transfer layer,BETL)和胚周区(embryo surrounding region,ESR)。淀粉胚乳负责积累淀粉和储藏蛋白质[23-24]。淀粉胚乳细胞在发育的早期主要为大型薄壁细胞,细胞内含有各种细胞器,在发育中后期,内胚乳细胞核逐渐衰亡,随着淀粉体和蛋白体不断填充,细胞内液泡逐渐消失,直至胚乳成熟期,淀粉胚乳细胞变成无生理活性的贮藏细胞[25-26]。BETL是由胚乳周围的区域最接近花梗端部的韧皮部分化成的,负责将营养物质从母体向内部胚乳细胞转运,以保证蛋白质和淀粉的合成。如王忠等[26]发现胚乳转移细胞(transfer cell,TC)的细胞壁中有胞间连丝,并且细胞壁的空腔含有较多的线粒体,细胞内部内含有许多电子密度高的物质,推测胚乳转移细胞在把灌浆养分输入胚乳方面起着重要的作用。近年来的研究鉴定了许多BETL中特异表达的基因,如BETL1是转移细胞分化的标志;MRP-1(MYB-related protein-1)编码1个MYB相关转录因子,参与激活BETL中其他基因,也有研究表明,MRP-1在AL中异位表达可以产生1个瞬时BETL-like的结构[27]。剩余的胚乳外细胞层分化形成AL,AL是一层单细胞,在种子萌发时产生水解酶活化淀粉胚乳中的储藏物质[28-29]。ESR细胞的体积小,并且有大的核和丰富的内质网,它是一个动态的结构,在15 DAP左右消失,并作为胚与胚乳的物理屏障,参与二者的互作[30]。除去ESR之外的胚乳细胞分化成了淀粉胚乳,它们构成了胚乳的大部分,致力于灌浆阶段的营养储存[31]。
2.2 miRNA对胚乳的调控
胚乳的发育受很多因素的调控,其中miRNA的调控至关重要。miR397被认为参与维持胚乳细胞分生组织的状态。研究发现,miR397在拟南芥原胚细胞中高表达,导致漆酶基因的下调,从而维持胚胎细胞处于薄壁和分生组织状态,影响次生细胞的木质化和细胞壁增厚;而miR397在分生组织中低表达使漆酶积累,从而导致分生组织向成熟细胞过渡时细胞壁木质化[32]。在椰子中也发现了相似的结果,miR397在胚乳中的高表达可以使其胚乳保持分生组织状态[33]。Gu等[34]通过小分子RNA(small RNA,sRNA)高通量测序技术鉴定了来自11个miRNA家族共18个参与调控玉米胚乳发育的miRNAs,发现与4~6 DAP相比,7~23 DAP胚乳中miR160的表达水平下调、miR167的表达水平上调。研究表明,miR160和miR167可以通过靶向生长素应答因子(auxin response factor,ARF)来调节生长素的水平,进而调控胚乳的发育[35-36]。在拟南芥中,miR160通过靶向降解转录因子ARF17基因,影响GH3(gretchen hagen 3,GH3)家族蛋白的变化,从而进一步调节细胞内生长素水平[37]。在水稻中,Yang等[38]发现当水稻细胞在无生长素培养基中生长时,miR167丰度降低,ARF8的mRNA水平升高;在含有生长素的正常生长培养基中生长的细胞中,miR167及ARF8的表达则呈现出相反的趋势。当将人工合成的miR167转染入水稻细胞后,细胞中ARF8和GH3-2的mRNA均降低。从而发现了生长素—miR167—ARF8—GH3-2这样一条新的生长素信号转导途径。
本实验室之前通过miRNA转录组学分析,在发育中的玉米籽粒中鉴定到132个已知的miRNAs和6个新的miRNAs,并发现miR164、miR171、miR393和miR2118在发育的胚乳中高表达[39]。这些高表达的miRNA靶向的基因包括转录调控、大分子生物合成与代谢过程以及胚乳中维生素生物合成与代谢过程[39],另外也研究了9、15和20 DAP玉米胚和胚乳中miRNA的动态特征,发现miR169在玉米籽粒发育的早期和中期特异性高表达,参与胚或胚乳的调控发育[40]。值得注意的是,早期研究表明miR169家族成员主要参与植物应对非生物胁迫的反应,而最近发现,miR169家族成员可能作为一个纽带协调应激反应和各种发育过程。如Luan等[41]发现ath-miR169d 通过对其靶基因NF-YA2的作用参与了拟南芥中逆境诱导的开花调控。在油菜中,miR169参与调控了盐胁迫或干旱胁迫条件下种子的萌发过程[42]。前期,本实验室也发现zma-miR169家族成员能响应聚乙二醇(polyethylene glycol,PEG)模拟的干旱、脱落酸(abscisic acid,ABA)和NaCl这3种非生物胁迫,并通过转基因玉米植物中启动子::GUS系统表明miR169影响籽粒发育[40]。此外,Zheng等[43]发现miR164在玉米籽粒发育过程中表达下调,参与了玉米胚乳的发育,并提出一条miR164参与玉米种子发育的调控途径:miR164通过靶向转录因子NAC32/NAC40,间接调控下游基因EXPB14(expansin 14)和EXPB15(expansin 15)的表达(expansin基因与种子膨大有关),进而影响玉米胚乳细胞的增大和种子的发育。参与调控胚乳的发育过程的miRNAs及其功能见图1。
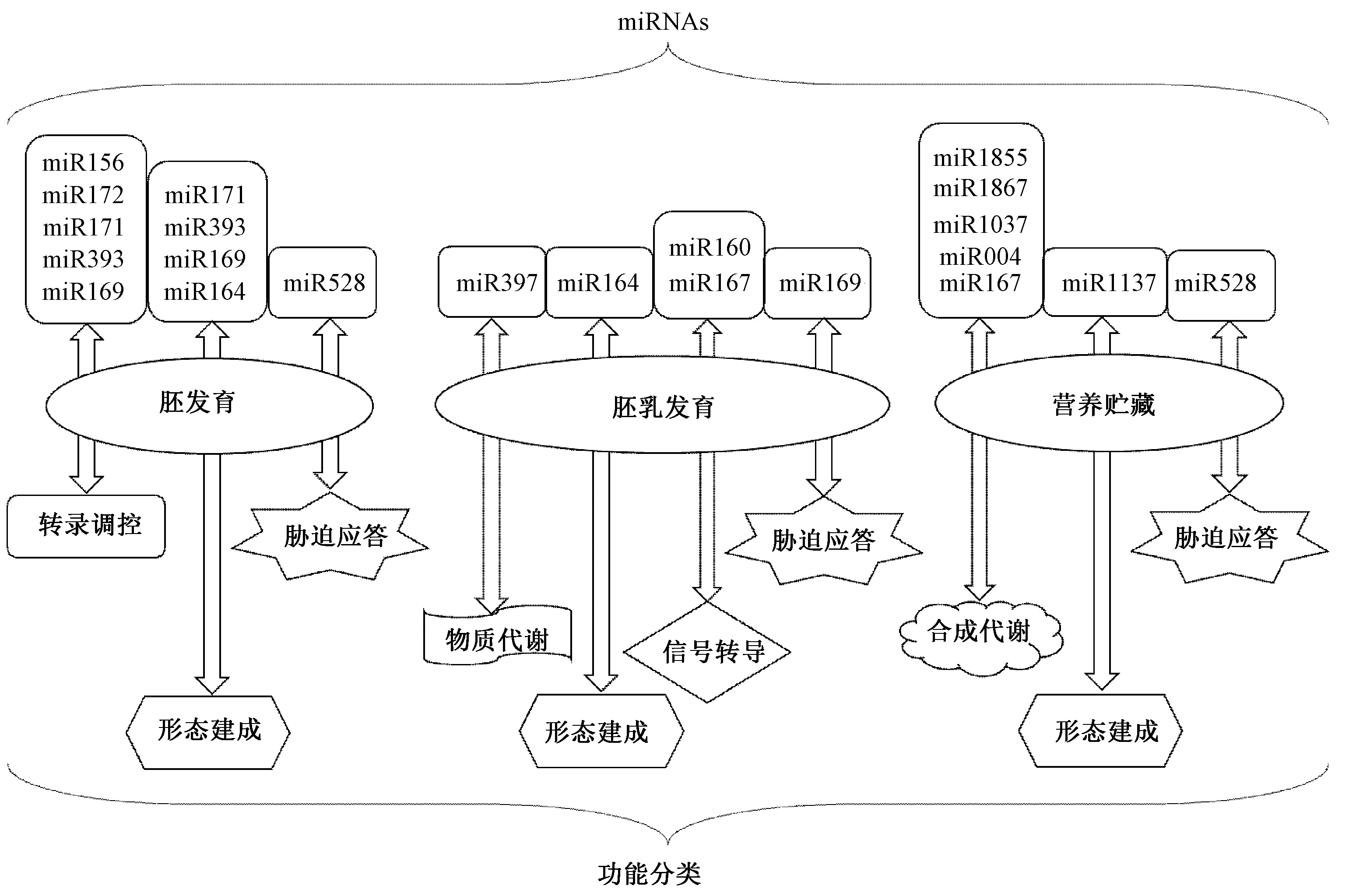
图1 与籽粒发育相关的miRNAs 及调控功能Fig.1 miRNAs involved in kernel development and its regulatory function
2.3 miRNA对胚乳中淀粉合成的调控
禾谷类作物如小麦、水稻、玉米等的籽粒发育主要是淀粉积累的过程,这个过程会受到miRNAs的诸多调控。在小麦中,miR1037可以通过调控其靶基因——磷酸甘油酸激酶基因,进而参与调节淀粉和蔗糖之间的碳分配[44];miR128-5p可以通过靶向调控蛋白DRG1(developmentally regulated GTP-binding protein 1),DRG1对调节囊泡转运或加工贮藏蛋白的酶活性至关重要,从而调节囊泡转运或加工贮藏蛋白的酶活性;miR004-1-5p通过抑制蔗糖磷酸合成酶编码基因的表达,从而对淀粉积累过程进行负调控[45-46]。扩展蛋白(expansin)是决定籽粒大小的一个重要因素,miR1137通过靶向扩展蛋白基因膨胀素,参与了小麦早期的籽粒膨大过程[44]。在水稻中,Peng等[47]发现miR1867的靶基因是编码淀粉合成酶蛋白的基因,通过参与淀粉合成通路,进而调控水稻灌浆率。而Li等[48]的研究发现在玉米中,miR167在营养贮藏阶段可能通过调节单铜氧化酶(monocopper oxidase,MCO)基因的表达参与种子成熟代谢的调控,miR528可能通过调节抗冻蛋白(antifreeze protein,AFP)基因的表达参与调控营养贮藏过程中的逆境反应。此外,在非谷类植物拟南芥中发现,miR1855的候选靶基因编码的磷酸丙糖转运体(triose phosphate translocator,TPT)是一种存在于拟南芥叶绿体内膜的完整膜蛋白,它负责输出光合作用过程中产生的所有碳水化合物,miR1855可抑制TPT从而使淀粉合成增加[49]。参与调控胚乳中淀粉合成的miRNAs及其功能见图1。
3 miRNA参与调控胚的发育过程
3.1 胚的发育过程
在被子植物中,无论是单子叶植物还是双子叶,都有着典型的双受精现象,即每个萌发的花粉管中携带2枚精子,到达胚珠后释放出来,一个精子与卵细胞结合形成受精卵,另一个精子与2个极核结合形成受精极核。以玉米为例,玉米的胚是在双受精过程中,由其中1个精子与卵细胞结合形成,其位于籽粒基底部的近轴侧。授粉后40 h左右,受精卵开始了第1次细胞分裂,形成1个顶细胞和1个近珠孔端的基细胞,顶细胞经过几次的细胞分裂,逐渐发育成球状胚体,近珠孔端的基细胞则经分裂发育成为胚柄。3~5 DAP,胚形成1个圆球形的上部、胚体以及1个锥形下部[50]。6~8 DAP,胚的一侧开始分化,出现了茎端生长点和根端生长点,另一侧已有盾片发育迹象。9~12 DAP,开始分化出茎尖分生组织(shoot apical meristem,SAM)和根尖分生组织(root apical meristem,RAM),它们周围形成了胚芽鞘和胚根鞘;另外,单一的玉米子叶在胚胎的背面开始生长扩大[51]。12 DAP时,便清晰可见生长锥,此时是生长最快的时期,并且胚芽鞘由于快速生长与盾片分离,胚柄变短,开始产生叶原基。之后,胚柄退化,胚根与胚芽鞘分化明显,胚根伸长,并分化出次生胚根,胚叶数不断增加;12~20 DAP是胚发育最快的时期,基本完成了各种器官的分化;45 DAP,胚便发育成熟,呈现出5~7片胚叶。胚发育过程中胚柄的退化、盾片与胚芽鞘之间凹陷的产生是细胞的一种程序性死亡[52-53]。
3.2 miRNA对胚的发育的调控
miRNA对不同物种的胚的发育调控都起着关键的作用。miR156、miR172及其靶基因SBP-Like(Squamosa promoter binding protein-like, SPL)和AP2(Apetala 2)编码的转录因子在植物胚胎发育过程中起着关键作用[54]。在油菜中,miR156家族的大多数成员在胚子叶中高度表达,并且在种子成熟过程中它们的表达逐渐增加;与之相反,一些miR156变异体则在胚乳和种皮中特异性表达,并在种子成熟过程中降低[55]。在玉米中发现miR172在种子发育早期的胚乳中优先表达,在随后的成熟过程中表达下调,而随着籽粒发育,miR156的表达量则上升,它们的靶基因AP2和SPL分别以互补模式表达[56]。玉米Cg1(Corngrass1)基因编码1个miRNA,促进幼年细胞壁形态建成,而此基因突变后的突变体的miR156水平升高、miR172水平降低,出现发育过度、幼期特征延长和延迟开花等表型[57]。此外,Huang等[55]研究发现,miR159优先表达于油菜子叶和下胚轴,推测miR159限制了胚胎中的赤霉素(gibberellins,GAs)效应,主要影响子叶以及下胚轴组织。Li等[48]在未成熟的玉米籽粒中鉴定到111个保守的miRNA(来自40个miRNA家族)和196个新的miRNA(来自162个miRNA家族),发现miR169、miR171、miR393等高表达的保守miRNA家族可能在玉米籽粒的胚胎发育中参与转录调控和形态发生。NAM(no apical meristem)是miR164的靶基因,miR164在玉米籽粒发育早期表达较高,而NAM表达较低,miR164的早期积累表明,它可能通过沉默NAM基因在玉米籽粒的胚胎发育中发挥作用。另外,在玉米籽粒发育后期miR528的积累,推测miR528可能通过调节AFP基因的表达参与调控营养贮藏过程中的逆境反应[48]。上述参与调控胚的发育的miRNAs及其功能见图1。
4 展望
本文综述了近年来miRNA参与调控植物胚和胚乳发育的相关研究进展。miRNA作为重要的调控因子,从2002年首次在植物中发现至今,研究人员从生物合成与作用机制、进化与变异、检测与鉴定技术、生物学功能及调控网络等多个方面对植物miRNA进行了深入系统的研究,研究对象也从模式植物逐渐转向作物,如水稻、小麦、马铃薯、大豆、玉米、番茄等。迄今为止,已经解析了不少具有重要生物学功能的miRNA-靶基因调控模块,如在水稻中鉴定了osa-miR156-OsSPL、osa-miR159-OsGAMYB、osa-miR160-OsARF等至少33个模块参与了水稻叶片发育、茎的伸长、开花时间、非生物与生物逆境响应、籽粒发育等几乎全生育期的调控;小麦中有tae-miR159-TaGAMYB、tae-miR164-TaNAC21/22、tae-miR408-TaCLP1等[58-59]。在玉米中目前共鉴定了5对模块,包括zma-miR156-tga1、zma-miR164-ZmNAC1、zma-miR166-rld1、zma-miR172-gl15以及zma-miR172-ids1,分别参与调控幼年到成年期转变、苞叶发育、侧根发育、叶片极性和性别决定等生物学过程,但目前尚未见有与玉米籽粒发育相关miRNA-靶基因调控模块被鉴定[59]。
本课题组前期对玉米籽粒发育过程中的miRNA进行挖掘和鉴定[40],发现有包括zma-miR166、zma-miR156、zma-miR171、zma-miR167、zma-miR169和zma-miR399等6个miRNA家族成员在玉米籽粒中优势表达。其中miR169是植物中家族成员最多的保守miRNA,发现至少有9个成熟的miR169在玉米籽粒中优势表达,并且通过PromiR169::GUS转基因玉米检测了在籽粒发育过程中zma-miR169家族成员的表达模式,组织化学分析结果表明zma-miR169b、zma-miR169c和zma-miR169i 主要在花梗、胎盘、基部胚乳转移层以及胚和胚乳中表达,提示miR169主要在营养转运和籽粒发育过程中发挥重要调控作用。下一步将重点研究其参与调控玉米籽粒发育的分子机制,综合转基因技术、分子生物学技术、生物信息学技术等方法,确定miR169调控的下游靶基因及其功能进行分析和实验的验证,阐明其内在的调控网络,将有望为玉米的遗传改良和种质资源创新提供新的思路。

