应用高通量测序技术对我国东海带鱼肠道菌群的研究
刘铭, 刘辉, 李娜, 陈潇, 胡光春, 刘岚铮
济南市疾病预防控制中心细菌性疾病检验所,济南 250021
近年来,随着生活水平的提高和捕捞技术的发展,海产品消费量逐渐提高,与之相关的疾病也呈现上升趋势。2011—2015年全国食源性疾病监测网1 668起微生物性食源性疾病暴发事件中,有515起由副溶血性弧菌导致,每年均位列所有病原首位,致使8 446人发病[1-5],且近两年事件数和发病人数仍呈上升趋势(数据未公开)。海洋作为一个巨大的“微生物库”,我们对其相关微生物还所知甚少。根据宏基因组学分析结果,海洋微生物有100万种,我们目前分离到的海洋微生物不足1%[6-7],因此对其中潜在的致病风险尚不知晓。
带鱼(Trichiurusspp.)为集群于近底层的广温性洄游鱼类,其广泛分布于中国、朝鲜半岛、日本、印度尼西亚、菲律宾、印度、非洲东岸及红海等海域。我国带鱼的渔获量最高,其中东海带鱼为海洋渔业生产中渔获量最高的经济鱼种之一,产量多年来一直居我国海洋捕捞鱼类产量的首位,同时也是东海“四大渔业”中唯一还能形成较大渔汛的传统捕捞对象,在东海渔业生产中占据重要地位[8]。带鱼作为我国主要海产品之一,消费量较大,与人的日常生活关系密切。目前其病原学相关研究主要集中于常见病原菌,如霍乱弧菌、副溶血性弧菌、单核细胞增生李斯特氏菌、肠出血性大肠杆菌[9]。而带鱼在水中有昼夜垂直移动的习惯,深海与表层均是其活动范围,关于带鱼所携带的自身特有或海洋特有的病原微生物状况和风险均未知。本研究通过基于16S rRNA基因高通量测序技术与多种统计方法,分析我国东海带鱼肠道内容物中细菌群落的多样性,对明确带鱼肠道菌群结构、发现潜在致病的新病原具有积极的意义。
1 材料与方法
1.1 材料
1.1.1实验材料 于2018年9月在我国东海海域(27。N,121。E)捕获的10条体态完好的带鱼冰鲜运输至实验室。带鱼体长75.5~86.0 cm,重量248.7~396.5 g。
1.1.2试剂 QIAamp Fast DNA Stool Mini Kit购自德国QIAGEN公司,GeneJET胶回收试剂盒购自美国Thermo Scientific公司,Ion Plus Fragment Library Kit 48 rxns建库试剂盒购自美国Thermofisher公司,无水乙醇(优级纯)购自天津科密欧公司,Phusion high-fidelity PCR Mastermix购自NEB(北京)有限公司。
1.1.3仪器与设备 超纯水机购自英国ELGA公司,5424R离心机和金属恒温器购自德国Eppendorf公司,超微量核酸检测仪购自BioDrop公司。
1.2 方法
1.2.1样品处理 在超净工作台上,用75%(体积分数)酒精擦拭鱼体表面,然后从肛门处成弧形剪开鱼腹部,展现并分离肠道,用75%酒精棉球擦拭肠管外壁,轻轻挤出肠道内容物,置于无菌1.5 mL EP管中,分别编号为Tri911.1~Tri911.10,并对其立即进行DNA提取。
1.2.2DNA提取及核酸浓度测定 参照QIAamp Fast DNA Stool Mini Kit试剂盒说明书所述方法对10份带鱼肠道内容物进行DNA提取,并进行琼脂糖凝胶电泳和DNA浓度检测,以确保所提取DNA质量能够满足后续扩增要求。
1.2.316S rRNA基因扩增和测序 DNA扩增和测序交由天津诺禾致源生物信息公司进行。过程简述如下:根据16S rRNA基因序列特点和Ion S5TMXL平台测序要求,针对V3-V4区域设计带Barcode的特异引物341F:5′-C C T A Y G G G R B G C A S C AG-3′,806R:5′-G G A C T A C H V G G G T W T C T A AT-3′进行扩增[10]。PCR反应使用Phusion high-fidelity PCR Mastermix进行,反应条件为:94 ℃预变性2.5 min;94 ℃变性40 s,50 ℃退火55 s,72 ℃延伸90 s,共35个循环;72 ℃延伸15 min。PCR产物使用2%琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物,剪切回收目标条带。使用GeneJET胶回收试剂盒回收产物。然后用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库构建,经Qubit定量和文库检测合格后,使用Ion S5TMXL进行上机测序。
1.2.4数据处理与分析 对测序所得原始数据进行去杂、拼接,对所有的优质序列使用Uparse软件(版本7.0.1001)以相似度97%进行OTU分类。选取OTUs代表性序列,用Mothur方法与SILVA数据库进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在各个分类水平统计各样本的群落组成。使用MUSCLE软件(版本3.8.31)进行快速多序列比对,得到所有OTUs序列的系统发生关系。最后对各样本的数据进行均一化处理,进一步通过QIIME软件(版本1.9.1)和R语言(版本2.15.3)进行α多样性和β多样性分析。
2 结果与分析
2.1 基于16S rRNA测序的肠道内容物菌群多样性
对东海带鱼肠道内容物样品16S rRNA数据分析,10个测序样经质控,每样品平均得到 74 914 条有效数据,平均长度为418~427 nt。从稀释曲线来看,随着样品量的不断增大,在样品量大于45 000时,稀释曲线趋于平坦,说明测序数据量合理,且测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。
根据97%的相似度进行OTU分类,获得 1 221 个OTUs。10个样本分别得到159、282、490、214、314、263、275、680、332和495个OTUs。其中,注释到数据库的OTU数目为1 218(99.75%),注释到门水平的比例为89.03%,纲水平的比例为86.90%,目水平的比例为80.18%,科水平的比例为73.87%,属水平的比例为53.24%。在门水平上,占主导地位的为柔膜菌门(Mollicutes)、变形菌门(Gammaproteobacteria)和螺旋体门(Spirochaetia),结果见图1。
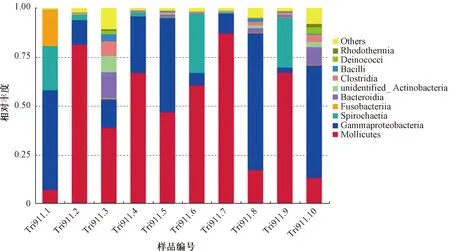
图1 每个样本中微生物在门水平上的群落结构组成分布(丰度排前 10)Fig.1 Bacterial community composition at phylum level in each samples (abundance in Top 10)
在属水平上的优势菌属为支原体属(Mycoplasma)、弧菌属(Vibrio)和发光杆菌属(Photobacterium)。不同分类水平上丰度排前10位的基于最大排序法以分布直方图展示。各样本中平均丰度排前10的属见图2,其中支原体属相对丰度分别为7.49%、79.18%、38.64%、67.13%、46.99%、60.71%、87.27%、17.51%、67.37%和13.51%。

图2 每个样本中微生物在属水平上的群落结构组成分布(丰度排前10)Fig.2 Bacterial community composition at genus level in each samples (abundance in Top 10)
2.2 α多样性分析
对不同样本在97%一致性阈值下的α多样性分析指数(Shannon、Simpson、Chao、ACE、goods coverage)进行统计,对样品微生物物种的丰富程度和多样性进行评估,结果见表1(均一化时选取的数据量:cutoff=43 885)。各样品的coverage都达到了0.999以上,即样品文库覆盖率高,序列未被检出的可能性小,本次测序结果能够较真实地反映样品中的微生物群落。其中Tri911.3、Tri911.8和Tri911.10样本的Chao指数和ACE指数较高,显示其微生物群落丰度较高;Tri911.1、Tri911.3、Tri911.8和Tri911.10样本的Shannon指数和Simpson指数较高,显示其微生物多样性较高。

表1 α多样性分析指数Table 1 α diversity index of each samples
2.3 β多样性分析
对样品进行主成分分析(principal component analysis, PCA),结果见图3。横坐标为PC1,其贡献率为26.17%。纵坐标为PC2,贡献率为25.82%。这2个主成分是样品微生物群落结构组成差异的主要因子。除Tri911.3、Tri911.10和Tri911.8外,大部分样品距离较近,样品的群落组成相似。
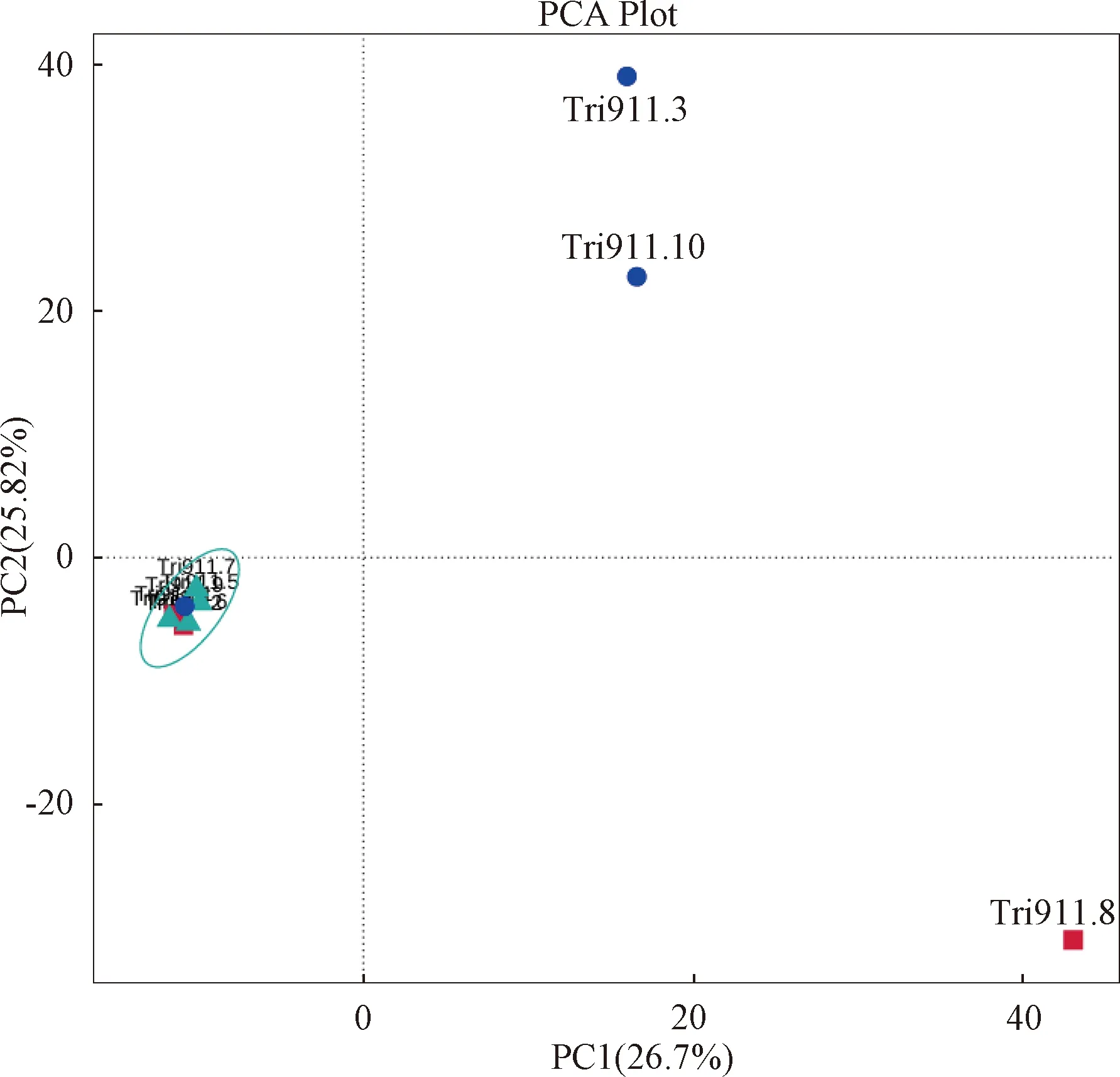
图3 10份带鱼肠道内容物样品的PCA分析Fig.3 Principal component analysis (PCA) of 10 hairtail fish intestinal contents samples
3 讨论
对鱼类肠道菌群的研究主要集中在淡水养殖鱼类和大黄鱼、大菱鲆等海洋经济鱼类上,以期通过对其肠道菌群的研究来提高鱼类的抗病能力,提高渔业产量[11]。本研究主要关注东海带鱼肠道菌群与人类新发传染病之间的关系。有研究报道,鱼类的肠道内容物中,以变形菌门为主,在不同种鱼类中占肠道菌群的90%[12-13],其中弧菌目(包括弧菌属和发光杆菌属)占70%[14]。而本研究发现柔膜菌门在其肠道菌群中为优势菌门,其中支原体属为优势菌属,相对丰度为50.95%。Holben等[15]运用16S rDNA测序技术对挪威和苏格兰养殖的大马哈鱼(Salmosalar)以及野生的大马哈鱼肠道菌群进行研究,发现支原体属(Mycoplasma)占主要成分,在挪威和苏格兰养殖大马哈鱼肠道菌群中相对丰度分别为25%和81%,在野生大马哈鱼中的相对丰度为96%,该研究首次报道了在鱼肠道菌群中发现支原体,且为主要成分,其认为虽然支原体具有致病性,但在该鱼中是正常菌群的一部分,并在其健康和生理上可能发挥着某种未知的作用;Bano等[16]运用DGGE方法对来自美国加州5处盐沼的长嘴虾虎鱼(Gillichthysmirabilis)中的肠道菌群进行研究也发现支原体占优势地位,并认为其与该鱼为共生关系,但对其他物种来说可能为潜在的病原体;Li等[17]运用16S rRNA高通量测序的方法对我国扬子江上游30条不同性别和体重的圆口铜鱼(Coreiusguichenoti)的肠道内容物菌群进行研究,发现在属水平上雌性鱼主要以支原体属为主,且与体重无关,可能与该鱼食性以及雌鱼体内特殊的代谢活动有关。本研究结果与上述对不同种鱼类肠道微生物菌群的研究结果存在相似性,说明支原体在鱼肠道菌群中大量存在是可能的,且为肠道正常菌群的一部分,但对宿主以外,特别是与其密切接触的生物来说支原体可能为潜在的病原菌[16]。
支原体是一类广泛存在于人和动物体内,隶属支原体科,柔膜菌纲,革兰氏阴性[18-20],为能够在宿主之外进行自我复制的最小和最简单的生命形式。到目前为止,支原体包含超过100个物种,其中许多为人类和各类动物的病原菌,引起了医学和兽医领域的广泛关注[21-23]。虽然多年来支原体一直被认为是宿主特异性的,但某些菌株在人与动物宿主间的交叉感染已被报道[19]。Hu等[24]报道了1994—2007年,血营养支原体(Hemotrophicmycoplasma)导致了我国人畜共患病的爆发,其在猪、牛、羊和狐狸以及与其密切接触的农民和兽医中广泛流行。支原体可能通过粘膜表面的亲密接触和物质转移而被宿主获得[19]。而支原体通过皮肤创伤进入健康个体可能会对其构成潜在的危险,即使支原体在其自然宿主中不具有致病性。Hill[25]曾报道了一名微生物学家操作豚鼠时,拇指意外被含有支原体(Mycoplasmacaviae)的液体感染,造成了整个手的充血肿胀和疼痛。而该支原体发现于豚鼠中但对啮齿类动物没有致病性。Baker等[26]曾报道了一名被海豹咬伤的水族馆驯兽师的手指感染了支原体Mycoplasmaphocacerebrale造成疼痛和肿胀,而该支原体也从咬人的海豹前牙中分离出来,证实了支原体通过伤口从海豹传染至人的过程。有报道称动物支原体经常从免疫功能低下的人群中分离出来,并对其造成感染[27-28],且通常是由易感人群与家畜持续和密切接触造成的。Armstrong等[29]曾报道了一位因子宫颈转移癌接受抗肿瘤(和免疫抑制)化疗的病人,患上了一种与她的宠物狗类似的呼吸道疾病。患者曾与狗有过非常密切的接触史。在狗和人的喉咙里都有犬支原体(Mycoplasmacanis),且都对这种支原体有血清学的反应。McCabe等[30]曾报道了一名兽医在猫抓伤后患有软组织蜂窝织炎,而从该兽医感染的手中唯一分离出来的是一种未知的支原体,后来被证明是猫呼吸道支原体菌群的一部分。上述报道表明支原体在动物和人之间通过咬伤、抓伤和密切接触传播的可能,从而成为人潜在的病原菌。因此,支原体在人和动物不同物种之间转移是可能的。
鉴于支原体广泛地分布于动物中,目前对于动物是如何获得支原体的尚待进一步研究。在处理相关生物材料时应考虑支原体可能通过交叉污染传播的潜在危害。许多关于支原体跨物种屏障传播的报道可反映出由于支原体的高突变率,其对不同宿主的适应性可能比之前认为的要更强。此外有免疫缺陷或遭受生理变化(如压力)的人或动物,可能更容易感染外来支原体,从而产生潜在的致病后果[19]。
总之,本研究通过16S rRNA高通量测序技术发现带鱼肠道菌群中支原体为优势菌,且相对丰度较高。而作为人们经常食用的鱼类品种之一,在对带鱼进行处理和加工过程中,其肠道内容物极易暴露在环境中,存在支原体通过气溶胶或接触传播污染的可能[31]。在目前没有相关有效疫苗的情况下[32],从而对人,尤其是免疫功能低下或手部有伤口的人群可能会造成潜在感染。因此,下一步需要扩大样本量对我国东海带鱼肠道菌群做深入研究,明确支原体污染来源,在引起人们的关注和重视的同时做好相应的防护措施。

