TGF-β1表达与舌鳞癌发生发展的相关性研究
刘金刚 刘本艳 游云华
[摘要] 目的 觀察转化生长因子-β1(Transforming growth factor-beta 1,TGF-β1)在舌不典型增生及舌鳞癌的表达情况,探讨其与舌鳞癌临床病理的关系。 方法 收集2010~2015年病理科保存的20例正常舌黏膜、20例舌不典型增生、35例舌鳞癌病例,应用S-P免疫组织化学法检测TGF-β1表达情况,对其表达水平结合临床病理资料进行统计学分析。 结果 TGF-β1表达在正常舌黏膜组,非典型性增生组和舌鳞癌组表达有差异(P<0.05)。TGF-β1阳性表达率与舌癌的TNM分期呈正相关,有淋巴结转移组与无淋巴结转移组表达率差异有统计学意义(P<0.05),TGF-β1在5年内有复发组表达率高(P<0.05)。 结论 TGF-β1在非典型增生组和舌鳞癌组,在有转移淋巴结和术后5年复发的舌鳞癌组阳性率表达高,TGF-β1的检测可能有助于判断舌癌的发生发展。
[关键词] 舌鳞癌;舌白斑;转化生长因子β1;免疫组化
[中图分类号] R737.1 [文献标识码] A [文章编号] 1673-9701(2020)04-0012-03
Correlation between TGF-β1 expression and development of tongue squamous cell carcinoma
LIU Jingang1 LIU Benyan1 YOU Yunhua2
1.Department of Stomatology, Zhuhai People's Hospital, Zhuhai 519000, China; 2.Department of Stomatology, the Fifth Affiliated Hospital Sun Yat-Sen University, Zhuhai 519000, China
[Abstract] Objective To observe the expression of transforming growth factor-β1(TGF-β1) in tongue dysplasia and tongue squamous cell carcinoma. To explore its clinical and pathological correlation with tongue squamous cell carcinoma. Methods Twenty specimens of normal tongue mucosa, twenty specimens of tongue atypical hyperplasia and thirty-five specimens of tongue squamous cell carcinoma were collected from specimens that were stored in the Department of Pathology from 2010 to 2015. The expression of TGF-β1 was detected by S-P immunohistochemistry. The TGF-β1 expression level was analyzed using statistical analysis, in combination of clinical pathological data. Results TGF-β1 expression was found to be different in specimens of normal tongue mucosa, tongue atypical hyperplasia and tongue squamous cell carcinoma(P<0.05). The positive expression rate of TGF-β1 was positively correlated with the TNM stage of tongue cancer. There was significant difference in the expression rate between the lymph node metastasis group and the none lymph node metastasis group(P<0.05). The expression rate of TGF-β1 was high in the recurrence group within 5 years(P<0.05). Conclusion The positive expression rates of TGF-β1 are high in the tongue atypical dysplasia group, the tongue squamous cell carcinoma group, the tongue squamous cell carcinoma with metastatic lymph nodes and the recurrence group within 5 years after operation. The detection of TGF-β1 is helpful in predicting the occurrence and development of tongue cancer.
[Key words] Tongue squamous cell carcinoma; Tongue leukoplakia; Transforming growth factor-β1; Immunohistochemistry
舌鳞癌是最常见的口腔鳞状上皮细胞癌,其发病率在近几年呈逐渐上升的趋势[1]。舌鳞癌发生发展的机制尚未阐明,但临床观察和动物实验研究发现,大约80%的舌鳞癌的发生都具有明确的癌前损害(premalignant lesion)阶段,即由正常黏膜到癌前病变再到舌鳞癌。16%~32%的口腔鳞癌与常见的口腔鳞癌癌前病变——白斑有关,即部分白斑可能发展成鳞状细胞癌。癌的发生、发展由上皮和间质交互作用所构成的肿瘤-宿主界面微环境的平衡状态所决定的。有证据表明,肿瘤间质的改变先于上皮恶性改变,由此可以推测,检测出现于肿瘤间质的肿瘤异常蛋白具有重要的意义[2]。因此从分子水平来认识舌鳞癌变发生发展的过程,了解其表达差异在不同病理分级、临床分期、淋巴转移的病例的差异意义重大。在肿瘤进展过程中,TGF-β1可通过通过促进上皮间质转化和肿瘤转移,可以促使肿瘤发生发展[3]。TGF-β1可能是影响口腔鳞癌患者生存率的独立影响因素[4]。
1 資料与方法
1.1 一般资料
收集中山大学附属第五医院,珠海市人民医院病理科2010年5月~2015年3月保存,口腔颌面外科门诊活检及手术切除的病例,所有病例术前均未行放射治疗和化学治疗及其他相关的抗肿瘤治疗。舌鳞癌组35例,均行舌鳞癌根治术及颈淋巴结清扫术,按2003年国际抗癌联盟(UICC)对口腔癌的TNM分期标准进行分类,其中:Ⅰ期11例,Ⅱ期14例,Ⅲ期10例;按病理学分级:高分化鳞癌22例,中分化鳞癌10例,低分化鳞癌3例。术后病理证实有淋巴结转移的16例,无淋巴结转移的19例;其中男18例,女17例;年龄32~68岁,中位年龄51岁。非典型性增生组20例,选取同期手术切除,病理证实有异常增生的舌白斑20例。其中男10例,女10例;年龄25~68岁,中位年龄48岁。正常舌黏膜组20例,切取舌白斑旁正常黏膜组织作为对照。三组病例资料比较,差异无统计学意义(P>0.05),具有可比性。上述标本均经过组织病理学检查证实,并经病理科医生重新切片。
1.2 免疫组化方法检测
免疫组织化学采用S-P法,试剂盒为美国Neomarker产品,购自福建迈新公司,其中S-P试剂盒为即用型,其余浓缩型抗体稀释度均为1:50,采用微波抗原修复。显微镜下观察染色情况。
1.3 结果判断
TGF-β1阳性为胞质着色,所有阳性表达均为棕黄色,定位于细胞浆及细胞膜,以阳性细胞数量作为观察指标,以细胞的染色深浅及阳性细胞所占百分率按以下方式进行评价。A、按切片中细胞显色有无及深浅评分:0分:无着色;1分:浅黄色;2分:棕黄色;3分:棕褐色;B:按阳性细胞所占的百分比评分:阳性细胞比例10%以下记作0分,10%~50%为1分,50%以上为2分,每例积分=A+B,A+B<3分计为阴性,≥3分为阳性[5]。
1.4 统计学方法
采用SPSS16.0统计学软件进行数据分析,计数资料用[n(%)]表示,采用χ2检验,非正态计量资料用中位数表示,采用非参数检验,等级资料采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1在正常舌黏膜组织、非典型性增生、舌鳞癌中的表达
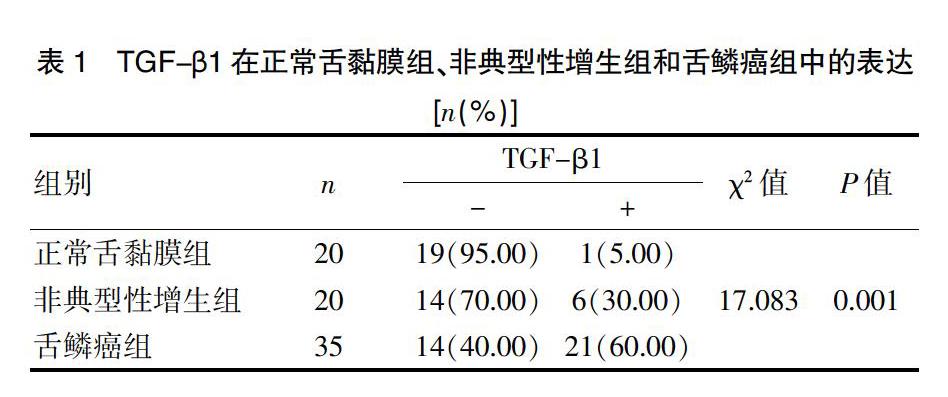
TGF-β1的阳性颗粒弥散地分布于胞浆内,呈棕黄色。在正常口腔黏膜组织中部分病例阳性表达见于上皮粒、棘层,部分病例阳性表达见于上皮全层。在非典型性增生病变中,阳性表达主要见于粒、棘层,呈带状分布。在舌鳞癌中,多数阳性表达癌巢中心和肿瘤浸润边缘,某些血管内皮细胞液有阳性表达。TGF-β1在正常舌黏膜组织、白斑、舌鳞癌中的表达阳性强度依次升高,组间差异有统计学意义(P<0.01)。见表1。
2.2 TGF-β1与舌鳞癌分期及术后5年复发的关系
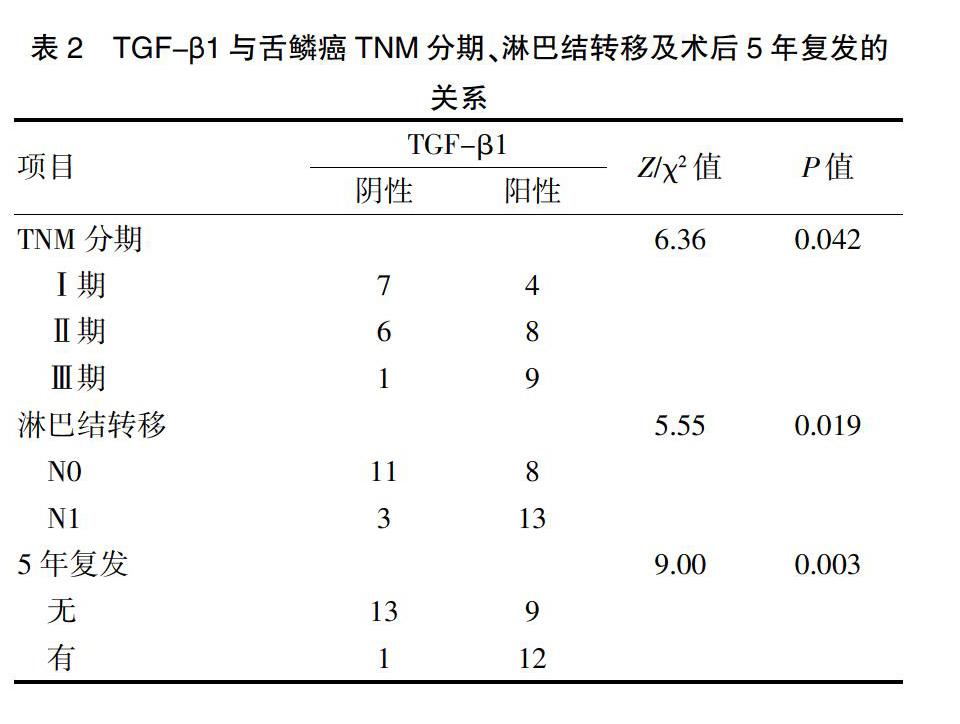
TGF-β1在舌鳞癌Ⅰ~Ⅲ期表达的阳性率有差异(P<0.05)。TGF-β1在有淋巴结转移组的阳性率(81.25%)高于无淋巴结转移组(42.11%),差异有统计学意义(P<0.05)。在5年内有复发的患者组高于无复发的患者组(P<0.05)。见表2。
3 讨论
TGF-β1是一种由多种类型细胞分泌的多肽类生长因子,基因定位于人染色体19q13.1带上。TGF-β1是细胞内广泛存在的丝/苏氨酸蛋白激酶超家族中最重要的一员,其可将细胞外信号传至细胞内,参与多种细胞的生理、病理过程,如细胞增殖分化、胚胎发育、肿瘤发生、血管形成等[6,7]。以往认为TGF-β1对体内多种上皮源性细胞及多种肿瘤细胞具有生长抑制作用,但现在更多的研究认为TGF-β1在肿瘤发生早期可能作为肿瘤抑制因子起作用,而随着肿瘤发展,其可促进肿瘤生长加速[8]。TGF-β1早期抑制肿瘤发生可能与以下机制有关:(1)TGF-β1通过抑制原癌基因C-myc的表达使细胞生长停滞于G期水平或延长G期。(2)其能使p53蛋白及Rb蛋白去磷酸化,而p53蛋白及Rb蛋白是抑癌基因野生型p53及Rb的表达产物,去磷酸化后的p53蛋白及Rb蛋白对肿瘤的形成具有抑制作用。(3)对周期蛋白依赖性激酶及周期蛋白可发挥抑制作用。周期蛋白依赖性激酶及周期蛋白是细胞完成其生长周期所必需的。冯庆辉等[9]应用免疫组化研究舌白斑及鳞癌的结果表明,有上皮异常增生的细胞染色程度高于正常黏膜及单纯性白斑组,鳞癌组又高于异常增生组,癌症细胞分化程度越低,染色越浓且着色面积广泛。这与我们的研究结果相似。对20例正常舌黏膜、20例不典型增生白斑和35例浸润性癌组织行TGF-β1蛋白免疫组化检测发现,TGF-β1表达阳性率随着由正常黏膜向癌症过渡也率逐渐增高。提示检测癌前病变组织中的TGF-β1表达,对舌癌的早期诊断意义重大。
肿瘤的形成是一个复杂的过程,而细胞基质改变和血管的形成易于肿瘤的发展浸润与转移。一般认为TGF-β1通过以下途径促进肿瘤的发展转移[10-12]:(1)拮抗机体免疫调节,使肿瘤细胞逃避机体的免疫监视,促进肿瘤细胞恶性增长。TGF通过抑制T和B淋巴细胞增殖、分化,抑制NK细胞和单核细胞的杀伤活性,抑制免疫球蛋白合成和免疫调节因子的作用,减少机体对肿瘤细胞生长抑制。(2)促进细胞外基质形成。TGF-β1分泌增多可增强蛋白水解酶活性,增加间质胶原的降解,从而降低癌细胞间的黏附力而易发生转移。(3)促进基质蛋白合成与分泌。(4)TGF-β1也是一种促血管生成因子,参与肿瘤新生血管的形成,为肿瘤生长提供营养,促使肿瘤增值。而肿瘤新生血管由于基底膜不完整,通透性高,癌细胞易脱落利于局部浸润和进入血管淋巴系统,致使淋巴转移。王晓冰等[13]报道TGF-β1高表达与乳腺癌细胞的浸润,组织学分期和淋巴转移显著相关,揭示乳腺癌细胞内增高的TGF-β1有助于癌细胞的侵袭和转移。Kinugasa S等[14]应用免疫组化技术对50例胃癌手术后患者进行回顾研究发现TGF-β1高表达者5年生存率明显低于TGF-β1低表达者。Schuster N等[15]曾对口腔鳞癌患者血清TGF-β1的前瞻性研究表明,血清TGF-β1水平与对照组相比,进展期口腔鳞癌的淋巴结状态、TNM分期、组织学分级均与TGF-β1高水平相关。TGF-β1的表达与口腔鳞状细胞癌进展相关[16]。
本研究中,舌癌的TNM分期越高,TGF-β1表达越强。术后证实有淋巴结转移的患者组显著高于无淋巴结转移的组。患者术后5年内复发的组又高于无复发的患者组。因此对舌癌患者TGF-β1检测可能有助于判断舌癌的发展并对颈淋巴结有无微转移灶的危险性作分子生物学方面的评估,可以发现实际有转移而临床和影像上未被发现的隐匿转移,从而指导手术方案,并可对患者预后进行评估。
[参考文献]
[1] Kantola S,Parikka M,Jokinen K.Prognostic factors in tongue cancer-relative importance of demographic,clinical and histopathological factors[J].Br J Cancer,2000,83(5):614-619.
[2] Liotta LA,Kohn EC. The microenvironment of the tumour-host interface[J].Nature,2001,411(6835):375-379.
[3] Colak S,Ten Dijke P.Targeting TGF-β signaling cancer[J].Trends Cancer,2017,3(1):56-71.
[4] 陆展翼,胡勤刚,陈盛,等.口腔鳞状细胞癌组织TGF-β1表达和临床病理学参数对预后的影响[J].口腔医学研究,2019,35(5):24-29.
[5] 许良中.实用肿瘤病理方法学[M].上海:上海人民出版,1997:223-224.
[6] Barron DA,Strand DW,Ressler SJ,et al.TGF-β1 induces an age-dependent inflammation of nerve ganglia and fibroplasia in the prostate gland stroma of a novel transgenic mouse[J].Plo S One,2010,5(10):e13571.
[7] 蔡梦月,郝美玲,李春辉.Oct4与TGF-β信号通路相关因子在胃癌组织中的表达和相互关系[J].承德医学院学报,2017,(3):185-187.
[8] 刘晨,王莉,张保莲,等.TGF-β和E-cadherin在子宮颈鳞状细胞癌表达的临床意义[J].中国妇产科临床杂志,2016,14(1):191-192.
[9] 冯庆辉,姜日文,王颖,等.转化生长因子β1在舌白斑及鳞癌中的表达[J].现代口腔医学杂志,2000,14(3):191-192.
[10] 白植宝,陈伟良,王永洁,等.TGF-β1/iNOS在Tca8113细胞系中的表达[J].口腔颌面外科杂志,2009,19(40): 243-247.
[11] Lou HZ,Wu JM,Chen LR,et al.Expression of transforming growth factorβ-1 and its prognostic value in breast cancer[J].China Oncology,2000,3:12-16.
[12] Sanjeev Mariathasan,Shannon J. Turley, Dorothee Nickles,et al. TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells[J].Nature,2018,554(22):543-546.
[13] 王晓冰,李春英,庞恩桥,等.乳腺癌组织中TGFβ1、VEGF、C-erbB-2的表达及其与浸润转移的关系[J].实用癌症杂志,2002,17(4):356-358.
[14] Kinugasa S,Abe S,Tachibana M,et al.Overexpression of transforming growth factor—beta l in scirrhous carcinoma of the stomach correlates with decreased survival[J].Oncology,1998,55(6):582-587.
[15] Schuster N,Krieglstein K.Mechanisms of TGF-beta-mediated apoptosis[J].Cell & Tissue Res,2002,307(1):1-14.
[16] 于烁,丁丽娜,李乾鹏,等.TGF-β1和Smad7在口腔鳞状细胞癌中的表达及意义[J].北京口腔医学,2019,27(2):26-29.
(收稿日期:2019-10-09)

