敲减G蛋白偶联受体75表达抑制20-HETE诱导的H9c2心肌细胞凋亡*
毛 凌, 陆光金, 唐清清, 李小红, 任啟旭, 韩 勇, 陈远寿
(遵义医科大学生理学教研室, 贵州 遵义 563000)
20-羟二十烷四烯酸(20-hydroxyeicosatetraenoic acid, 20-HETE)是由细胞色素P-450催化花生四烯酸ω-羟基生成的血管活性物质。动物实验及临床研究表明20-HETE具有促使血管平滑肌收缩、诱导内皮功能紊乱、促进炎症因子表达以及诱导细胞凋亡等作用,与高血压、脑卒中、心肌梗死和心肌肥大等心血管疾病的发生、发展密切相关[1-2]。
G蛋白偶联受体75(G-protein-coupled receptor 75, GPR75)属于G蛋白偶联受体家族中视紫红质样受体,其功能尚不明确,目前被国际基础和临床药理学委员会列为孤儿受体[3]。最近,Garcia等[4]报道20-HETE通过激活GPR75导致血管平滑肌细胞收缩以及内皮功能紊乱,从而诱导CYP4A12转基因小鼠发生20-HETE依赖性高血压。20-HETE-GPR75受体配对机制在血管系统中的发现,对研究GPR75的生物学作用以及20-HETE在心血管疾病中的病理、生理作用具有重要意义。然而,GPR75是否在心脏组织中表达并介导20-HETE的心肌损伤作用,尚未见相关报道。本实验通过体外培养大鼠H9c2心肌细胞,观察GPR75的表达及其对20-HETE诱导心肌细胞凋亡的影响,为探究20-HETE参与缺血性心肌病的分子机制提供参考资料。
材 料 和 方 法
1 材料
1.1细胞系 H9c2心肌细胞购自中国科学院上海细胞库,用完全培养基于37 ℃、5% CO2细胞培养箱中培养,取对数生长期的细胞实验。
1.2主要试剂 20-HETE购自Sigma;慢病毒包装试剂盒购自GeneCopoeia;TUNEL细胞凋亡检测试剂盒及JC-1荧光探针购自上海碧云天公司;RT-qPCR引物由上海捷瑞公司合成;逆转录试剂盒及荧光SYBR GreenI购自TaKaRa;Caspase-3活性检测试剂盒购自索莱宝科技有限公司;兔抗Bax抗体、兔抗Bcl-2抗体及兔抗GPR75抗体购自Abcam;兔抗细胞色素C(cytochromeC, CytC)抗体购自Cell Signaling Technology;抗β-actin抗体及HRP标记的Ⅱ抗购自Proteintech。
2 主要方法
2.1细胞转染 将2×105个细胞接种至6孔板,待细胞融合度达到60%~70%进行转染。分别加入慢病毒载体[GPR75 shRNA (shGPR75)和control shRNA (shCtrl)]和完全培养基(MOI=5),培养箱中转染24 h,更换为完全培养基继续培养48 h,采用RT-qPCR和Western blot检测转染效率。细胞随机分为6组:对照(control)组、20-HETE(100 nmol/L)组、shCtrl+20-HETE(100 nmol/L)组、shGPR75+20-HETE(100 nmol/L)组、shCtrl组和shGPR75组。各加药组细胞继续培养24 h后进行实验。
2.2TUNEL法检测细胞凋亡 多聚甲醛固定心肌细胞,TUNEL反应液避光孵育,DAPI显色,甘油封片,于荧光显微镜下观察,随机挑选5个200倍视野,计算平均每100个细胞中含凋亡细胞的数量。
2.3Bcl-2、Bax及GPR75的mRNA表达 收集各组细胞,TRIzol法提取细胞总RNA,按逆转录试剂盒说明书合成cDNA。Bcl-2的上游引物序列为5′-TCAGGCTGGAAGGAGAAGAT-3′,下游引物序列为5′-GGGGTACGAGTGGGATA-3′; Bax的上游引物序列为5′-GGTCCCGAAGTAGGAAAGG-3′,下游引物序列为5′-GCAAACTGGTGCTCAAGG-3′;GPR75的上游引物序列为5′-GCCACAAGCCTGGTCTACAAA-3′,下游引物序列为5′-GTGCTCTGGTGCCTGCGATAC-3′;GAPDH的上游引物序列为5′-TCTCTGCTCCTCCCTGTTC-3′,下游引物序列为5′-ACACCGACCTTCACCATCT-3′。反应条件为:预变性94 ℃ 30 s;变性94 ℃ 5 s,退火60 ℃ 30 s,共40个循环。GAPDH为内参照,2-ΔΔCt法计算Bcl-2、Bax及GPR75 mRNA的相对表达量。
2.4线粒体膜电位(ΔΨm)检测 清洗细胞后,加入JC-1荧光探针避光孵育,清洗多余染料,激光共聚焦显微镜下观察。正常ΔΨm在激发波长585 nm、发射波长590 nm下产生红色荧光;ΔΨm降低时,在激发波长514 nm、发射波长529 nm下产生绿色荧光,采用LAS AF Lite 2.6 软件分析平均红色荧光强度与平均绿色荧光强度的比值,反应细胞线粒体膜电位变化。
2.5caspase-3活性检测 收集各组细胞,Bradford法检测蛋白浓度。于等量细胞蛋白提取液中加入反应缓冲液和底物共同孵育,酶标仪于405 nm波长下测定游离对硝基苯胺(p-nitroaniline,pNA)吸光度(A)反映caspase-3酶活性。
2.6Western blot检测蛋白表达水平 收集各组细胞,BCA法检测蛋白浓度。等量蛋白进行SDS-PAGE,转膜后封闭,分别加入Ⅰ抗(鼠抗β-actin、兔抗CytC、兔抗GPR75、兔抗Bax和兔抗Bcl-2), 4 ℃孵育过夜,再加入Ⅱ抗室温孵育1 h。ECL法显影,暗室曝光,ImageJ 1.48软件分析,以β-actin 作为内参照,以靶蛋白与β-actin的比值反应蛋白表达水平。
3 统计学处理
所有数据均用SPSS 13.0统计软件进行分析,计量资料以均值±标准差(mean±SD)表示,组间比较采用单因素方差分析及LSD-t法,以P<0.05为差异有统计学意义。
结 果
1 慢病毒shGPR75感染H9c2心肌细胞后GPR75 mRNA及蛋白的表达
与control组相比,转染了shGPR75的心肌细胞GPR75 mRNA及蛋白的表达分别降低了71.24%和64.95% (P<0.05,),而转染了shCtrl的心肌细胞中GPR75 mRNA及蛋白的表达与control组无显著差异(P>0.05),见图1。
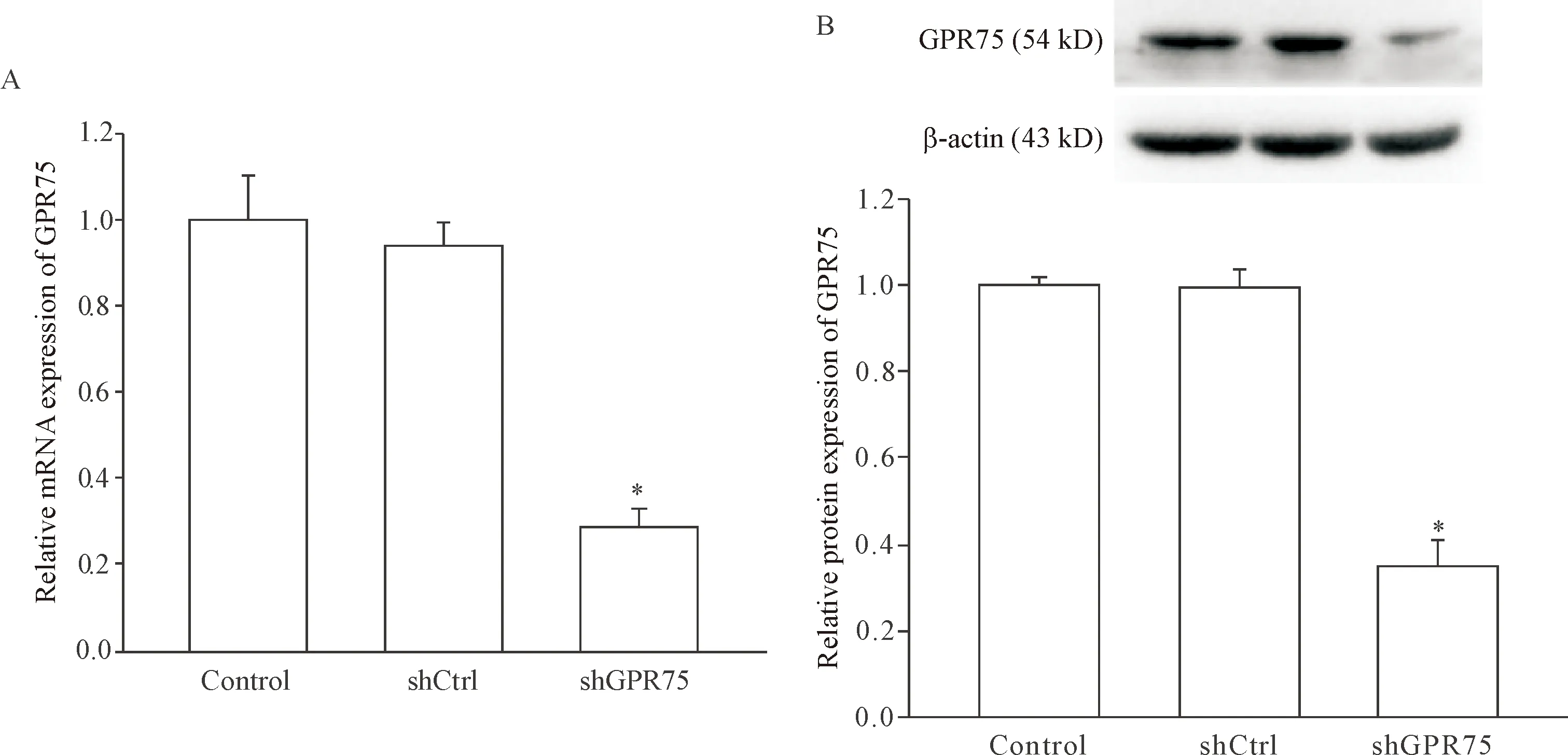
Figure 1.The effects of shGPR75 transfection on mRNA and protein expression of GPR75 in H9c2 cells. A: the mRNA expression of GPR75 was detected by RT-qPCR; B: the protein expression levels of GPR75 were detected by Western blot. Mean±SD.n=4.*P<0.05vscontrol group and shCtrl group.
图1 转染shGPR75对GPR75 mRNA和蛋白表达的影响
2 敲减GPR75对20-HETE诱导心肌细胞凋亡的影响
与control组相比,使用20-HETE处理后心肌细胞凋亡率显著增加(P<0.05);心肌细胞转染sh-GPR75,敲减GPR75表达后,20-HETE诱导的细胞凋亡率下降(P<0.05);作为阳性对照,采用20-HETE处理转染了shCtrl的心肌细胞后细胞凋亡率亦显著增加(P<0.05);单独转染shCtrl和shGPR75组与control组无显著差异(P>0.05),见图2。
3 敲减GPR75对20-HETE诱导的Bax和Bcl-2表达的影响
与control组相比,20-HETE处理组心肌细胞中Bax的mRNA表达增加,Bcl-2的mRNA表达降低(P<0.05);敲减GPR75后,与20-HETE处理组相比,Bax的mRNA表达降低,Bcl-2的mRNA表达增加(P<0.05),见图3A。与mRNA表达水平的变化一致,20-HETE处理后心肌细胞Bax蛋白表达增加,Bcl-2蛋白表达下调,而敲减GPR75显著抑制了20-HETE这种作用(P<0.05),单独转染shCtrl和shGPR75组与control组无显著差异(P>0.05),见图3B。
4 敲减GPR75阻断20-HETE诱发细胞线粒体膜电位下降
与control组相比,20-HETE处理组细胞ΔΨm显著下降,而敲减GPR75显著抑制了20-HETE诱导的ΔΨm下降(P<0.05),20-HETE处理转染了shCtrl的心肌细胞后ΔΨm亦下降(P<0.05),单独转染shCtrl和shGPR75组与control组无显著差异(P>0.05),见图4。
5 敲减GPR75抑制20-HETE诱导的CytC蛋白表达增高及caspase-3活性增强作用
20-HETE处理H9c2心肌细胞后,CytC蛋白表达与control组相比显著增高(P<0.05),同时,caspase-3活性显著增强(P<0.05);而敲减GPR75显著阻断了20-HETE诱导的CytC蛋白表达增高和caspase-3活性增强作用(P<0.05); 20-HETE处理转染了shCtrl的心肌细胞后CytC蛋白表达亦升高(P<0.05),caspase-3活性亦增强(P<0.05);单独转染shCtrl和shGPR75组与control组无显著差异(P>0.05),见图5。
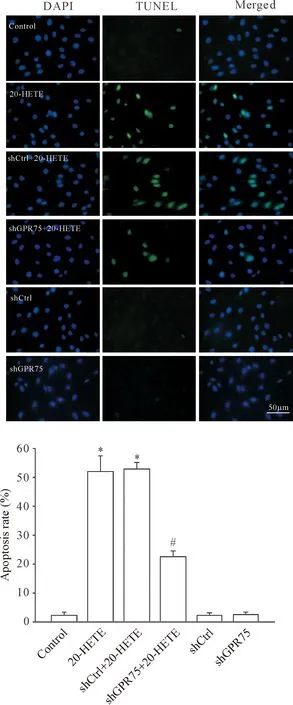
Figure 2.The effects of knockdown ofGPR75on 20-HETE-induced cardiomyocyte apoptosis detected by TUNEL staining. The scale bar=50 μm. Mean±SD.n=4.*P<0.05vscontrol group and shCtrl group;#P<0.05vs20-HETE group and shCtrl+20-HETE group.
图2 敲减GPR75对20-HETE诱导心肌细胞凋亡的影响
讨 论
作为近年发现的心血管活性物质,20-HETE发挥生理、病理作用的受体机制一直受到学者关注。最近,有研究者[4-5]通过点击化学交联和伴侣蛋白分析等方法,在血管平滑肌细胞和内皮细胞中鉴定出GPR75与20-HETE绑定并介导20-HETE依赖性高血压,提示20-HETE通过与GPR75受体配对机制发挥生物学作用。之前曾有学者报道,大鼠胰岛β细胞中炎症趋化因子CCL5通过GPR75受体介导促进胰岛素的分泌[6-7],但一项基于β-arrestin的G蛋白偶联受体检测实验未能证实CCL5对GPR75的激活作用[8]。本实验在大鼠H9c2心肌细胞中观察到GPR75在mRNA及蛋白水平均有表达,且敲减GPR75阻断了20-HETE诱导的细胞凋亡作用,提示GPR75与20-HETE在影响心脏功能方面存在密切关系,为研究20-HETE-GPR75受体配对机制提供了新的实验证据。后续实验需进一步证实20-HETE对心肌细胞中GPR75表达及激活的影响,以深入揭示二者作用关系。
研究显示在心肌缺血再灌注损伤(myocardial ischemia reperfusion injury, MIRI)中,心肌组织20-HETE含量增加,抑制其合成可减少再灌注后心肌梗死面积,而外源性加入20-HETE可加重心肌损伤[9]。大量证据表明细胞凋亡是MIRI主要特征之一,Wei等[10]证实抑制20-HETE生成可减少大鼠MIRI中细胞凋亡。我们前期在大鼠离体MIRI中的研究也显示,20-HETE可通过激活NADPH氧化酶途径诱导活性氧簇(reactive oxygen species, ROS)生成,引起氧化应激从而诱导细胞凋亡[11];在培养的乳鼠心肌细胞中,20-HETE可引起线粒体功能损伤激活内源性凋亡途径从而导致细胞凋亡[12]。与如上研究一致,本实验中观察到体外培养的H9c2心肌细胞经20-HETE孵育处理后,细胞凋亡率显著增加。
Bcl-2蛋白家族在线粒体凋亡途径中发挥重要作用[13],该蛋白家族主要通过促凋亡蛋白Bax和抗凋亡蛋白Bcl-2相互作用而发挥细胞凋亡的调控作用[14],其中Bax蛋白激活将引起线粒体膜电位下降,诱发线粒体释放凋亡因子CytC,活化细胞内凋亡关键蛋白caspase-3,从而诱导细胞凋亡[15]。细胞内Bax活化的具体机制尚不清楚,有研究报道细胞肿瘤抑制基因p53具有直接激活Bax基因以及下调Bcl-2表达作用[16]。20-HETE对于Bax蛋白活化机制尚未见报道,但以往研究表明20-HETE具有促进心肌细胞ROS生成作用[17],而ROS被认为是p53介导的线粒体凋亡途径的始动因子[18],因此,20-HETE诱导ROS生成引起的氧化应激是其激活Bax基因的可能途径。在本实验中观察到,20-HETE具有上调促凋亡蛋白Bax表达、下调抗凋亡蛋白Bcl-2表达的作用,同时诱发ΔΨm下降,导致线粒体功能损伤;而敲减GPR75显著阻断了20-HETE对于Bax/Bcl-2的调节作用,同时也抑制了20-HETE诱导的线粒体ΔΨm下降。线粒体通透性增高、ΔΨm下降可诱发凋亡相关因子释放,其中CytC蛋白的释放是内源性凋亡途径的关键步骤,一旦释放则启动不可逆凋亡[15]。本实验检测到20-HETE上调了CytC蛋白表达并促进caspase-3活性升高,而敲减GPR75后则抑制了20-HETE诱导的促进凋亡因子的释放,进一步证实GPR75介导了20-HETE诱导心肌细胞凋亡的作用。
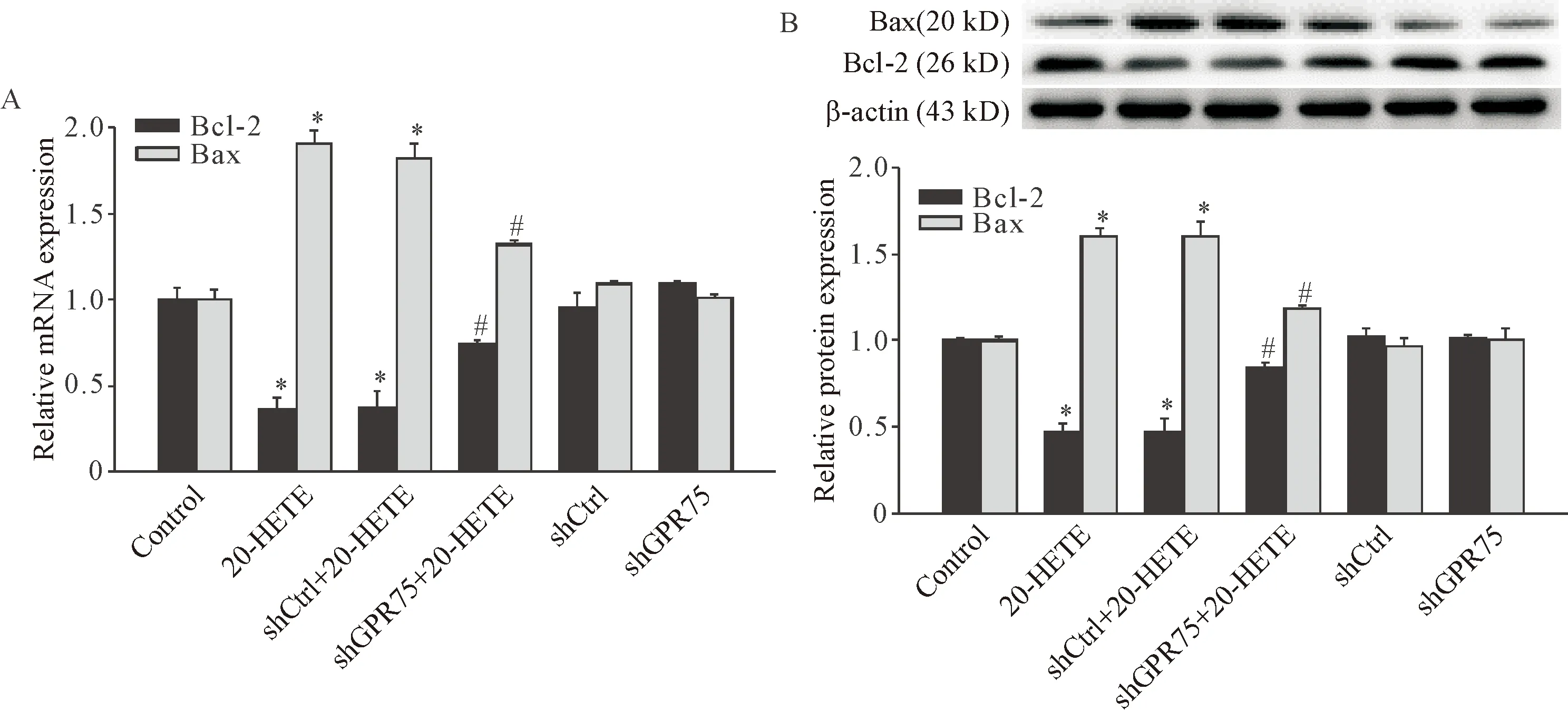
Figure 3.The effects of knockdown ofGPR75on mRNA (A) and protein (B) expression of Bax and Bcl-2 in H9c2 cells. Mean±SD.n=4.*P<0.05vscontrol group and shCtrl group;#P<0.05vs20-HETE group and shCtrl+20-HETE group.
图3 敲减GPR75对20-HETE诱导的Bax和Bcl-2表达的影响
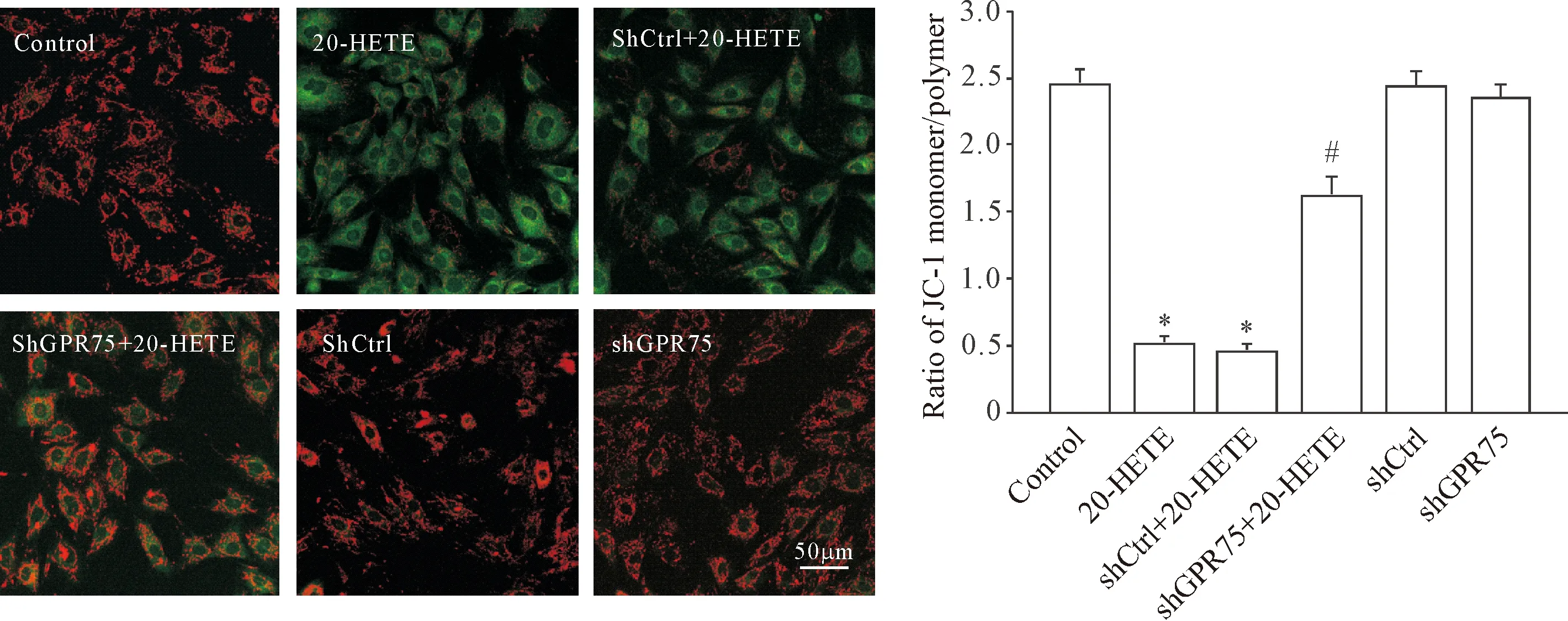
Figure 4.The effects of knockdown ofGPR75on 20-HETE-induced decrease inΔΨmlevel detected by JC-1 staining. The scale bar=50 μm. Mean±SD.n=4.*P<0.05vscontrol group and shCtrl group;#P<0.05vs20-HETE group and shCtrl+20-HETE group.
图4 敲减GPR75对20-HETE诱导的ΔΨm水平的影响
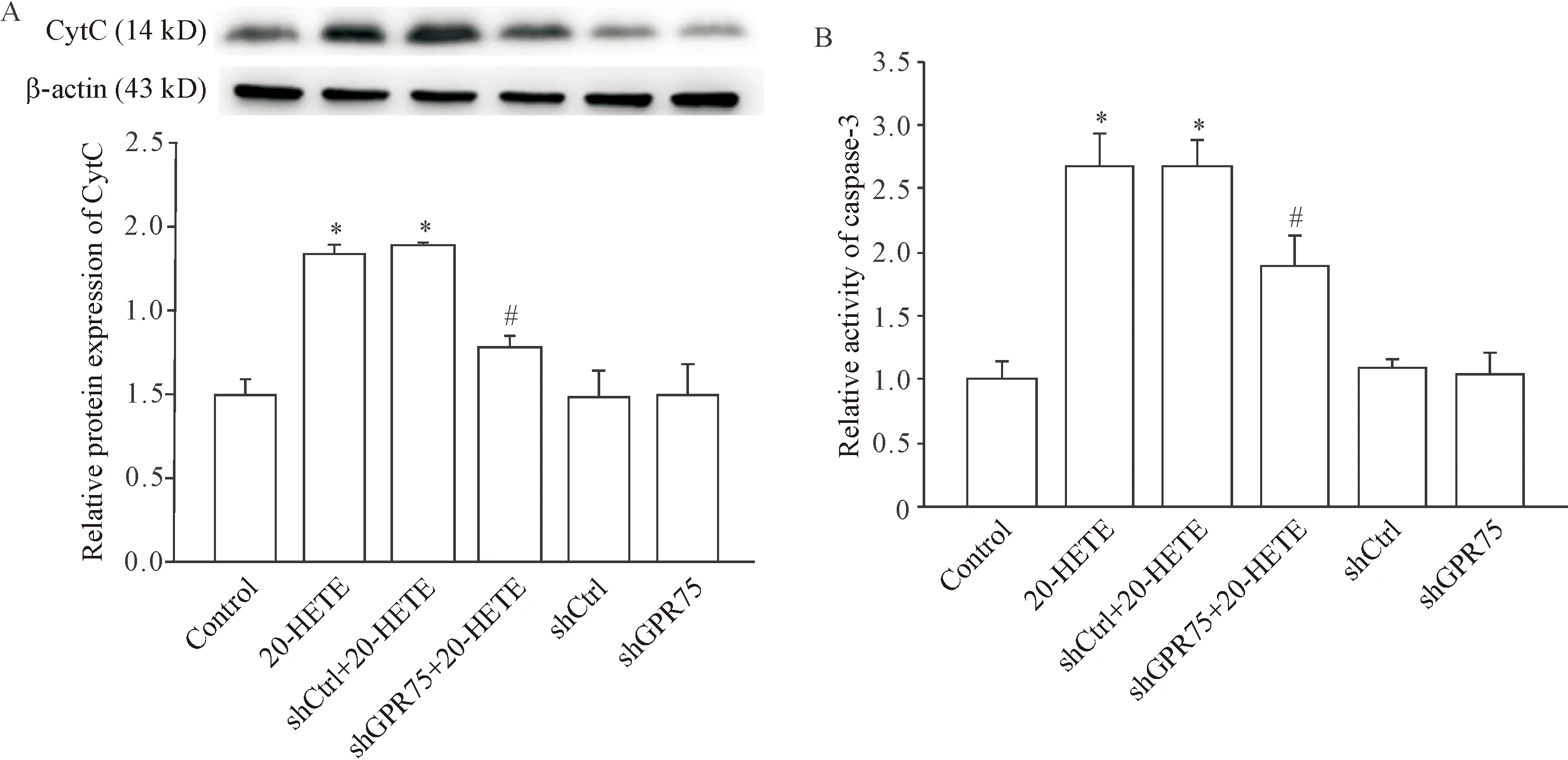
Figure 5.The effects of knockdown ofGPR75on 20-HETE-induced CytC expression (A) and caspase-3 activity (B). Mean±SD.n=4.*P<0.05vscontrol group and shCtrl group;#P<0.05vs20-HETE group and shCtrl+20-HETE group.
图5 敲减GPR75对20-HETE诱导的CytC表达及caspase-3活性的影响
综上所述,本实验观察到GPR75在大鼠H9c2心肌细胞中表达,并通过线粒体损伤机制参与20-HETE诱导的心肌细胞凋亡,为探索GPR75功能以及20-HETE在缺血性心肌病中的分子、细胞机制提供了实验依据。在心脏中,20-HETE还具有促进心肌细胞内ROS生成、诱发钙超载、导致心肌肥大等心肌损伤作用[17],这些效应是否同样由GPR75所介导,有待深入研究。

