运用思维模型巧答工艺流程题
黄一文
(福建省泉州市厦门外国语学校石狮分校 362700)
解化学工艺流程题,除了要熟练掌握常见无机物及其应用、反应原理、化学计算等的基础知识,还应具备较熟练的物质的分离与提纯的基本技能,解题的关键是读懂流程图,构建解题思维模型并灵活运用巧答题.
一、化学工艺流程题常见考点
化学工艺流程题融合了物质制备和分离提纯过程中有关元素化合物、离子反应、氧化还原反应、化学速率、化学平衡、电化学、反应条件控制、绿色化学等核心知识,常见考点为:
1.给信息的化学方程式的书写:考查信息素养、分类观、微粒观、转化观和守恒法.
2.基本实验操作:考查金属离子的逐步沉淀和分离、重结晶、过滤、沉淀的洗涤、蒸馏、萃取和分液等操作.
3.反应条件的选择:考查反应速率和化学平衡影响因素,反应温度、浓度、pH控制等.
4.化学计算:考查氧化还原、平衡常数、溶度积、转化率、产率、纯度等有关计算.
5.绿色化学:考查工艺的安全性和可操作性、减少污染、节约成本等问题.
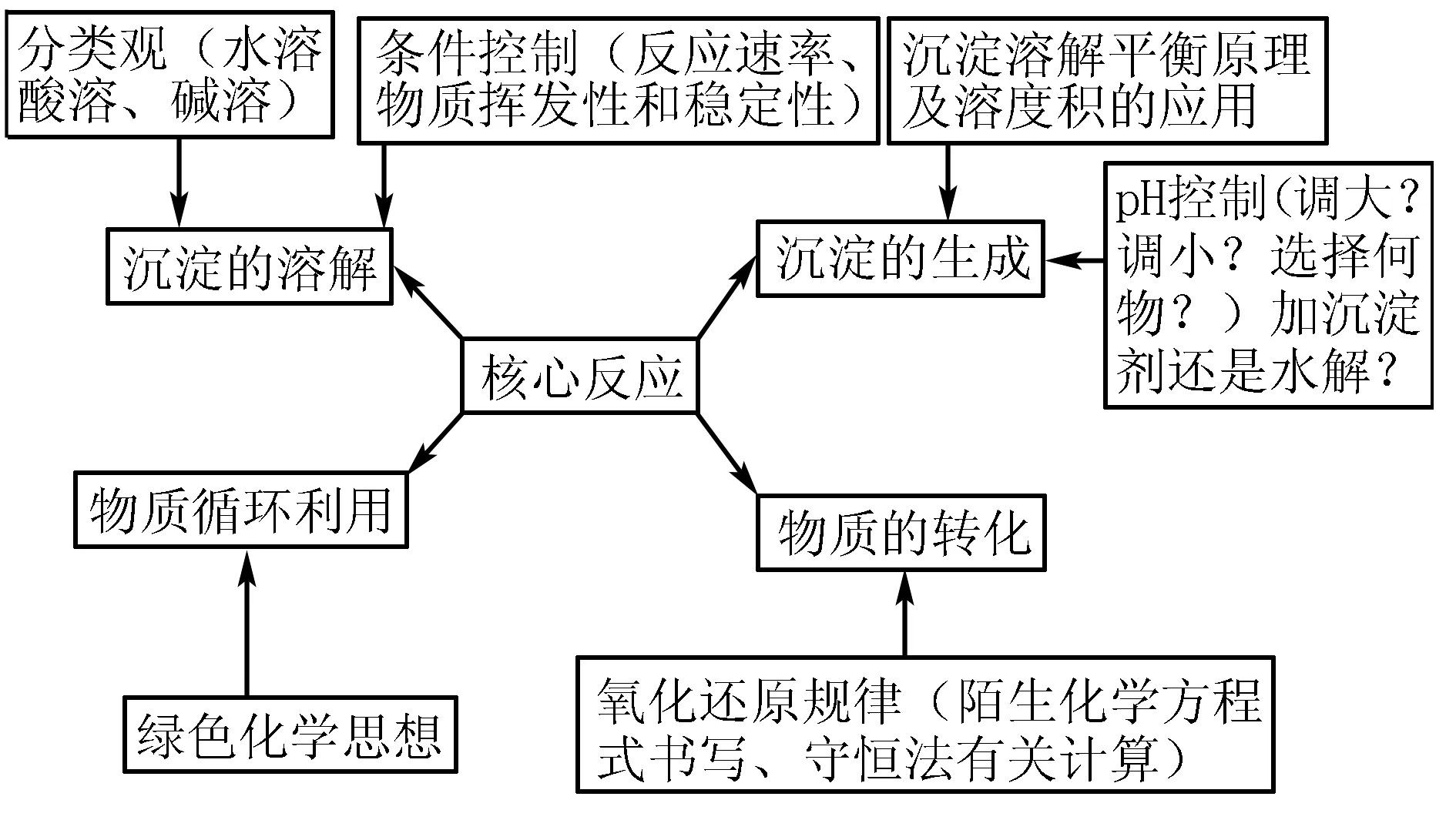
二、化学工艺流程题解题思维模型
思维模型如下图所示.
三、运用思维模型巧答工艺流程题示例
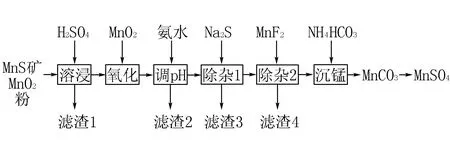
例[2019新课标Ⅲ] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示.回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:

金属离子Mn2+Fe2+Fe3+Al3+Mg2+Zn2+Ni2+开始沉淀的pH8.16.31.53.48.96.26.9沉淀完全的pH10.18.32.84.710.98.28.9
(1)“滤渣1”含有S和____;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____.
(2)“氧化”中添加适量的MnO2的作用是____.
(3)“调pH”除铁和铝,溶液的pH范围应调节为____~6之间.
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是____.
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+.若溶液酸度过高,Mg2+沉淀不完全,原因是____.
(6)写出“沉锰”的离子方程式____.
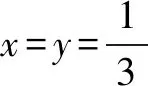

(2)考查分类观和转化观,根据实验室制氯气的反应和流程可知二氧化锰作为氧化剂,其作用是使MnS反应完全,且将溶液中Fe2+氧化为Fe3+.
(3)考查Fe3+和Al3+沉淀生成条件控制,由表中数据可知pH在4.7时,Fe3+和Al3+沉淀完全,所以pH应该控制在4.7~6之间.
(4)考查加沉淀剂Na2S的目的,是为了除去锌离子和镍离子,所以滤渣3是生成的沉淀ZnS和NiS.
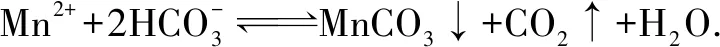
(7)考查守恒法的运用,根据化合物中各元素化合价代数和为0的规律得:1+2x+3y+4z=6,已知,x=y=1/3,带入计算得:z=5/6.
化学工艺流程题陌生度、整合度、灵活度较大,解题时既要明确试题的反应原理、考点、设问点,又要运用所学知识和信息读懂流程图的步骤含义,根据设问进行准确答题,只有构建解题思维模型并灵活运用思维模型指导答题,练就“化学的慧眼和思维的慧心”,触类旁通,领悟解题的规律性和技巧性,才能突破工艺流程题这一富有挑战的题型.

