18F-FMISO PET显像评价结直肠癌肝转移的实验研究
张茗昱 姜昊 张荣军 王振常 姜慧杰
结直肠癌(colorectal cancer,CRC)是全球第三大常见的癌症[1]。肝脏是 CRC转移最常见的部位,结直肠癌肝转移(colorectal liver metastasis,CLM)是影响患者生存率的关键因素[2]。肿瘤转移行为取决于肿瘤的遗传和微环境异质性,肿瘤异质性与其生物学行为、临床表现、预后和治疗反应息息相关[3,4]。CRC转移与否直接影响临床治疗决策,分子显像可以活体、无创、动态评估CRC的生物学行为,被认为是指导CRC个体化治疗的必要手段。
实体肿瘤的快速生长导致了组织内氧供不足[5],肿瘤乏氧与预后不良、侵袭性增强、血管生成、肿瘤浸润、肿瘤转移及放化疗抵抗密切相关[6,7]。在CRC患者中,肿瘤乏氧程度及乏氧区域决定了其转移潜能,准确评估肿瘤组织的乏氧状态可以有助于了解肿瘤生物学特性[8]。正电子发射显像(positron emission tomography,PET)是一种无创的功能成像方法,PET定量参数可以提供肿瘤空间异质性有关的信息,基于PET的肿瘤乏氧显像促进了我们在分子水平上对肿瘤生物学行为的理解,并有助于早期个体化治疗方案的制定[9,10]。18FFMISO示踪剂是检测和量化肿瘤乏氧最常见的示踪剂[11,12]。18F-FMISO属于亲脂性,容易穿过细胞膜并扩散到组织中,同时受血流影响小,并可选择性的在低氧细胞中结合,其2 h后的摄取分布可以准确反映氧供不足的区域[11,13],标准化摄取值(standardized uptake value,SUV)是18F-FMISO PET的定量参数,可用于量化肿瘤内低氧水平状况。目前,18F-FMISO显像已应用于胶质母细胞瘤、头颈癌、肺癌及乳腺癌等疾病中的诊断、评估生物学侵袭区域及预测预后[14-18]。然而,基于18F-FMISO显像预测CRC异种移植小鼠模型转移潜能的研究尚未报道。
本研究的目的是探究不同转移潜能CRC细胞系(LoVo、HT29和 HCT116)的肝转移生物学行为,基于细胞和动物水平分别从体外、体内进行18F-FMISO摄取和生物学指标的相关性进行研究。本研究有助于更好地了解CRC生物学行为,并发现用于指导个性化治疗所需的影像指标。
资料与方法
1.细胞培养
人CRC细胞系LoVo、HT29和HCT116购于中科院上海细胞库。LoVo细胞系培养于DMEM(Gibco Corporation,USA) 培养基中,HT29 和HCT116细胞系培养于McCoy's 5A培养基(Gibco Corporation,USA)中。所有培养基中加入10%的胎牛血清(Hyclone,USA)和 1%的青-链霉素(Beyotime Biotechnology,China)。细胞乏氧时,使用常规培养基,将细胞置于含 1%O2、5%CO2和 94%N2的乏氧培养箱中孵育24 h,孵育温度37℃。
2.CLM小鼠模型及CRC皮下异种移植小鼠模型的建立
选取 5周龄的BALA/C裸鼠(体重 16~18 g),购于常州卡文斯动物实验公司(常州,中国)。种植前3天所有实验动物适应性饲养于无菌室。动物室温和相对湿度分别设定在24℃和(55±10)%。动物研究按照江苏省原子医学研究所动物管理与使用委员会(IACUC)批准的方案进行。肝转移模型的建立方法是将LoVo,HT29和HCT116细胞悬液(5.0×106/0.15 ml)注射到麻醉的(混入纯氧中的2%异氟烷)裸小鼠脾脏内,同时保留脾脏,从而诱发肝转移的发生。皮下异种移植模型的建立方法是 将 LoVo(5×106)、HT29(5×106)及 HCT116(5×106)细胞悬液注射于左前肢皮下。手术完成后,每三天记录一次裸鼠的体重,Micro-PET显像后处死小鼠。
3.体外细胞摄取实验
18F-FMISO细胞摄取实验前,三种细胞需置于乏氧环境下进行预处理。CRC细胞、18F-FMISO示踪剂和缓冲液(含0.2%牛血清白蛋白的DMEM)加入到2 ml玻璃试管中混合,在37°C条件下分别孵育 30、60、120和 240 min。 自行标记 O管、T管、X管。其中O管(对照组):加入100 μl放射性核素和 200 μl缓冲液;T管: 仅加入 100 μl放射性核素用于测量放射性核素剂量;X管:加入100 μl放射性核素,100 μl细胞悬液和100 μl缓冲液。细胞数量为5×105个/管。孵育结束后,1000 rpm/min离心5 min,吸出O管和X管中的所有液体。采用自动伽马计数器(PerkinElmer,2480,USA)测量不同时间点每个中试管中的放射性计数。细胞体外核素摄取率:X(cpm)-0(cpm)/T(cpm)%。
4.18F-FMISO示踪剂的合成
用于18F-FMISO合成的多功能模块购于无锡市江源工业技术贸易公司,按文献的步骤进行合成[19]。18F-FMISO示踪剂的放射化学纯度均大于95%,最终比活度大于0.5 TBq/mmol。用于动物实验的18F标记的示踪剂在生理盐水中配制并通过0.22 μm Millipore 过滤。
5.Micro-PET显像及定量分析
CLM模型建立7周后、皮下异种移植瘤体积达1 cm3后行18F-FMISO Micro-PET显像,使用3D Inveon Micro-PET 扫描仪(Siemens)采集小鼠Micro-PET图像。使用Inveon Acquisition Workplace工作站(Version 2.0,Siemens)进行基于有序子集期望最大化的图像重组,矩阵:128×128×159;像素尺寸:0.86 mm×0.86 mm×0.8 mm;β 值为 1.5,分辨率均匀。PET显像前,所有小鼠用含2%异氟烷的纯氧麻醉,经尾静脉注射18F-FMISO(约14.8 MBq,400μCi)。所有图像均使用ASI Pro VM 6.8.6.9图像处理软件进行兴趣区域的勾勒,肿瘤兴趣区的勾勒尽可能包括整个肝脏转移灶。计算最大标准化摄取值(SUVmax)定量评估肝转移瘤放射性核素的摄取。SUVmax的计算公式为:
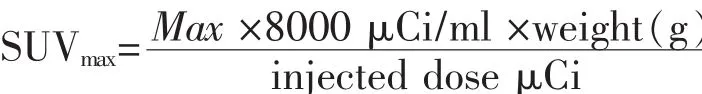
6.伤口愈合实验
将 LoVo、HT29和 HCT116细胞以 5×105个/ml的浓度接种在无菌6孔板中,待每种细胞生长至单层铺满时采用10 μl移液枪头尖部划伤单层细胞以创建伤口缝隙。在Olympus IX71显微镜(Olympus,Japan)下采集划痕后 0 h 的图像,第一次图像采集后,用含2%FBS的低血清培养基处理细胞,于伤口创建后24和48 h采集划痕图像。整个图像采集过程使用相同的视野,以保证位置的一致性。 使用 Image J软件(NIH,Bethesda,MD,USA)测量伤口面积。伤口愈合百分比计算公式如下:伤口愈合百分比=(0 h的伤口面积-特定时间的伤口面积)/0 h的伤口面积×100%。
7.细胞免疫荧光实验
LoVo、HT29和HCT116细胞铺于含有无菌细胞载玻片的6孔板中。HIF-1α染色前,细胞进行乏氧(37℃,1%O2、5%CO2和 94%N2)预处理 24 h;GLUT-1染色前,细胞置于无血清培养基中饥饿预处理12 h。根据文献指导进行细胞免疫荧光染色[20]。 HIF-1α(Abcam,H1 alpha67,UK)和 GLUT-1(Abcam,ab40084,UK)一抗的工作浓度为 1∶100。采用共聚焦显微镜(Nikon,C2 si,Japan)拍摄图像。采用活细胞成像系统(NIS-Elements,Japan)定量细胞内蛋白质的表达水平。
8.免疫组化实验
将 LoVo、HT29和 HCT116皮下瘤标本置于10%甲醛液中固定 48 h,石蜡包埋,切片厚度3 μm。根据之前的文献指导进行免疫组化染色[21]。组织切片分别滴加HIF-1α和GLUT-1一抗置于4℃环境孵育过夜(工作浓度,1∶100)。 第二天,将组织切片与HRP标记的二抗(Boster,武汉)在室温下孵育1 h。最后,苏木精复染,于显微镜下观察(放大 200 倍,Olympus BX53,Japan)。 肿瘤细胞在细胞质或细胞膜中呈现棕黄色时,定义为HIF-1α和GLUT-1结果为阳性。
9.统计学分析
所有数据以均数±标准差表示。使用SPSS 19.0软件进行统计分析。采用单因素方差分析结合最小显著差法比较三组数据之间的差异。采用Fisher精确检验比较肝转移潜能的差异。采用Pearson相关系数分析18F-FMISO定量参数与肝转移数量及肿瘤相关生物学指标之间的相关性,P<0.05为差异有统计学意义。
结 果
1.三种CRC细胞体外迁移能力评价(图1)
结果显示 LoVo 细胞[24 h,(25.27±0.6)%;48 h,(67.3±0.51)%]不同时间点的伤口闭合率大于HT29[24 h,(20.46±0.57)%;48 h,(29.32±0.43)%,P<0.001]和 HCT116[24 h,(5.88±0.83)%;48 h,(18.42±0.73%),P<0.001]细胞,揭示了 LoVo 细胞具有更强的体外迁移能力。
2.三种CLM模型体内转移潜能评价
20只LoVo模型中有12只(60%)发生了肝转移;20只HT29模型中有7只(35%)发生肝转移,20只HCT116模型中有3只(15%)发生肝转移(χ2=8.756,P=0.13)。 经统计,在 22 只发生肝转移的小鼠中有16只小鼠的肝转移瘤大于0.5 cm,大于0.5 cm的肝转移结节共35个(一个肝脏内可有多个直径大于 0.5 cm的结节)。此外,LoVo、HT29和HCT116 CLM小鼠的中位生存时间分别为 8.5、10 和 12 周(P<0.001,图 2)。 与 LoVo和HT29 CLM小鼠比较,HCT116小鼠具有更长的生存时间。
3.18F-FMISO体外细胞摄取能力评价
三种细胞18F-FMISO体外核素摄取率随时间增加而增长(图3)。LoVo、HT29和HCT116细胞在30 min的18F-FMISO摄取率无统计学差异(P>0.05); 在 60和 120 min,LoVo细胞的18F-FMISO摄取率明显高于HT29和HCT116细胞(P<0.001),但是,HT29和HCT116对18F-FMISO的摄取差异无统计学意义(P值分别为 0.265和 0.462,均>0.05);在 240 min 时,LoVo、HT29 和 HCT116 细胞两两间18F-FMISO摄取率差异均存在统计学意义(P<0.01)。本结果表明不同转移潜能的CRC细胞系之间存在放射性核素摄取的多样性,这种现象也反映了CRC肿瘤细胞系之间的生物学行为差异。
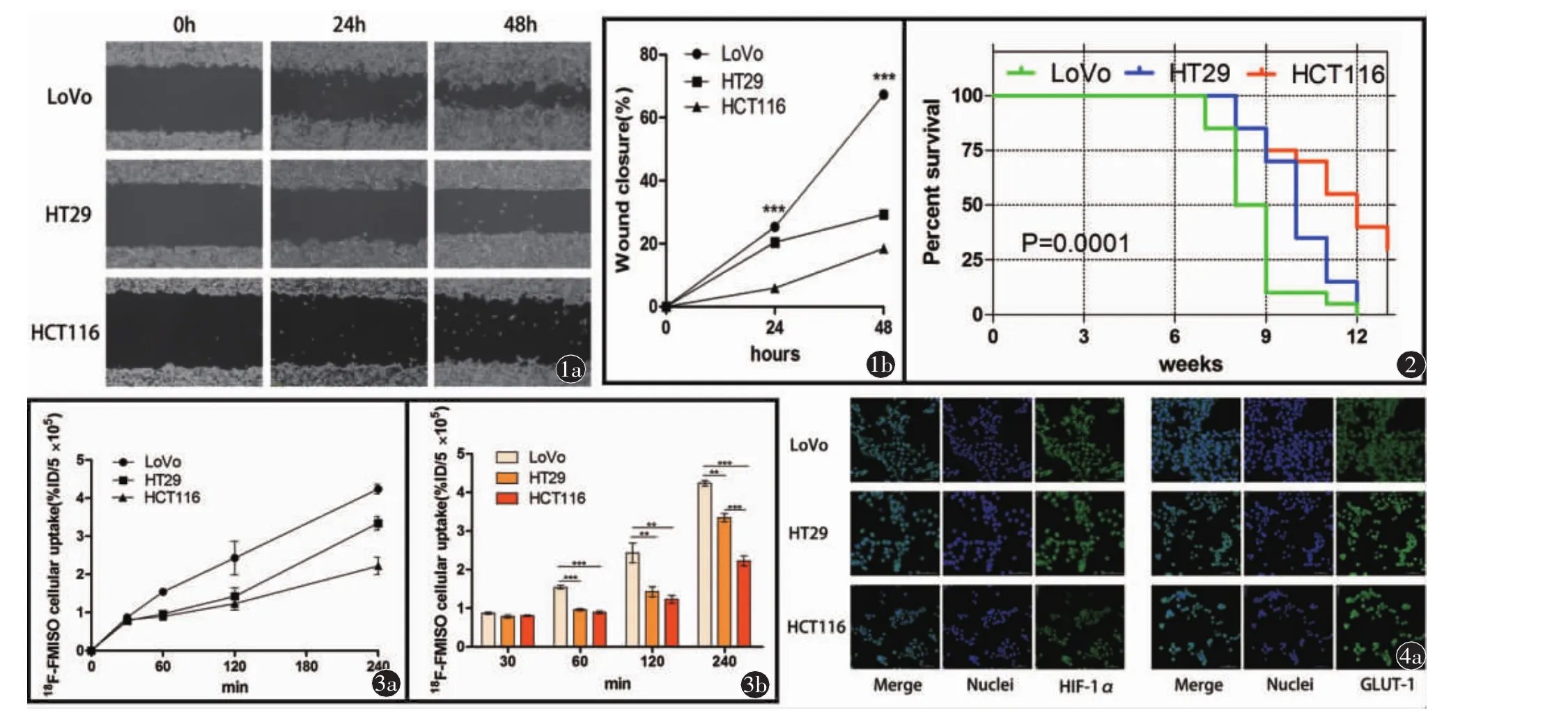
图1 LoVo、HT29和HCT116细胞体外迁移实验。a)使用10 μl移液管尖端刮擦LoVo、HT29和HCT116细胞单层。在伤口形成后的0、24和48 h采集图像。图像放大倍数(×100);b)LoVo、HT29和HCT116细胞的伤口愈合定量分析(%)。数据以均值±标准差表示,差异的显著性用星号(*)表示,***P<0.001 图 2 LoVo、HT29和HCT116肝转移模型小鼠生存曲线 图 3 LoVo、HT29和HCT116体外细胞摄取实验。a)LoVo、HT29和HCT116体外18F-FMISO细胞摄取的时间曲线;b)18F-FMISO细胞摄取率定量直方图。数据以表示均值±标准偏差表示,差异的显著性用星号(*)表示,**P<0.01;***P<0.001
4.生物学指标检测(HIF-1α、GLUT-1)(图 4)
LoVo细胞GLUT-1和HIF-1α的平均荧光强度值显著高于 HT29细胞(29.3±5.63比 10.14±3.02 和 71.06±11.24 比 14.98±5.74,P<0.0001),HT29细胞的GLUT-1和HIF-1α平均荧光强度值略高于HCT116细胞,但两者间的差异无统计学意义(10.14±3.02比 8.24±1.20和 14.98±5.74比10.04±3.26,P=0.155 和 P=0.268)。 免疫组化结果显示,LoVo皮下瘤的 GLUT-1和HIF-1α表达显著高于 HT29(51.21±3.36 比 35.89±3.45 和 21.15±3.40 比 10.46±2.16,P<0.05)和 HCT116 (51.21±3.36比 23.46±1.82 和 21.15±3.40 比 5.83±1.26,P<0.05)组织(图4d)。HT29皮下瘤组织中 GLUT-1的表达显著高于HCT116组织(P<0.05)。三种细胞体内、体外GLUT-1和HIF-1α的表达高低与其转移潜能表现出一致性。
5.18F-FMISO T/L SUVmax定量参数可以鉴别CRC的转移潜能
笔者于18F-FMISO注射后4 h行Micro-PET显像。图5为LoVo、HT29和HCT116模型的18FFMISO PET图像及其对应的肝脏解剖图像。在肝转移模型中,18F-FMISO PET可以很好的显示直径大于等于0.5 cm的肝转移瘤。定量分析表明,皮下瘤的18F-FMISO T/L SUVmax值高于肝转移瘤(P<0.05);LoVo肝转移瘤和皮下移植瘤的T/L SUVmax值均显著高于 HT29和HCT116模型(P<0.05,表1)。结果表明了,18F-FMISO T/L SUVmax定量参数可以鉴别不同转移潜能CRC细胞系的肝转移生物学行为。
6.相关性分析
在本实验中,肝转移瘤的体积明显小于皮下瘤。为此,在量化肿瘤乏氧程度时,皮下瘤的ROI勾勒会更准确。本研究发现肝转移瘤的18F-FMISO T/L SUVmax值与肝转移数量(大于0.5 cm的转移瘤)具有中度相关性(r=0.6408,P=0.0013);在皮下瘤中,18F-FMISO T/L SUVmax定量参数与 HIF-1α(r=0.8145,P=0.0075)和 GLUT-1(r=0.8252,P=0.0062)的表达具有高度相关性。
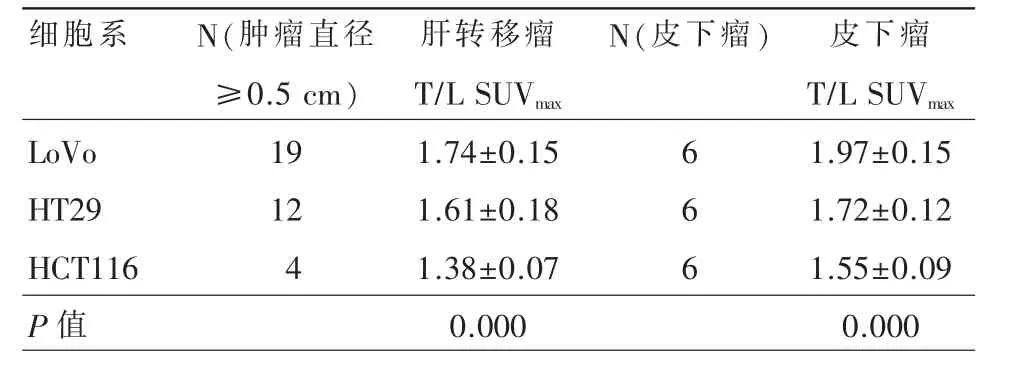
表1 LoVo、HT29和HCT116动物模型18F-FMISO T/L SUVmax值比较
讨 论
在CRC患者中,约25%的患者在首次就诊时即发生肝转移(同时性),约50%的患者在原发病灶切除后3年内发生肝转移异时性[22,23]。肝转移是导致CRC死亡的主要原因。肿瘤异质性是影响肿瘤进展、转移、预后和疗效的关键因素,在CRC肝转移中扮演了重要的角色[24,25]。 Kim 等[26]研究证实,CRC进程中普遍存在基因亚型异质性,是肿瘤转移初始克隆行为的潜在驱动力。应用分子显像深入理解CRC转移相关生物学行为对早期检测肝转移和指导CRC患者个体化治疗至关重要。
在肿瘤进展过程中,乏氧微环境是一个动态的过程,并且与新生血管生成、肿瘤侵袭、肿瘤转移及肿瘤耐药密切相关[8,27]。PET显像可以量化肿瘤组织摄取示踪剂的程度,18F-FMISO注射后2 h的SUV值可反映实体肿瘤中的乏氧水平,进而预测其生物学特性[11,28]。本实验中,首先采用伤口愈合实验比较了三种CRC细胞的体外迁移能力,明确了体外迁移能力由高到低分别为:LoVo>HT29>HCT116。随后,进一步构建肝转移模型评价了其体内转移潜能。生存分析的结果显示,LoVo、HT29和HCT116肝转移小鼠的中位存活时间分别为8.5、10和 12周(P<0.001)。 三种 CRC 细胞或模型在迁移、转移和生存时间的差异表明了CRC生物学行为的多样性。笔者选取皮下瘤进行ROI的勾勒及肿瘤FMISO摄取的量化,以减少因为肿瘤体积过小而引起的测量误差。结果显示,皮下瘤可更好的显示肿瘤乏氧区域,其T/L SUVmax值显著高于肝转移瘤,T/L SUVmax值由高到低分别为:LoVo>HT29>HCT116。18F-FMISO定量参数可以很好的区别三种不同转移潜能的CRC小鼠模型,结论与之前的研究结果一致,认为具有高转移潜能的LoVo细胞由于乏氧程度的增加表现出较强的放射性核素摄取能力[29,30]。
乏氧核心调控因子-1α(HIF-1α)和乏氧诱导生成的葡萄糖转运蛋白-1(GLUT-1)都是与肿瘤进展及转移密切相关的生物学指标[31,32]。在Estrella等[33]研究中,发现具有高葡萄糖代谢的恶性肿瘤细胞其微环境呈酸性,促进了肿瘤的侵袭和转移,另外也显示肿瘤组织高GLUT-1表达的区域也是具有高侵袭行为的区域。结果显示,与HT29和HCT116相比,LoVo细胞在体内和体外均表现出更强的GLUT-1和HIF-1α染色,且18F-FMISO定量参数与肝转移数量及GLUT-1和HIF-1α的表达具有相关性,说明18F-FMISO的定量参数也反映了肿瘤间蛋白水平表达的异质性[31]。正如之前的研究所述,乏氧为肿瘤的发生、发展创造了适宜的微环境,具有高侵袭能力的肿瘤可促进18FFMISO的摄取[30,32]。相似的一项PET荟萃分析结果表明,乏氧示踪剂高浓聚的恶性肿瘤趋向于不良预后结局[34]。
本研究也具有一定的局限性,三种细胞系不能代表所有的CRC,会在未来的实验中增加细胞系的种类,以便更全面、综合的分析CRC的生物学特性,并选择更多定量参数阐明18F-FMISO PET在预测CRC肝转移潜能中的应用价值。
18F-FMISO定量参数T/L SUVmax值为小鼠CRC肝转移提供了有价值的分子影像信息,其在预测CRC肝转移潜能方面具有一定的应用价值。

