基于PLFA分析中温和高温大曲及其曲房空气微生物群落相关性
,*
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000;2.四川国检检测有限责任公司,四川泸州 646000;3.宜宾海关,四川宜宾 644000;4.四川健能制药有限公司,四川自贡 643000)
“曲乃酒之骨”,大曲作为白酒酿造不可或缺的糖化发酵剂,不仅为白酒的酿造提供各种酶系,还为其提供丰富的微生物资源[1]。

表1 中温大曲取样参数Table 1 Sample lable of medium-temperature Daqu

表2 高温大曲取样参数Table 2 Sample lable of high-temperature Daqu
大曲种类繁多,常以制曲温度分为低温大曲、中温大曲及高温大曲三大类,其制作基本可归纳为原料配比、粉碎和搅拌、成型、培菌和储存这五个步骤[2],其中培菌为自然网罗原料、自然环境、器具等[3]里面的各种野生菌进行自然培养,使大曲成为一个复杂且多样性丰富的微生物载体,因此大曲制作所用的原料、水、母曲以及制曲工艺、环境因素等的不同,发酵过程中大曲及曲房微生物消长也会有所不同[4],导致最终生产的大曲质量参差不齐。
目前,大曲的研究多集中在大曲的工艺、微生物群落结构变化等方面[5-8]。谭崇尧等[9]利用高通量测序法对不同地域浓香型大曲微生物的结构进行分析,发现不同区域浓香型大曲优势菌群存有差别;施思等[10]利用高通量测序法对浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析,发现大曲在储藏过程真菌群落结构不断调整,且随着时间的推移,大曲发酵力逐渐升高,糖化力由高变低再升高。罗惠波等[11]采用聚合酶链式反应-单链构象多态(PCR-SSCP)技术对浓香型大曲不同发酵阶段原核微生物群落变化进行研究,发现不同阶段大曲原核微生物群落相似,不同菌群间具有复杂的协调和制约作用。至今对于大曲生产环境的微生态研究依然较少,但大曲制作培菌采用开放式自然接种,制曲环境对大曲最终质量至关重要,加强对大曲酿造环境的研究是更进一步了解大曲发酵机理的关键。
磷脂脂肪酸(Phospholipid fatty acid,PLFA)图谱分析法是一种快捷、可靠的检测方法,根据不同微生物细胞膜中PLFA数量、种类不同且具有很高的生物学特异性的特点,以微生物脂肪酸甲酯为分析对象,能很好地表征微生物的多样性,它能克服传统微生物培养方法费时费力、无法检测不可培养微生物的缺点,使得检测结果更为完善,同时依据细胞死亡后磷脂脂肪酸会迅速降解这一机理[12-17],样品中脂肪酸种类及其数量的改变可以对活体微生物生物量及群落多样性动态变化进行很好地表征。
本文采用Corolis μ空气生物采样器采集曲房空气微生物,利用PLFA图谱分析法对四川泸州地区的中温大曲和高温大曲及其曲房空气微生物进行研究,探索大曲及其曲房空气微生物群落的相关性,比较不同温度大曲及其曲房空气群落微生物之间的差异,以期为提高大曲质量提供理论依据。
1 材料与方法
1.1 材料与仪器
大曲及曲房空气 分别为采自四川泸州地区某浓香型酒厂和某酱香型酒厂的大曲及其曲房空气,同一生产阶段大曲及对应曲房空气采取三个平行,利用Corolis μ空气生物采样器采集曲房空气,再将其转入装有无菌水的玻璃瓶中;无菌采集大曲后装入无菌的自封袋中,置于冰盒中迅速运回,粉碎后混匀,用于PLFA分析;各阶段样品取样环境参数如表1、表2所示;甲基叔丁基醚 Telia公司;正己烷 Fisher Scientific;甲醇 Darmstadt Germany;以上试剂均为色谱纯;三氯甲烷、甲苯、醋酸和丙酮 分析纯,成都市科龙化工试剂厂。
ZWY-103B恒温培养振荡器 中国上海智城公司;Sherlock 602气相色谱仪 美国Agilent公司;Sherlock MIS 4.5(Sherlock Mi-crobial Identification System)微生物鉴定系统 美国MIDI公司;5430R高速离心机 德国Eppendorf公司;Corolis μ空气生物采样器 法国Bertin公司;599型低温冰箱 美国Thermo公司;BF-2000氮气吹干仪 中国北京八方公司。
1.2 实验方法
1.2.1 PLFA提取及甲基化 将装有空气微生物的无菌水先后用定性滤纸(8 μm,47 mm)和硝化纤维滤膜(0.22 μm,47 mm)进行抽滤,再将收集有空气微生物的0.22 μm滤膜和8 g大曲样品分别置于50 mL的离心管中,加入10 μL 2.5 mmol/L的1,2-dinonadecanoyl-sn-glycero-3-phosphocholine作为内标,参照文献[18]进行PLFA的提取及甲基化。
1.2.2 PLFA气相色谱分析 气相色谱仪配备分流进样口,Agilent GC6890气相色谱化学工作站和氢火焰离子化检测器(FID)。进样口温度为250 ℃;分流比为10∶1;进样量为1 μL;起始柱温40 ℃,保持2 min后以5 ℃/min升至220 ℃,保持9 min。
1.3 数据分析
2 结果与分析
2.1 大曲及曲房空气微生物PLFA种类变化规律
采用PLFA图谱分析法分别对中温、高温大曲及其曲房空气的微生物磷脂脂肪酸(PLFA)种类数随发酵时间的变化关系进行研究。图1表明:在整个发酵过程中,大曲各阶段微生物PLFA种类数均高于对应曲房空气PLFA种类数。中温大曲在发酵前期微生物呈下降趋势,低温期微生物种类达到最低值29,显著低于第1、3、5阶段(P<0.05),发酵中期微生物呈上升趋势,在第3个阶段(高温期)微生物种类达到最大值39,发酵后期(第4、5阶段)微生物趋于稳定(P>0.05);其曲房空气在发酵前期趋于稳定,进入后火期微生物种类数达到最大值22,显著高于第3、5阶段(P<0.05);高温大曲在发酵前期微生物种类数呈上升趋势,在第2个阶段(入房4 d)微生物种类达到最大值32,显著高于第1、3、5阶段(P<0.05);其曲房空气微生物在发酵0 d微(第1阶段)生物PLFA种类达到最大值21,发酵阶段的微生物PLFA种类趋于稳定(P>0.05),微生物种类显著低于发酵0 d(P<0.05)(除第5阶段)。这可能与制曲所用的原料、水、母曲,以及制曲工艺、环境因素等的不同,导致两种大曲及曲房微生物消长有其特殊性[4]。中温大曲在高温期微生物种类最高,后火期微生物种类降低,这可能是由于发酵前期中温大曲营养丰富、温度适宜,多种微生物快速生长繁殖,生物量逐渐累积,使得高温期微生物PLFA种类达到最大值,高温期温度迅速上升,不适应高温环境的微生物逐渐死亡,故而后火期微生物种类降低;高温大曲在第2阶段(入房4 d)微生物种类最高,高于发酵中后期,其原理同中温大曲相似。除低温期外,中温大曲微生物种类皆高于高温大曲,结果与张会敏等的研究结果一致[19-21],这可能是由于高温大曲制曲温度高于中温大曲,不适应高温环境的微生物会逐渐死亡。可见,大曲发酵过程中温度是直接影响细菌多样性高低的一个重要因素。

图1 不同温度大曲及其曲房空气微生物PLFA种类数变化Fig.1 Changes of species of microbial PLFA in different temperature of Daqu and the workshop air注:不同发酵阶段PLFA种类数的差异用不同字母表示, 不含相同字母的表示差异显著(P<0.05)。
2.2 大曲及曲房空气微生物PLFA种类组成分析
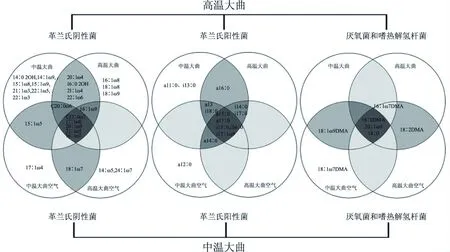
图2 样品中PLFA种类组成Fig.2 PLFA composition in the sample
采用PLFA图谱分析法对中温、高温大曲及其曲房空气微生物PLFA种类组成进行分析。图2结果表明:在空气中能检测到的大多数微生物种类在对应大曲中能检测到,只有少部分微生物种类未能被检测。这可能是由于大曲含有丰富的营养物质,发酵过程中大量空气微生物被自然富集,随着空气的流动大曲中细菌也可能被迁移进空气中进行生长繁殖,因此从一定程度上体现了大曲和曲房空气的细菌群落区系具有一定的相似性[22]。大曲和曲房空气的PLFA种类具有差异性,存在其特有的微生物种类。中温大曲特有磷脂脂肪酸为表征革兰氏阴性菌的特征磷脂脂肪酸14∶0 20H、14∶1ω9、15∶1ω8、15∶1ω9、21∶1ω3、22∶1ω5、22∶1ω3和表征革兰氏阳性菌的特征磷脂脂肪酸a11∶0、i13∶0;其曲房空气特有磷脂脂肪酸为表征革兰氏阴性菌的特征磷脂脂肪酸17∶1ω4和表征革兰氏阳性菌的特征磷脂脂肪酸a12∶0以及表征厌氧菌的特征磷脂脂肪酸18∶1ω7 DMA。高温大曲特有的磷脂脂肪酸种类为表征革兰氏阴性菌的特征磷脂脂肪酸16∶1ω8、18∶1ω8、18∶1ω9;其曲房空气特有磷脂脂肪酸为表征革兰氏阴性菌的特征磷脂脂肪酸14∶1ω5、24∶1ω7。这可能是由于制曲工艺和制曲环境的不同,使得两种大曲长期制曲区域的细菌群落保持相对的稳定性[23],并驯化出其特有的微生物种类,而这些微生物种类可能就是中、高温两种大曲质量产生差异的重要因素,这需要后续验证。此外,两种大曲微生物PLFA组成差异主要表现在革兰氏阴性菌,且高温大曲中革兰氏阴性菌种类数较低,结果与赵金松等[24]的研究结果相一致。
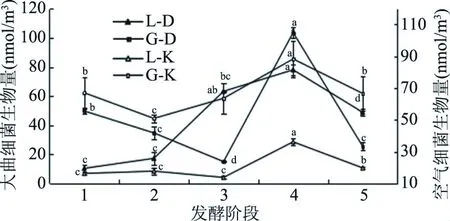
图3 大曲及曲房空气细菌生物量随发酵时间的变化趋势Fig.3 Change of bacteria biomass in Daqu and its workshop air注:不同发酵阶段细菌生物量的差异用字母表示, 不含相同字母的表示差异显著(P<0.05)。
2.3 大曲及曲房空气细菌生物量变化趋势
采用PLFA法分别对中温、高温两种不同大曲及其曲房空气细菌生物量变化趋势进行研究。图3表明:在发酵过程中两种大曲及其曲房空气细菌生物量总体先上升后降低,且均在发酵第4阶段(中温大曲为退火期、高温大曲为二次翻曲后4 d)达到最大值,这说明大曲微生物与曲房空气微生物具有一定相关性。中温大曲细菌生物量在发酵前期缓慢增加,后火期生物量达到最大值78.09 nmol/m3;其曲房空气细菌生物量在发酵前期趋于稳定(P>0.05),高温期开始上升,至发酵后火期生物量达到最大值36.24 nmol/m3。高温大曲细菌生物量在发酵前期呈下降趋势变化,第一次翻曲后(发酵第3阶段)细菌生物量开始上升,在第二次翻曲达到最大值(发酵第4阶段)103.62 nmol/m3,显著高于其他阶段(P<0.05),之后生物量有所下降;其曲房空气细菌生物量在大曲入房前缓慢降低,发酵第2阶段达到最低值,后期细菌生物量迅速上升至发酵第四阶段最大值88.39 nmol/m3,显著高于其他各阶段(P<0.05),贮存期生物量降低。两种大曲细菌生物量在发酵前期变化差异较大,这可能是由于在前几个阶段的发酵过程中,中温大曲的升温速度较相对于高温大曲较缓慢,有利于微生物逐渐适应高温环境[25],使中温大曲细菌生物量逐渐增加。
2.4 大曲及曲房空气细菌群落变化趋势
采用PLFA法对中温、高温两种不同大曲及曲房空气的细菌群落结构进行研究分析。图4表明:高温大曲及曲房空气细菌群落演替较中温大曲稳定。高温大曲在发酵0 d以革兰氏阴性菌为优势菌群,入房后革兰氏阴性菌迅速降低,革兰氏阳性菌成为优势菌群;其曲房空气在发酵过程中以革兰氏阴性菌为优势菌群,发酵后期革兰氏阳性菌相对丰度有所上升。中温大曲在整个发酵过程中以嗜热解氢杆菌、革兰氏阴性菌为优势菌群,随着发酵时间的延长,革兰氏阳性菌逐渐增加;其曲房空气在发酵0 d以革兰氏阳性菌为优势菌群,随着大曲中微生物的生长及迁移,革兰氏阴性菌的丰度呈较高水平。
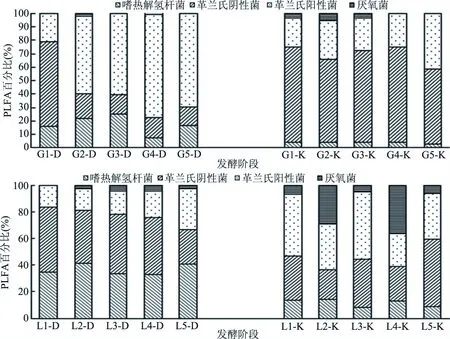
图4 大曲及曲房空气中细菌群落的分布Fig.4 Distribution of bacterial community in Daqu and the workshop air
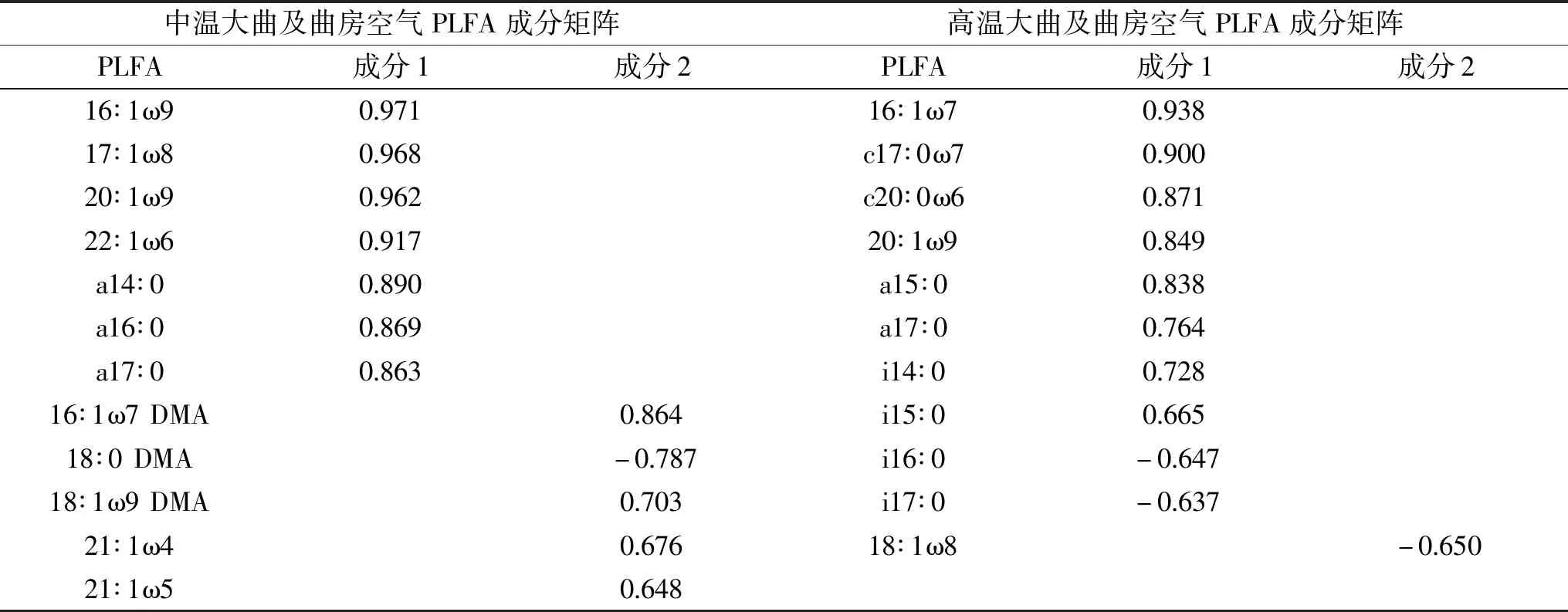
表3 大曲及其曲房空气中PLFA主成分Table 3 Principal component of PLFA in Daqu and the workshop air
中温、高温两种大曲在发酵初期均以革兰氏阴性菌为优势菌群,这可能是由于在发酵初期大曲温度、湿度适宜,营养充足,为革兰氏阴性菌创造了快速生长的条件,革兰氏阴性菌的相对丰度最高。随着大曲发酵的进行,两种大曲及曲房空气革兰氏阳性菌相对丰度均有所上升,尤以高温大曲最为明显,这可能是由于革兰氏阳性菌在相对恶劣的环境中具有更好的耐受性[26],在缺乏营养物质和高温缺水的条件下,革兰氏阳性菌的生长情况较其他菌群好。此外,在整个发酵过程中,两种大曲及曲房空气嗜热解氢杆菌相对丰度总体趋于稳定,在大曲发酵温度最高时期也能保持较高的丰度,而在发酵过程中的厌氧菌相对丰度在中温大曲及其曲房空气各阶段均高于高温大曲及其曲房空气,这可能是由于嗜热解氢杆菌具有较强的适应力,能在不同温度及环境下做出有利于自身生长的反应,同时由于高温大曲在发酵过程中会进行多次翻曲,使得曲房的空气更加流通,曲房氧气含量升高,仅在大曲里层形成局部的高温缺氧环境,使厌氧菌的丰度处于较低水平。
2.5 大曲及曲房空气细菌群落结构的主成分分析
采用主成分分析法(PCA)对中温、高温两种不同大曲及其曲房空气不同发酵阶段的微生物PLFA种类进行分析。结果表明:中温、高温两种不同大曲及其曲房空气中的PLFA均可归为两个主成分,各成分中载荷值>0.6的脂肪酸如表3所示。中温大曲及其曲房空气PLFA的主成分1主要代表的脂肪酸种类为16∶1ω9、17∶1ω8、20∶1ω9、22∶1ω6革兰氏阴性细菌的特征磷脂脂肪酸和a14∶0、a16∶0、a17∶0革兰氏阳性细菌的特征磷脂脂肪酸;成分2主要代表的脂肪酸种类为18∶1ω9 DMA、16∶1ω7 DMA、18∶0 DMA厌氧菌的特征磷脂脂肪酸。高温大曲及其曲房空气PLFA的主成分1主要代表的脂肪酸种类为16∶1ω7、c17∶0ω7、c20∶0ω6、20∶1ω9革兰氏阴性细菌的特征磷脂脂肪酸和a15∶0、a17∶0、i14∶0、i15∶0、i16∶0、i17∶0革兰氏阳性细菌的特征磷脂脂肪酸。中温大曲及曲房空气在PC1和PC2的分布情况如图5所示,L1-K、L2-K、L3-K、L4-K、L5-K和L1-D、L2-D在PC1上距离接近;高温大曲及曲房空气在PC1和PC2的分布情况如图6所示,G1-K、G2-K、G3-K、G4-K、G5-K 和 G1-D、G2-D、G3-D、G5-D 在 PC1 上距离接近,表明这几个阶段的的革兰氏阴性细菌和革兰氏阳性菌的组成较为相似,存在相互影响。
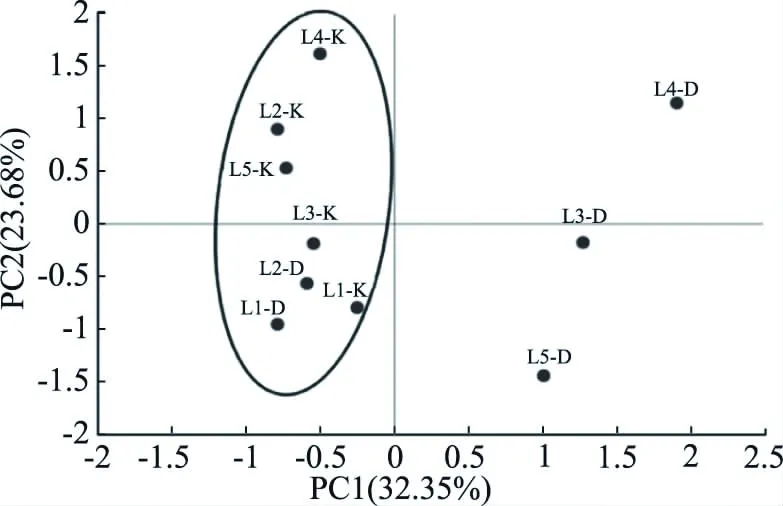
图5 中温大曲及曲房空气的主成分分析Fig.5 Principal component analysis of PLFA in medium temperature Daqu and the workshop air

图6 高温大曲及曲房空气PLFA的主成分分析Fig.6 Principal component analysis of PLFA in high temperature Daqu and the workshop air
3 结论
本文利用磷脂脂肪酸(PLFA)技术对中温、高温两种大曲及其曲房空气在发酵过程中的微生物群落进行研究,并对两者之间细菌群落结构的差异进行分析,结果发现:各阶段大曲微生物PLFA种类数皆高于对应曲房空气,大曲及其曲房空气细菌生物量均在发酵第4阶段达到最大值。中温大曲及其曲房空气微生物在发酵前期群落组成相似,高温大曲与其空气细菌群落组成在整个发酵过程中比较稳定(除发酵第4阶段)。中温大曲以嗜热解氢杆菌、革兰氏阴性菌为优势菌群,其曲房空气以革兰氏阳性菌、革兰氏阴性菌为优势菌群;高温大曲以革兰氏阳性菌为优势菌群(除发酵初期),其曲房空气以革兰氏阴性菌为优势菌群。此外,不同温度大曲及其曲房空气均含其特有微生物种类,这可能是这两种大曲质量产生差异的重要因素。综合研究结果可得:大曲及其曲房空气的细菌群落区系具有一定的相似性,曲房空气微生物对大曲微生物的多样性具有重要影响;不同温度大曲有其特有细菌群落结构和微生物种类。因此深入研究曲房空气微生物和不同温度大曲特有微生物对提升大曲质量具有重大意义。

