垂体生长激素腺瘤相关顽固性头痛诊治经验
封一定 邓侃 王任直
垂体生长激素腺瘤是一种功能性垂体腺瘤,约 占全部垂体腺瘤的10%,由于过量分泌生长激素(GH),在成人中主要表现为肢端肥大症[1⁃2]。肿瘤分泌的生长激素直接或间接作用于各器官,除导致五官粗大、头颅变长、鼻大唇厚等典型面容改变外,还可引起多系统并发症,如心血管病、糖尿病、高血压、睡眠呼吸暂停综合征(SAHS)、结肠息肉等[3⁃4]。头痛是垂体腺瘤患者常见的非特异性症状,约57%的患者可出现头痛症状[5],除伴发垂体卒中外,大多数患者头痛程度较轻微,手术切除肿瘤后症状基本可缓解[6⁃7];但仍有少部分患者术后出现持续性且极为剧烈的头痛,疼痛程度比术前更甚且难以忍受,镇痛药物治疗效果欠佳,严重影响患者生活与工作。北京协和医院近年收治4 例术后出现剧烈头痛的垂体生长激素腺瘤患者,回顾总结其临床特点及诊治经验,以期提高临床医师的诊疗水平。
临床资料
1.一般资料 选择2014 年2 月至2017 年7 月在我院神经外科住院的4 例垂体生长激素腺瘤患者,诊断符合《中国肢端肥大症诊治指南(2013 版)》[8]标准:肢端肥大症特征性面容改变、血清胰岛素样生长因子⁃1(IGF⁃1)水平升高、口服葡萄糖耐量试验(OGTT)GH 谷值>1 μg/L,以及垂体MRI 提示垂体腺瘤。男性1 例,女性3 例;年龄23 ~42 岁,平均为(31 ± 9)岁;肢端肥大 症 病程2.80 ~5.70 年,平均(4.19±1.17)年;临床表现为明确的肢端肥大症及重度持续性头痛,入院后生长抑素试验[于皮下注射短效生长抑素类似物(SSTAs)醋酸奥曲肽(善宁)0.10 mg,1 ~2 min 后头痛症状彻底缓解]均呈阳性。4 例患者既往曾行经蝶窦入路垂体腺瘤切除术(例1、例3 和例4)或开颅垂体腺瘤切除术(例2),其中,1 例(例3)术后辅助伽马刀治疗(具体剂量不详);本次入院后均再次施行经蝶窦入路垂体腺瘤切除术。
2.手术前后各项指标评价 (1)术前:血清GH、IGF⁃1 和OGTT 试验GH 谷值均明显升高,数字评价量表(NRS)评分提示重度头痛。(2)术后7 天内:血清GH 仅1 例(例2)低于正常水平,其余3 例仍高于正常水平但明显低于术前;IGF⁃1 仅1 例(例1)仍高于正常水平,其余3 例基本降至正常值范围;OGTT试验GH 谷值仅1 例(例2)恢复正常(0.07 μg/L),其余3 例均>1 μg/L;NRS 评分提示头痛程度呈轻度,症状明显改善。(3)术后3 个月随访:血清GH 1 例(例2)仍维持于正常水平、2 例(例1、例3)高于正常值范围但明显低于术前水平、1 例与术前相比无明显改善;IGF⁃1 水平2 例(例1、例2)降至正常值范围、2 例(例3、例4)仍高于正常水平,其中例3 高于术前水平;OGTT 试验GH 谷值仅1 例(例2)降至0.05 μg/L,其余3 例仍>1 μg/L;NRS 评分1 例(例1)为6 分,呈中度头痛,其余3 例均呈轻度头痛(表1)。
例1 女性,24 岁。因经蝶窦入路垂体腺瘤切除术后1 周头痛症状加重(NRS 评分8 分)且发作频繁,于2017 年6 月8 日 入 院。患 者2 年5 个 月 前(2015 年1 月)出现眉弓突出、颧骨上抬、鼻尖变圆、鼻翼肥厚等面容改变,未予重视。1 年8 个月后(2016 年9 月)开始出现头痛,主要位于右侧颞部,伴右侧眶部、耳周、颈部疼痛,呈间断性发作,每次持续4 ~5 小时,休息后缓解,无明确加重因素,NRS 评分4 分,至当地医院就诊,以“肢端肥大症”收入院。入院后实验室检查血清GH 34.90 μg/L,IGF⁃1 未测;垂体MRI 显示蝶鞍扩大,鞍内团块状等T1、等T2信号影,大小约18.20 mm×26.70 mm×26.70 mm,并可见“束腰征”,视交叉受压上抬,双侧颈内动脉海绵窦段向外推移且部分包绕,病灶向下突入蝶窦,增强后病灶呈不均匀中度强化,临床诊断为垂体生长激素腺瘤。2017 年2 月16 日于显微镜下行经蝶窦入路垂体腺瘤切除术并经病理证实为垂体腺瘤。术后头痛症状明显缓解(NRS 评分2 分),复查GH 为5.35 μg/L;术后7 天头痛症状加重(NRS 评分8 分),尤以双侧额顶部显著,并且发作频繁(4 ~6 h/次、1 ~2 次/d),严重影响生活和工作,予非甾体抗炎药(NSAID)治疗无好转。为求进一步诊断与治疗,至我院就诊。入院后实验室检查血清GH 9.80 μg/L、IGF⁃1 586 μg/L、OGTT 试验GH 谷值4.28 μg/L。垂体MRI 增强扫描可见垂体右翼于颈内动脉内下方有片状肿瘤残留(图1a),临床诊断为垂体生长激素腺瘤残留。入院后1 周(2017 年6 月15 日)于神经内镜下行经蝶窦入路垂体腺瘤切除术,术中可见鞍底瘢痕组织,鞍内右侧瘢痕组织与肿瘤组织混杂,大小约10 mm×10 mm×10 mm,呈灰白色、质地较韧、与鞍膈粘连紧密、血运一般,术中出血约20 ml,手术全切除肿瘤。术后3 天头痛症状明显缓解(NRS 评分2 ~3 分),复查GH 7.20 μg/L、IGF⁃1 598 μg/L、OGTT 试验GH 谷值7.32 μg/L。患者共住院11 天,出院后随访至术后2 个月(2017 年8 月)时,头痛复发,但疼痛较术前轻微且可耐受(NRS 评分6 分),复查MRI 显示残留肿瘤全切除(图1b),复查OGTT 试验GH 谷值2.93 μg/L、IGF⁃1 414 μg/L,予长效奥曲肽10 mg/月治疗,1 个月(2017 年9 月)后再次复查GH 为5.30 μg/L、IGF⁃1 352 μg/L,NRS 评分6 分;维持治疗2 年,期间GH 2 ~5 μg/L、IGF⁃1 350 μg/L,NRS 评分2 ~6 分;患者自觉头痛症状逐渐加重,2019 年10 月改用兰瑞肽40 mg/15 d 皮下注射,治疗后NRS 评分3 ~4 分。目前仍在随访中。
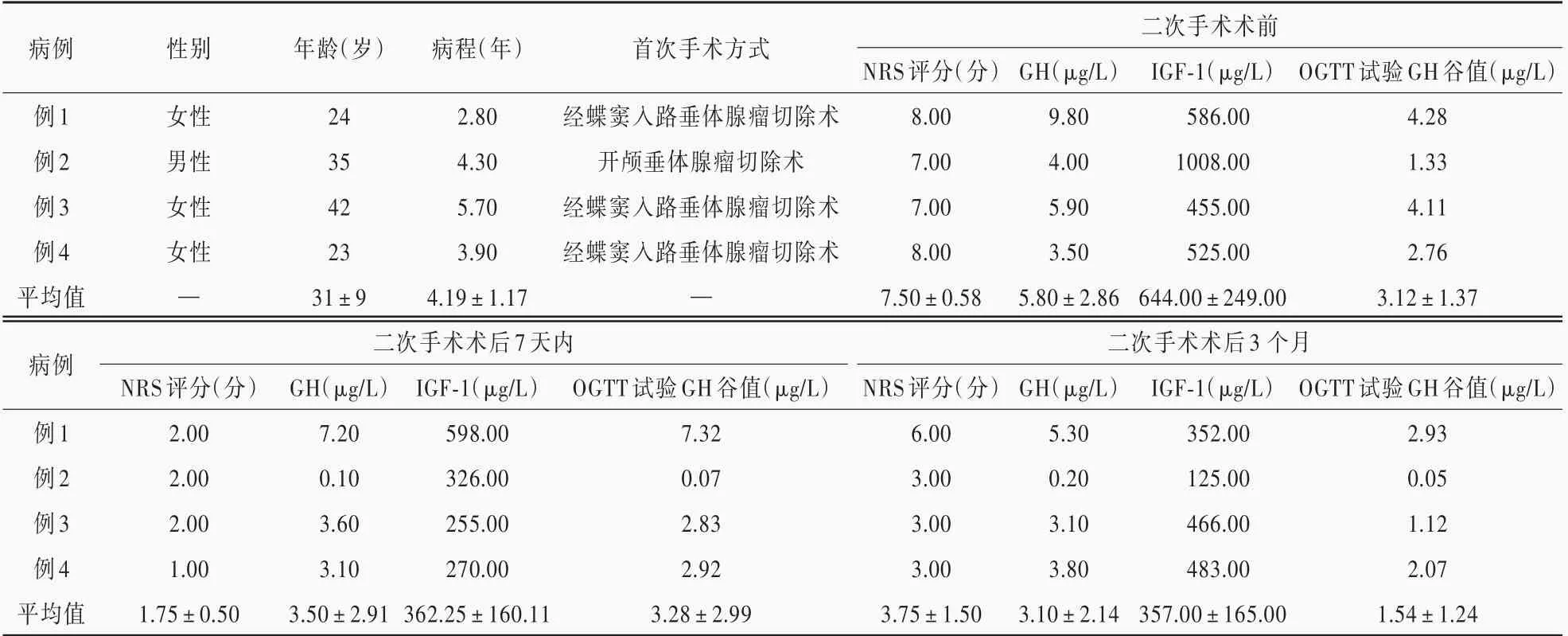
表1 4 例垂体生长激素腺瘤相关顽固性头痛患者的临床资料Table 1. Clinical data of 4 cases with intractable headaches combined with GH⁃secreting pituitary adenoma
例2 男性,35 岁。因开颅垂体腺瘤切除术后3 个月出现严重的持续性头痛症状(NRS 评分7 分),于2014 年4 月25 日入院治疗。患者10 个月前(2013 年7 月)出现颧弓增高等面容改变,当地医院测定血清GH 为18 μg/L,未测IGF⁃1;垂体MRI 增强扫描显示鞍区占位性病变呈不均匀强化,临床诊断为垂体生长激素腺瘤。于2013 年7 月30 日行开颅垂体腺瘤切除术,术后GH 为1.90 μg/L。术后3 个月(2013 年10 月)开始出现头痛,以右侧颞部最为显著,间断发作(4 ~6 h/次、1 ~2 次/d),NRS 评分7 分,严重影响生活和工作。为求进一步诊断与治疗,遂至我院就诊。入院后实验室检查血清GH 4 μg/L、IGF⁃1 1008 μ g/L、OGTT 试 验GH 谷 值1.33 μ g/L;MRI 增强扫描可见垂体右翼强化信号减弱(图2a),临床诊断为垂体生长激素腺瘤残留。2014 年4 月29 日行显微镜下经蝶窦入路垂体腺瘤切除术,术中可见鞍内瘢痕组织,切开瘢痕,于垂体右翼可见灰白色、稀软肿瘤组织流出,手术全切除肿瘤并经病理证实垂体腺瘤诊断。术后7 天头痛明显缓解,NRS 评分2 分,复查GH 0.10 μg/L、IGF⁃1 326 μg/L、OGTT 试验GH 谷值0.07 μg/L;MRI 未见明确肿瘤残留。患者共住院10 天,出院后随访至术后3 个月(2014 年8 月)时自诉偶有头痛症状,但疼痛程度较术前明显减轻(NRS 评分3 分),血清GH 0.20 μg/L、IGF⁃1 125 μg/L、OGTT 试验GH 谷值为0.05 μg/L;术后1 年(2015 年5 月)仍偶尔出现头痛症状(NRS 评分3 分),血清IGF⁃1 230 μg/L、OGTT 试验GH 谷值0.09 μg/L;术后2 年2 个月(2016 年7 月)头痛发作频率增加、程度有所加重(NRS 评分4 分),复查IGF⁃1 444 μg/L、OGTT 试验GH 谷值0.36 μg/L,遂予普瑞巴林(具体剂量不详)治疗但症状无明显改善;术后3 年4 个月(2017 年9 月)头痛发作频率增加且症状加重,影响生活和工作(NRS 评分6 分),血清GH 0.40 μg/L、IGF⁃1 352 μg/L,MRI 未见明显肿瘤残留(图2b),改用长效奥曲肽10 mg/月治疗,治疗11 个月后头痛症状明显缓解(NRS 评分3 ~4 分),血清GH 和IGF⁃1 均于正常值范围,维持治疗1 年4 个月(2019 年12 月),头痛控制尚可(NRS 评分2 ~4 分),偶有发作。目前仍在随访中。

图1 例1 二次手术前后垂体MRI 增强扫描所见 1a 术前冠状位增强T1WI 显示肿瘤残留(箭头所示) 1b 术后冠状位增强T1WI 显示残留肿瘤全切除 图2 例2 二次手术前后垂体MRI 增强扫描所见 2a 术前冠状位增强T1WI 显示肿瘤残留(箭头所示) 2b 术后冠状位增强T1WI 显示残留肿瘤全切除Figure 1 Pituitary enhanced MRI of Case 1 before and after the second operation Coronal enhanced T1WI showed the tumor residual after the initial surgery (arrow indicates, Panel 1a). Coronal enhanced T1WI showed the tumor residual was removed after re⁃operation(Panel 1b). Figure 2 Pituitary enhanced MRI of Case 2 before and after the second operation Coronal enhanced T1WI showed the tumor residual after the initial surgery (arrow indicates, Panel 2a). Coronal enhanced T1WI showed the tumor residual was removed after re⁃operation (Panel 2b).
例3 女性,42 岁。主因经蝶窦入路垂体腺瘤切除术后3 年9 个月出现持续性剧烈头痛(NRS 评分7 分),于2017 年6 月12 日入院。患者5 年4 个月前(2012 年2 月)逐渐出现眉弓突出、颧骨上抬、鼻翼肥厚、手指变粗、双足增大等肢端肥大症表现,未予重视。1 年7 个月后(2013 年9 月)开始出现头痛,主要位于额部和双侧眶周,呈间断发作(3 ~5 h/次、3 ~4 次/周),NRS 评分7 分,严重影响生活和工作。当地医院血清学检测GH >5 μg/L、IGF⁃1 >1000 μg/L;垂体MRI 增强扫描可见鞍区占位性病变,临床诊断为垂体生长激素腺瘤。遂于2013 年9 月行显微镜下经蝶窦入路垂体腺瘤切除术,术后头痛症状未见减轻(NRS 评分7 分),复查GH >5 μ g/L、IGF⁃1 >1000 μg/L;2014 年2 月进一步行伽马刀治疗(具体剂量不详)和星状神经节阻滞术,症状如前(NRS 评分7 分),GH 和IGF⁃1 复查结果不详;予以短效奥曲肽皮下注射,经治疗后头痛症状有所减轻(NRS 评分2 分),停药后症状加重(NRS 评分7 分)。为求进一步诊断与治疗,至我院就诊。入院后实验室检查血清GH 5.90 μg/L、IGF⁃1 455 μg/L、OGTT 试验GH谷值4.11 μg/L;垂体MRI 增强扫描可见垂体上方条状肿瘤残留(图3a),临床诊断为垂体生长激素腺瘤残留。2017 年6 月15 日于神经内镜下行经蝶窦入路垂体大腺瘤切除术,术中可见鞍底瘢痕组织,鞍内瘢痕组织与肿瘤组织混杂,约为10 mm×10 mm×10 mm,呈灰白色、鱼肉状,与鞍膈粘连紧密,血运尚可。手术全切除肿瘤并经病理证实为垂体腺瘤。术后3 天MRI 检查显示残留肿瘤全切除(图3b);术后7 天头痛明显缓解(NRS 评分2 ~3 分),血清GH 3.60 μg/L、IGF⁃1 255 μg/L、OGTT 试验GH 谷值为2.83 μg/L。共住院9 天,出院后随访至术后2 个月(2017 年8 月)时罹患化脓性脑膜炎,经当地医院规范治疗(具体方案不详)1 个月痊愈;术后4 个月头痛发作频率增加且程度加重(NRS 评分5 ~6 分),复查GH 3.10 μg/L、IGF⁃1 466 μg/L、OGTT 试验GH 谷值1.12 μg/L,予以普瑞巴林(具体剂量不详)治疗后效果欠佳;术后1 年(2018 年5 月)换为长效奥曲肽10 mg/月治疗,间断治疗1 年2 个月(2019 年7 月),症状基本得以控制,偶有发作,服用镇痛药可缓解(NRS 评分2 ~4 分),血清GH 和IGF⁃1 均于正常值范围。目前仍在随访中。
例4 女性,23 岁。主诉经蝶窦入路垂体腺瘤切除术后2 年5 个月出现持续性剧烈头痛(NRS 评分8 分),于2017 年7 月25 日入院。患者4 年7 个月前(2013 年12 月)出现间断性头痛但尚可忍受(NRS评分2 ~4 分),且伴鼻唇增厚等面容改变,未予重视;2 年2 个月后(2015 年2 月)出现停经,至当地医院就诊,以“肢端肥大症”收入院。入院后垂体MRI检查显示鞍区、鞍上占位性病变,血清GH 和IGF⁃1检测结果不详,临床诊断为垂体生长激素腺瘤,并于2015 年2 月行显微镜下经蝶窦入路垂体腺瘤切除术。术后1 年出现严重头痛,尤以双侧颞部和枕部显著,呈间断发作(3 ~4 h/次、1 ~2 次/d),症状较术前明显加重,严重影响生活和工作(NRS 评分8 ~9 分)。经阿片类药物治疗无效,此后并发脑脊液鼻漏(2016 年5 月)和鼻腔囊肿(2016 年10 月),分别经显微镜下脑脊液鼻漏修补术和囊肿切除术治愈,但头痛症状始终未得以改善(NRS 评分8 分)。为求进一步诊断与治疗,至我院就诊。入院后实验室检查血清GH 3.50 μg/L、IGF⁃1 525 μg/L、OGTT 试验GH谷值为2.76 μg/L;垂体MRI 增强扫描显示垂体右翼片状低强化影(图4a),临床诊断为垂体生长激素腺瘤残留。2017 年7 月31 日于神经内镜下行扩大经蝶窦入路垂体腺瘤切除术,术中可见鞍底充满较厚瘢痕组织,鞍内肿瘤大小约为1.50 cm × 1.00 cm ×1.00 cm,呈灰白色、边界不清、与腺垂体粘连紧密,血运较丰富,术中出血约150 ml,手术全切除肿瘤并经病理证实为垂体腺瘤。术后3 天复查MRI 显示鞍区占位性病变消失(图4b);术后7 天头痛症状明显缓解(NRS 评分1 ~2 分),复查GH 3.10 μg/L、IGF⁃1 270 μg/L、OGTT 试验GH 谷值2.92 μg/L。患者共住院21 天,出院后随访至术后3 个月(2017 年11 月)时头痛程度明显缓解(NRS 评分2 ~3 分),血清GH 3.80 μg/L、IGF⁃1 483 μg/L、OGTT 试验GH 谷值为2.07 μg/L,经长效奥曲肽10 mg/月持续治疗1 年9 个月(2019 年9 月),头痛症状仍无明显改善(NRS 评分3 ~4 分),血清GH 为3.10 μg/L。目前仍在随访中。
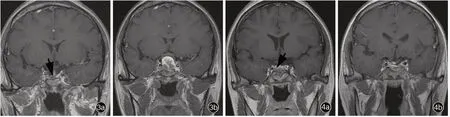
图3 例3 二次手术前后垂体MRI 增强扫描所见 3a 术前冠状位增强T1WI 显示肿瘤残留(箭头所示) 3b 术后冠状位增强T1WI 显示残留肿瘤全切除 图4 例4 二次手术前后垂体MRI 增强扫描所见 4a 术前冠状位增强T1WI 显示肿瘤残留(箭头所示) 4b 术后冠状位增强T1WI 显示残留肿瘤全切除Figure 3 Pituitary enhanced MRI of Case 3 before and after the second operation Coronal enhanced T1WI showed the tumor residual after the initial surgery (arrow indicates, Panel 3a). Coronal enhanced T1WI showed the tumor residual was removed after re⁃operation(Panel 3b). Figure 4 Pituitary enhanced MRI of Case 4 before and after the second operation Coronal enhanced T1WI showed the tumor residual after the initial surgery (arrow indicates, Panel 4a). Coronal enhanced T1WI showed the tumor residual was removed after re⁃operation (Panel 4b).
讨 论
1987 年,Williams 等[9]率 先 报 告6 例 垂 体 腺 瘤相关重度头痛病例,其中5 例诊断为肢端肥大症,尽管受限于当时有限的垂体腺瘤治疗手段(主要植入90Y),但生长抑素类似物显著的镇痛效果已被发现,与安慰剂组相比,生长抑素类似物组患者剧烈头痛症状几乎完全缓解;此后,Levy 等[10]、Marina 等[11]以及Lovato 和Kapsner[12]相 继报 告 垂体 生 长 激素 腺 瘤并发严重头痛病例。我们归纳总结此类患者的临床特点:(1)结合临床表现、实验室内分泌功能测定和影像学检查结果,可明确诊断为垂体生长激素腺瘤。(2)手术切除垂体腺瘤为初始治疗,术后血清GH 和IGF⁃1 水平下降,但无法达到临床治愈标准,且有影像学证据证实肿瘤残留。(3)术后均出现无法忍耐的剧烈头痛,使患者痛不欲生甚至出现自杀倾向。(4)生长抑素类似物治疗可产生戏剧性疗效,治疗后无论血清GH 和IGF⁃1 能否降至正常值范围,头痛症状均可得到缓解。(5)再次手术切除残留肿瘤后头痛症状有所减轻。结合上述临床特点,我们将此类头痛定义为垂体生长激素腺瘤相关顽固性头痛,可能有其独特的发病机制。
垂体腺瘤患者并发头痛临床并不少见[5],一般认为发生机制与肿瘤牵拉硬脑膜或海绵窦有关[13],但也有研究表明垂体腺瘤大小与头痛程度无明确的对应关系[14]。无论是既往文献报道还是对本组病例的观察,均显示手术切除肿瘤并未能长期有效地控制垂体生长激素腺瘤相关顽固性头痛[10⁃11],提示头痛症状并非完全由硬脑膜和海绵窦受累所致。此外,垂体生长激素腺瘤并发的头痛症状与偏头痛症状有部分重叠,偏头痛的发病机制与三叉神经回路和降钙素基因相关肽(CGRP)有关[15],但是生长抑素类似物对急性偏头痛并未显示出与垂体生长激素腺瘤相关顽固性头痛同样良好的镇痛效果[16],表明二者在发病机制上存在差异。除生长抑素类似物外,目前常用的镇痛药如非甾体抗炎药、阿片类药物均不能有效缓解垂体生长激素腺瘤相关头痛[11]。非甾体抗炎药主要通过抑制环氧合酶(COX)以减少前列腺素的合成,从而降低周围神经痛觉敏感性,阿片类药物则是通过激活中枢神经系统μ型受体以发挥镇痛作用,这两类药物对垂体腺瘤相关头痛无效也提示此类头痛有其独特的发生机制。
生长抑素类似物可以有效缓解垂体腺瘤相关头痛[17],有研究显示,短效奥曲肽治疗数分钟内即可使头痛症状明显缓解[9],而长效生长抑素类似物则对头痛症状具有长期缓解作用;但是不同类型的生长抑素类似物具有不同的效果,这可能是由于其对不同生长抑素受体(SSTRs)的亲和力存在一定差异。生长抑素受体属于G 蛋白偶联受体,包括SSTR1 ~5 亚型,激活后可抑制环腺苷酸(cAMP)生成,抑制cAMP 依赖性蛋白激酶A(PKA)活性,进而阻 止GH 分 泌[18],其 中,SSTR1 ~3 和SSTR5 均 表 达于垂体腺瘤细胞表面[19⁃20]。奥曲肽和兰瑞肽为第一代生长抑素类似物,均对SSTR2 具有较高亲和力,同时对SSTR3 和SSTR5 亦有一定亲和力,其中奥曲肽对SSTR5 的亲和力更高、兰瑞肽对SSTR3 的亲和力更高。Levy 等[10]采用生长抑素类似物治疗1 例垂体生长激素腺瘤相关顽固性头痛患者,先以短效奥曲肽50 ~100 μg/次(2 次/d)皮下注射,待头痛症状显著缓解后改用兰瑞肽30 mg/月皮下注射,这种方案虽然可使血清GH 控制在较低水平,但治疗后非但未使患者头痛症状减轻,反而更为严重,提示患者体内的激素水平与头痛症状的改善可能与不同亚型SSTRs 相关。第一代生长抑素类似物对SSTR1和SSTR4 的亲和力较低,而第二代生长抑素类似物帕瑞肽不仅对SSTR5,同时对SSTR1 ~3 也具有较高的亲和力,对SSTR4 亦 有 一定亲和力[21⁃22]。Marina等[11]采用长效奥曲肽和兰瑞肽治疗1 例垂体生长激素腺瘤相关顽固性头痛患者,头痛症状始终无改善,遂改为帕瑞肽40 mg/月皮下注射,症状缓解。Lovato 和Kapsner[12]同样也发现,垂体腺瘤术后应用长效奥曲肽未获得明显疗效即激素水平下降、头痛症状减轻的患者,经帕瑞肽治疗(40 mg/月皮下注射)后血清GH 和IGF⁃1 水平均可达到预期治疗目标,即血清GH <2.50 μg/L、IGF⁃1 于正常值范围,且头痛症状明显缓解。上述研究提示,SSTR1 和SSTR4 可能与疼痛缓解有关。本组4 例患者首次手术后均以长效奥曲肽作为初始治疗方案,1 例(例1)维持治疗2 年余,头痛症状呈渐进性加重,遂改用兰瑞肽治疗,头痛症状明显缓解。
综上所述,尽管垂体生长激素腺瘤相关头痛的发生机制和镇痛机制尚不十分明确,但生长抑素类似物的治疗效果已取得共识。根据既往文献报道和我们的诊疗经验,此类头痛主要出现在手术效果欠佳的垂体生长激素腺瘤患者中,因此,手术彻底切除肿瘤仍为首选治疗方案。对于术后出现严重头痛的患者,除评估肿瘤残留程度和激素水平外,还应排除原发性头痛及其他原因引起的头痛,并行生长抑素类似物诊断性试验。考虑为垂体生长激素腺瘤相关顽固性头痛时,除手术切除鞍区残留肿瘤外,还应予长效生长抑素类似物治疗,持续控制肿瘤生长和缓解头痛症状[11]。
利益冲突无

