长期高效抗反转录病毒治疗对艾滋病患者免疫功能及预后的影响研究
张海生
汕头市中心医院,广东 汕头515031
艾滋病是一种全球性危害极为严重的病毒性疾病,经人类免疫缺陷病毒(HIV)感染的患者常表现为免疫功能低下或抑制,患者免疫细胞活性下降,机体对外界侵袭的病原缺乏防御导致感染,严重患者易诱发恶性肿瘤等病变[1]。关于艾滋病的防治目前主要通过控制传染源及传播途径的方法,传染途径目前主要通过宣传教育降低性传播等危害,而针对传染病原的控制没钱缺乏有效的治疗药物。随着艾滋病防治药物的深入研究,研究者发现持续使用抗反转录病毒药物治疗可以控制病毒扩增,从而降低HIV对患者的持续性侵害[2]。有研究报道使用多种抗反转录病毒联合治疗可以更好的提高患者的生存质量,但是需要患者长期依从治疗[3]。为有效验证及推广上述治疗方法,本研究选择136例经汕头市中医院诊治的艾滋病患者实施治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年1月—2018年12月经汕头市中心医院诊治的136例艾滋病患者为研究对象,按照是否接受长期规律高效抗反转录病毒治疗将其分为观察组和对照组,每组各68例。观察组,男33例、女35例,年龄范围38~56岁,平均年龄(41.34±6.47)岁;病程范围3~11个月,平均(6.45±2.31)月;临床分期60例Ⅱ期、8例Ⅲ期。对照组,男31例、女37例,年龄范围38~55岁,平均年龄(40.78±5.56)岁;病程范围3~10个月,平均(6.37±2.44)月;临床分期有64例Ⅱ期、4例Ⅲ期。两组患者在年龄、性别、病程及临床分期方面均差异不显著(P>0.05),本研究具有可比性。
1.2 纳入及排除标准
纳入标准:(1)临床症状及临床诊断结果均符合《艾滋病诊疗指南》中有关艾滋病的判定标准;(2)均对本次治疗情况知情,且签订知情同意书;(3)对本次治疗中所用药物无过敏反应;(4)除艾滋病病症外,无心、肝及肾等其他脏器功能障碍性疾病;(5)无沟通障碍或精神障碍性疾病。排除标准:(1)临床诊断结果不符合或疑似符合《艾滋病诊疗指南》中有关艾滋的判定标准;(2)对本次治疗不知情或不签订知情同意书;(3)对本次治疗中使用的药物存在过敏反应;(4)伴有其他脏器功能障碍问题或精神沟通障碍问题。
1.3 治疗方法
两组患者经我国艾滋病门诊确诊后,给予高效抗反转录治疗,高效抗反转录治疗方案包括:HIV反转录酶抑制剂拉米夫定(湖南千金湘江药业,H20084604)+核苷酸逆转录酶抑制剂替诺福韦(Patheon Inc,H20180060)+非核苷反转录酶抑制剂依非韦伦(MerckSharp&Dohme,H2013 0135)。依据医生对患者是否接受长期规律接受治疗方案的回访统计结果将入选患者分为观察组和对照组,对照组患者因依从性差,对此治疗方案均不能持续规律的服从;观察组患者均严格按照医生规定,持续接受高效抗反转录治疗方案治疗。此次治疗方案持续12个月,期间每间隔6个月对患者进行一次外周血采集及血样检测,同时不定期回访统计患者病情变化及感染情况。
1.4 观察指标
(1)不同治疗阶段(0天、6个月及12个月)对患者进行外周血采集及检测,统计不同阶段两组患者血液炎性标记物(CRP、TNF-α)水平、CD4+T淋巴细胞总数及CD4/CD8;(2)统计患者治疗期间不同感染类型(细菌感染、病毒感染、真菌感染及混合感染)患者占比及总感染率(细菌感染、病毒感染、真菌感染及混合感染患者总数占各组入选患者比值)。
1.5 统计学方法
采用SPSS16.0进行统计学处理,计数资料以例数和百分比(%)表示,组间比较采用χ2检验;计量资料以均数()表示,组间比较采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者治疗期间血液淋巴细胞数变化比较
通过表1可知,随着治疗时间的延长,两组患者的CD4+T淋巴细胞总数及CD4/CD8比值均呈现上升趋势;治疗第0天,两组患者的CD4+T淋巴细胞总数及CD4/CD8比值均差异不显著(P>0.05);治疗后6个月及12个月,观察组患者CD4+T淋巴细胞总数及CD4/CD8比值均显著高于对照组(P<0.05),见表1。
2.2 两组患者治疗期间炎性标记物水平变化比较
见表2可知,两组患者治疗前后血清CRP及TNF-α均呈现下降趋势,治疗第0天,两组CRP及TNF-α水平均差异不显著(P>0.05);治疗第6个月及第12个月,观察组患者的血清CRP及TNF-α水平均显著低于对照组(P<0.05),见表2。
2.3 两组患者治疗期间不同类型感染患者占比比较
见表3可知,两组患者治疗期间均不同数量的患者发生不同类型感染,在细菌感染、病毒感染、真菌感染及混合感染患者占比方面,对照组感染患者数量均高于观察组,但无统计学差异;观察组患者治疗期间总感染率显著低于对照组(P<0.05)。
表1 不同治疗阶段两组患者血液淋巴细胞水平变化比较()

表1 不同治疗阶段两组患者血液淋巴细胞水平变化比较()
组别观察组(n=68)对照组(n=68)CRP水平(mg/L)TNF-α水平(pg/ml)tP 0天8.01±1.49 7.86±1.22 0.642 0.261 6个月4.87±1.08 6.64±1.13 9.338 0 12个月3.24±0.74 5.12±0.56 16.706 0 0天0.77±0.24 0.73±0.27 0.913 0.181 6个月0.34±0.12 0.52±0.07 10.684 0 12个月0.31±0.10 0.47±0.14 7.669 0
表2 不同治疗阶段两炎性标记物组患者血清炎性因子水平比较()
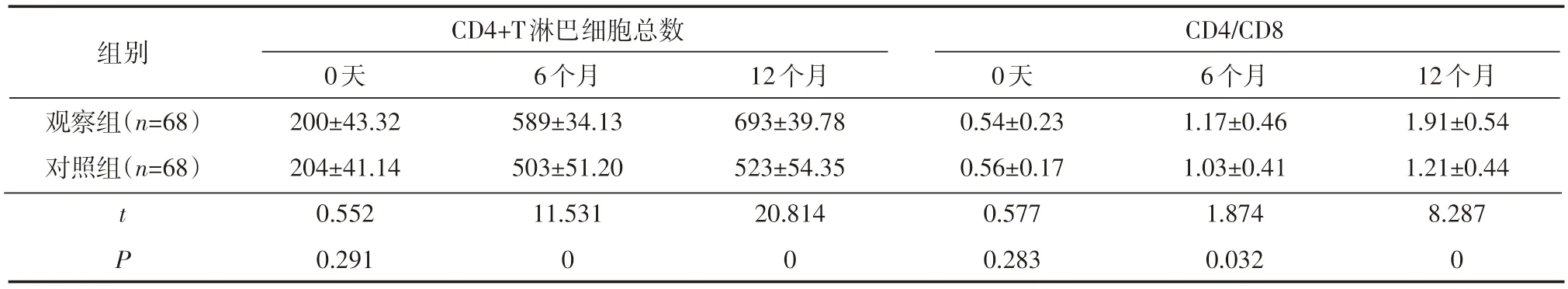
表2 不同治疗阶段两炎性标记物组患者血清炎性因子水平比较()
CD4/CD8组别观察组(n=68)对照组(n=68)CD4+T淋巴细胞总数tP 0天200±43.32 204±41.14 0.552 0.291 6个月589±34.13 503±51.20 11.531 0 12个月693±39.78 523±54.35 20.814 0 0天0.54±0.23 0.56±0.17 0.577 0.283 6个月1.17±0.46 1.03±0.41 1.874 0.032 12个月1.91±0.54 1.21±0.44 8.287 0
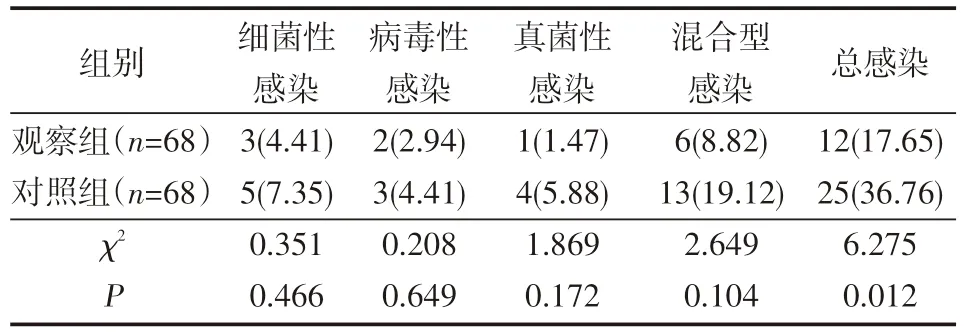
表3 两组患者治疗期间不同类型感染占比比较 例(%)
3 讨论
高效抗反转录病毒治疗是目前全球较为公认的对艾滋病治疗效果较为理想的方案,此方案是基于抑制病毒的复制从而改善患者自身免疫机能恢复或重整,但是由于药物不良反应多等问题,导致有些患者无法依照治疗计划长期依从治疗[4]。艾滋病患者的最大的危害在于自身免疫机能降低或缺失,机体的免疫系统功能无法抵御外源病原的侵袭,从而严重危害患者的生命安全。目前对艾滋病患者的病情发展的分析主要通过患者血清炎性标记物水平以及免疫淋巴细胞总数进行评估,通过对患者自身免疫功能恢复情况以及炎性标记物水平变化从而判定患者病情发展[5]。血清炎性标记物中TNF-α是巨噬细胞生长促进因子,可以促进巨噬细胞对外来病原吞噬,但是对于经HIV侵袭的巨噬细胞释放的TNF-α对促进HIV的复制起到了促进作用;CRP又称C反应蛋白,是机体感染病原后产生的一种蛋白,健康人群血清CRP的浓度小于5 mg/L,高于上述浓度代表患者存在感染、炎症等问题[6]。HIV感染后,患者机体免疫系统受到损伤,其中淋巴细胞损伤严重降低了抗原提呈以及体液免疫,T淋巴细胞中CD4+T淋巴细胞是重要的T辅助细胞,增强机体免疫功能;CD8+T细胞是T杀伤性细胞,参与防控自身免疫性疾病[7]。为了有效衡量机体免疫调节平衡情况,目前国际上将CD4+/CD8+的比值作为患者免疫功能恢复情况的评定标准,正常情况下,血液中CD4+/CD8+范围在1.4~2.0,当此比值高于2.0或低于1.4均代表患者细胞免疫功能紊乱[8-9]。
为有效跟踪验证长期高效抗反转录病毒治疗对艾滋病患者的免疫功能恢复情况及预后效果,本研究回顾性分析了2017年1月—2018年12月经医院诊治的136例艾滋病患者经过一年治疗期后的临床效果。结果显示,治疗后6个月及12个月,接受长期依从治疗的观察组患者CD4+T淋巴细胞总数及CD4/CD8比值均显著高于对照组,且CD4/CD8比值处于正常范围,说明接受长期依从性治疗患者的免疫功能恢复情况显著好于依从性较差的患者;治疗第6个月及第12个月,观察组患者的血清CRP及TNF-α水平均显著低于对照组,结果证实长期给予高效抗反转录病毒治疗可以有效降低患者炎性感染比例,通过抑制HIV病毒复制从而减少对巨噬细胞的侵害;经过对治疗一年内不同类型感染患者比例发现,对照组患者在细菌、病毒及真菌感染比例均高于观察组,观察组患者治疗期间总感染率(17.65%)显著低于对照组(36.76%),此结果与观察组患者血清CRP水平显著低于对照组相符合,有效证实长期接受抗反转录病毒治疗方案后,患者感染率会得到降低。
综上所述可知,对艾滋病患者给予长期高效抗反转录病毒治疗可以显著改善患者免疫功能,降低感染率,对患者后期免疫功能恢复及重置起到了有利的促进作用。

