GnRH长效激动剂方案对PCOS不孕症患者雌孕激素及妊娠结局影响
代先琼 齐小雪 聂敦利 杨青梅 张艺霁
四川省成都市中西医结合医院(610000)
多囊卵巢综合征(PCOS)以慢性无排卵或高雄激素血症为主要特征,下丘脑-垂体-卵巢轴功能紊乱为本病发病主要机制[1]。而无排卵或稀发排卵是PCOS不孕主要原因,诱导排卵对治疗PCOS意义重大[2]。绒毛膜促性腺激素(HCG)通过支持黄体而发挥较持久作用,但同时也增加了卵巢过度刺激综合征(OHSS)、多胎妊娠、下一月经周期卵巢囊肿发生率[3]。促性腺激素释放激素(GnRH)激动剂与拮抗剂可促进卵泡发育,也可在一定程度上限制血清孕酮(P)水平。有研究[4]发现,血清P及P/雌二醇(E2)比值对体外受精/卵泡浆内单精子注射(IVF-ICSI)并行GnRH长效激动剂方案妊娠结局有预测作用。本文主要分析GnRH长效激动剂方案治疗PCOS不孕症患者疗效及对血清E2、P水平、妊娠结局等的影响。
1 资料与方法
1.1 一般资料
以2016年1月—2019年1月本院诊治的PCOS不孕症患者360例为研究对象。纳入标准:①患者稀发排卵或无排卵,有多毛、痤疮等高雄激素临床表现;②超声检查双侧卵巢呈多囊样改变,体积有增大趋势,但至少一侧输卵管通畅;③自愿参与本研究且签署知情同意书。排除标准:①库欣综合征、先天性肾上腺皮质增生、雄激素分泌性腺瘤或高泌乳素血症;②近3个月内有接受激素治疗史;③合并其他激素过多相关性疾病或有原发性内分泌疾病、妇科疾病者。依据所采取治疗方案不同分为两组。本研究获本院伦理委员会批准。
1.2 治疗方法
两组患者均予以克罗米芬或来曲唑促排卵方案,在月经周期第3~5 d口服克罗米芬/来曲唑(用量视患者情况、监测结果而定),于月经第10 d开始经阴道B超监测卵泡发育状态及子宫内膜厚度。最大卵泡直径18~23 mm时,尿LH检测见LH峰,观察组予以GnRH长效激动剂方案,即皮下注射醋酸曲普瑞林0.1 mg/d,,每日监测E2、P、黄体生成素(LH)水平,当LH升高>15 mIU/ml时将剂量调整为0.2 mg/d,当LH下降至10 mIU/ml时将剂量调为0.1 mg/d,共14 d。在下次月经第2~4 d,查空腹血清E2、卵泡刺激素(FSH)、LH水平,达到降调标准后注射重组人促卵泡激素(r-FSH),75~150 IU/d,当3个以上主导卵泡直径》18 mm时停用促性腺激素,注射人绒毛膜促性腺激素(HCG)5000~10000U进行扳机。对照组予以HCG 6000~10000 IU诱导卵泡成熟,在注射诱导排卵药物后36 h指导患者同房或宫腔内人工受精,排卵后给予黄体支持(口服黄体酮胶囊,100 mg/次,2次/d;或口服地屈孕酮,10 mg/次,2次/d),连用14 d。于月经周期第1 d开始测基础体温,体温上升0.3~0.5℃且持续升高》12 d时提示有黄体形成。对未孕者在下一月经周期第3~5 d阴道B超检查,排除卵巢囊肿。本次均为新鲜胚胎移植。
1.3 相关判断标准
①妊娠结局:胚胎移植14 d后,检测空腹血清P、HCG水平,当HCG>5 mIU/ml认为阳性,阳性者2周后再查B超,宫腔内有妊娠囊即为临床妊娠,确定妊娠囊位置与数目[5]。②流产与异位妊娠[5],新鲜胚胎移植后不足12 h流产终止妊娠为早期流产,妊娠12~28周且胎儿体重不足1 kg为晚期流产,着床在子宫腔外为异位妊娠。
1.4 观察指标
①排卵质量:包括子宫内膜厚度、≥14 mm卵泡数目、成熟卵泡数目、优势卵泡数目。②性激素水平;于治疗前、诱发排卵日取晨空腹静脉血,化学发光法(西门子ADVIA Centaur XP化学发光全自动免疫分析仪)测定E2、P、P/E2、LH水平。③妊娠结局:包括受精率、卵裂率、移植胚胎数、优质胚胎率、临床妊娠率、早期流产率、异位妊娠率、OHSS率、下周期囊肿率。
1.5 统计学方法
2 结果
2.1 两组一般临床资料
观察组166例,对照组194例,观察组与对照组在年龄(28.9±2.9岁、29.1±2.9岁)、不孕年限(3.6±0.4年、3.7±0.4年)、体质指数(23.4±2.5 kg/m2、23.5±2.4 kg/m2)等比较无差异(t=0.686、1.229、0.157,P=0.493、0.220、0.875)。
2.2 两组排卵质量
诱发排卵日子宫内膜厚度、≥14 mm卵泡数目、成熟卵泡数目两组无差异(P>0.05),优势卵泡数目观察组多于对照组(P<0.01)。见表1。
2.3 两组激素水平变化
两组诱发排卵日E2、P、P/E2均低于治疗前,LH高于治疗前(P<0.05);且观察组诱发排卵日E2低于对照组,而P/E2高于对照组(P<0.05),但诱发排卵日P、LH水平两组比较无差异(P>0.05)。见表2。
2.4 两组妊娠结局
观察组受精率、卵裂率、优质胚胎率、临床妊娠率均高于对照组,OHSS、下周期囊肿发生率低于对照组(均P<0.05),两组移植胚胎数、早期流产率、异位妊娠率比较无差异(P>0.05)。见表3。
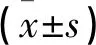
表1 两组排卵质量比较
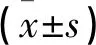
表2 两组不同治疗时期性激素水平比较
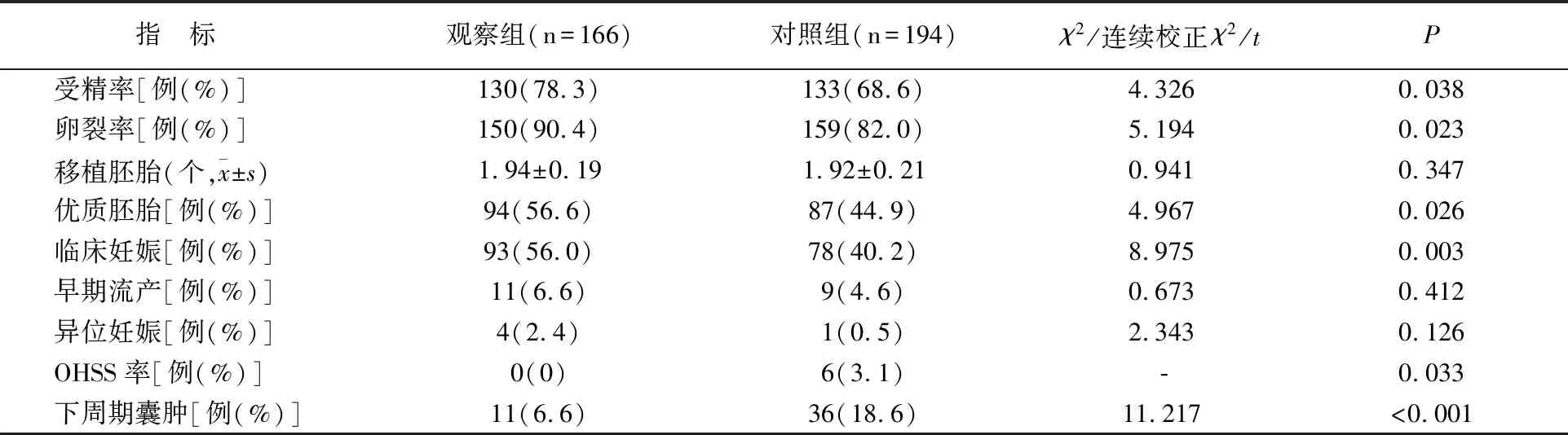
表3 两组妊娠结局比较
3 讨论
PCOS是一种生殖功能障碍与糖代谢异常并存的内分泌紊乱综合征,为其患病率占不孕妇女30%~40%,随年龄增加女性生育力下降,目前较多高龄PCOS妇女选择IVF-ICSI治疗[6]。目前IVF-ICSI促排卵可选择方案有长方案、抗拮抗剂方案、微刺激方案、改良超长方案、超长方案等,其中HCG的结构、生物作用与LH相似,同受体结合而代替月经中期LH峰触发排卵[7],GnRH长效激动方案能使垂体产生内源性类似正常排卵前的LH及FSH峰,适用于卵巢功能好、年轻的不孕患者,且OHSS发生风险较HCG低[8-9]。因此GnRH长效激动方案对PCOS不孕症疗效更佳。
本研究两组诱发排卵日子宫内膜厚度、≥14 mm卵泡数目、成熟卵泡数目未见差异,但观察组优势卵泡数较对照组高,与张媛媛等[10]结果相似,说明相比于HCG,GnRH长效激动方案能更有效提高排卵质量。曲普瑞林与GnRH有较高亲和力,通过与激素受体复合物结合,使FSH、LH短时间内急剧增加,所激发的LH峰、FSH峰与正常内源性周期更接近,并作用卵巢增加颗粒细胞前列素合成,使卵巢组织型纤维蛋白溶解酶原激活因子活性被激活,继而促进卵泡发育、排出,因而观察组的诱发排卵效果较好。同时激发的FSH峰可通过负反馈作用抑制部分小的卵泡闭锁,更利于优势卵泡的形成,联合应用HCG后因HCG与LH结构及生物作用相似,与同一受体结合,使用HCG可替代月经周期LH峰触发排卵,因此GnRH联合HCG利于促进优势卵泡的形成,可提高PCOS患者排卵质量[11]。
在PCOS患者性腺轴功能紊乱,因不规律月经及无排卵月经周期,常有不完善的E2、P分泌,E2、P呈较高水平,LH呈较低水平,刺激免疫应答,促进自身免疫发展[12-13]。Foroozanfard等[14]认为,IVF-ICSI周期中妊娠结局可能受E2、P超生理浓度的影响。本研究两组诱发排卵日E2、P均低于治疗前, LH高于治疗前,且观察组E2水平低于对照组,P/E2高于对照组,表明HCG或GnRH均能有效改善PCOS患者性激素水平,促进排卵,而GnRH改善效果更佳。HCG可持续刺激受体7~9 d,且HCG较LH受体亲和力更强,因而HCG可放大与延长LH的作用,使小卵泡延迟排卵,促进排卵周期中多个黄体形成。曲普瑞林则为天然GnRH类似物,与GnRH受体结合后形成有生物活性的激素受体复合物,促使垂体产生内源性LH峰、FSH峰,刺激FSH及LH释放,较好改善患者激素水平[15]。也有研究[16-17]发现,GnRH激动剂或拮抗剂可能引起P水平升高,其机制与卵泡晚期成熟卵泡数及P分泌量有关[17],PCOS患者内分泌状态有明显异质性,无法完全控制隐匿性LH峰,LH峰的异常升高则常伴随P升高,同时出现于HCG日之前,影响卵子受精率与胚胎卵裂率。本研究未检测到两组诱发排卵日P水平升高现象,可能是因为采用了灵活剂量的GnRH激动剂方案,依据LH、P水平调整剂量,较好地控制了患者内源性隐匿性LH峰的出现。此外在应用GnRH时,对PCOS患者E2下降应密切检测卵泡及激素变化,若GnRH减量导致E2下降时需及时增加GnRH用量,而GnRH对LH的过低抑制也可能影响卵泡发育、子宫内膜容受性与黄体功能,如何适当补充LH活性是后期研究重点[18]。
PCOS患者诱发排卵过程中最关键问题为避免过早排卵或OHSS发生,本研究中观察组受精率、卵裂率、优质胚胎率、临床妊娠率均高于对照组,而OHSS、下周期囊肿发生率低于对照组,与刘宝莲等[19]结果相近。表明GnRH可有效改善PCOS不孕症患者妊娠结局,满足IVF-ICSI对受精质量、卵裂效果、优质胚胎的需求,提高临床妊娠率。HCG因上调生长因子(VEGF)、成纤维生长因子,加上半衰期长等因素更易发生OHSS,而GnRH可同时刺激FSH、LH释放,诱发内源性LH峰短且激活LH受体能力弱,加上不上调VEGF,因此能明显降低OHSS率[20]。此外长效GnRH-a降调节后人工周期可能通过多途径协同作用改善患者子宫内膜容受性,长效GnRH-a能持续作用于丘脑,最初可兴奋垂体,使得促性腺激素分泌增加,后因GnRH-a受体不断消耗,垂体对GnRH-a“脱敏”,抑制FSH、LH分泌,继而达到“卵巢去势”作用;同时与单纯人工周期比较,长效GnRH-a降调节后可完全抑制内源性雌激素、LH释放,避免高雌激素环境、高LH水平对子宫内膜容受性的不良影响,利于胚胎早期种植,提高妊娠率及受精质量,诱发优质排卵。
综上所述,GnRH长效激动方案对PCOS不孕症患者的疗效较好,能较好调节患者性激素水平,提高诱发排卵效果及临床妊娠率,改善妊娠结局。

