特发性肺纤维化患者中睡眠呼吸紊乱的研究
张丽萍,毕小瑞,侯洪艳
(北京市海淀医院/北京大学第三医院海淀院区 呼吸内科,北京 100080)
0 引言
近年来,特发性肺纤维化(IPF)的患病率、发病率呈上升趋势,死亡率也较前增加。阻塞性睡眠呼吸暂停低通气综合征(OSAHS)在呼吸内科较为常见,主要以“夜间睡眠打鼾伴呼吸暂停、白天嗜睡”为特征的睡眠呼吸疾病,严重影响患者的身体健康及生活质量。既往国外研究发现,IPF患者中存在睡眠呼吸结构紊乱,且发病率较高[1]。而国内有关IPF 合并睡眠呼吸紊乱的研究较少。本研究通过对IPF 患者进行多导睡眠图监测,试图探讨IPF 患者中睡眠呼吸紊乱的特征和OSAHS 的发病情况。
1 对象与方法
1.1 对象。样本来源:北京市海淀医院呼吸科门诊就诊或住院患者;样本时间:2015 年1 月至2019 年1 月;样本对象:44 例IPF 患者,诊断依据为中华结核和呼吸杂志2011 年发布的特发性肺纤维化诊治循证指南(摘译本)[2]。排除继发性肺纤维化、排除合并其它慢性呼吸系统疾病,如慢性阻塞性肺病、肺结核等;排除合并慢性心、肝、肾功能不全的患者。其中男性31 例,女性13 例,年龄45-80 岁,平均(64.2±9.4)岁。患者一般资料见表1。
1.2 方法。①采用意大利科时脉公司肺功能仪测量:患者的肺通气功能及弥散功能。指标包括:肺总量占预计值百分比(TLC%pred)、用力肺活量占预计值百分比(FVC%pred)、第1 s 用力呼气容积占预计值百分比(FEV1%pred)、FEV1/FVC、一氧化碳弥散量占预计值百分比(DLCO%pred)。②以Epworth 嗜睡量表进行评价患者睡眠质量,总分24 分,得分越高说明嗜睡现象越严重,评分大于等于9 分认为有白天嗜睡现象。③采用美国Embla 多导睡眠监测仪进行夜间多导睡眠图(PSG)监测,时长≥8 h,内容包括胸腹呼吸运动及外周血氧饱和度(SpO2)、脑电图、心电图、肌电图、眼电图、口鼻气流等。监测结果判定为以下两种情况:a.呼吸暂停。指口鼻气流较基线水平下降≥90%且时间持续≥10 s;b.低通气。与基线水平相比,口鼻气流速度下降≥30%,并伴SpO2下降≥4%,且持续时间不低于10 s,或口鼻气流速度下降不低于50%,伴SpO2下降≥3%,持续时间≥10 s。睡眠呼吸暂停低通气指数(AHI)主要是指患者平均1 h 内上述两种症状出现的次数;微觉醒指数是指睡眠期间平均1 h内发生的微觉醒次数;氧减指数(ODI)指睡眠期间平均1 h内发生血氧下降的次数。依据AHI 进行OSAHS 疾病严重程度判定,5 次/h ≤AHI<15 次/h、15 次/h ≤AHI<30 次/h、AHI ≥30 次/h 分别对应轻度、中度、重度。
1.3 统计学处理。44 例IPF 患者调查数据采用SPSS 17.0 统计包分析。多导睡眠图监测结果及睡眠评分用()表示。P<0.05 为差异显著。
2 结果
2.1 肺功能测定。IPF 患者的肺功能显示限制性通气功能障碍及弥散功能减退(结果见表1)。
2.2 多导睡眠图监测结果分析。44 例IPF 患者均存在夜间外周血氧饱和度的下降,睡眠结构紊乱,睡眠效率降低,微觉醒指数、睡眠分期I 期和II 期比例增加,III 期、快速动眼睡眠期(REM 期)比例减少。参与本次研究的44 例IPF 患者中,有68%(30 例)的患者合并OSAHS,其中14%(6 例)为轻度,54%(24 例)为中重度;而其余的14 例患者AHI 小于5 次/h,未达到OSAHS 的诊断标准,诊断为鼾症(结果见表2、表3)。
表1 IPF 患者一般资料
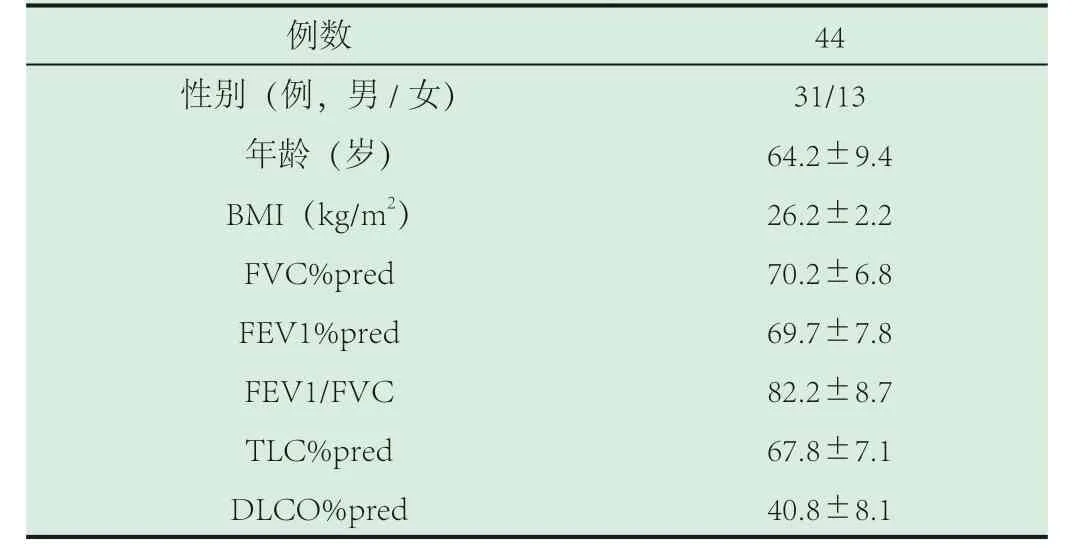
表1 IPF 患者一般资料
例数 44性别(例,男/女) 31/13年龄(岁) 64.2±9.4 BMI(kg/m2) 26.2±2.2 FVC%pred 70.2±6.8 FEV1%pred 69.7±7.8 FEV1/FVC 82.2±8.7 TLC%pred 67.8±7.1 DLCO%pred 40.8±8.1
表2 44 例IPF 患者多导睡眠图监测结果及睡眠评分

表2 44 例IPF 患者多导睡眠图监测结果及睡眠评分
睡眠效率(%) 70.3±10.2微觉醒指数(次/h) 23.4±10.1 I 期睡眠(%) 14.5±4.3 II 期睡眠(%) 63.6±4.7 III 期睡眠(%) 10.4±3.2 REM 期(%) 11.3±2.2 AHI(次/h)20.4±10.7 ODI(次/h)22.6±9.8 SpO2<0.90 比例(%) 16.5±8.4临睡前清醒时SpO2 92.8±2.0 ESS 评分 8.1±2.3
表3 AHI ≥5 次/h 的IPF 患者多导睡眠监测结果及睡眠评分

表3 AHI ≥5 次/h 的IPF 患者多导睡眠监测结果及睡眠评分
例数 30性别(例,男/女) 22/8年龄(岁) 64.4±9.0睡眠效率(%) 67.6±9.4微觉醒指数(次/h) 28.3±9.1 I 期睡眠(%) 15.6±3.9 II 期睡眠(%) 63.9±4.2 III 期睡眠(%) 9.2±3.0 REM 期(%) 10.1±2.8 AHI(次/h)29.8±12.4 ODI(次/h)30.5±10.3 SpO2<0.90 比例(%) 18.7±8.2 ESS 评分 9.2±3.1
3 讨论
特发性肺纤维化(IPF)是特发性间质性肺炎中最常见的一种,临床表现为干咳、渐进性呼吸困难或活动后气喘等。阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是常见的睡眠呼吸疾病。既往对OSAHS 的研究多集中在慢性阻塞性肺病患者,而最新的美国胸科学会(ATS)指南已经将OSAHS作为IPF 的合并症之一[3]。Perez-Padilla 等[4]研究显示,间质性肺疾病患者睡眠质量恶化、睡眠结构改变,存在睡眠片段化及夜间低氧现象。Mermigkis 等[5]研究发现IPF 患者睡眠效率及慢波睡眠比例降低,睡眠分期I 期比例及微觉醒指数增加,患者的日常功能受到影响。本研究所示IPF 患者存在睡眠结构紊乱,睡眠效率降低,微觉醒指数、睡眠分期I 期和II 期比例增加,III 期、快速动眼睡眠期(REM 期)比例减少,与既往研究一致。Mermigkis 等[6]另一项研究显示18 例IPF 患者合并OSAHS 的比例为61%(11 例)。Lancaster 等[1]研究显示,IPF 患者合并OSAHS 的概率大大增加,50 例IPF 患者中OSAHS 的发病率为88%(44 例)。参与本次研究的44 例患者中,有30 例(68%)患者合并OSAHS,其中6 例为轻度,24 例为中重度;进一步证实了IPF 患者中OSAHS 的高发病率。
当前,学界关于IPF 并OSAHS 的发生机制尚未完全阐明,临床多认为与IPF 导致上气道阻力、容量发生异常改变所致。特发性肺纤维化存在明显换气功能障碍,随着疾病进展,机体呈现缺氧状态,影响大脑中枢神经对低氧的敏感性,由于上述两种因素相互作用,增加了患者夜间呼吸事件发生风险。虽然最新指南不主张使用激素,但既往临床中常常用激素来治疗IPF,长期使用激素可引起肥胖、颈部脂肪堆积,从而使IPF 中OSAHS 的发病率增加。
目前IPF 缺乏有效的治疗药物,优化睡眠及生活质量是治疗IPF 合并OSAHS 的首要目标[7]。持续气道正压通气(CPAP)治疗合并OSAHS 的IPF 患者,通过面罩使气道维持正压,增加上气道稳定性,防止上气道塌陷,能在很大程度上缓解患者的嗜睡症状,提高注意力。Mermigkis 研究表明,合并OSAHS 的IPF 患者经过CPAP 治疗后,其睡眠质量、生活质量均有所提高[8]。
综上所述,OSAHS 在IPF 患者中发病率高,影响患者的日常功能和生活质量,故建议对IPF 患者均进行PSG 监测,及早发现IPF 患者中睡眠呼吸紊乱问题。尽早通过CPAP 治疗,可能会达到改善症状、提高生活质量的目的。

