肝脏≤2cm局灶性病变动态增强MRI和MDCT的诊断价值*
1.海南医学院第二附属医院放射科(海南 海口 570311)
2.海南省海口市中医医院放射科(海南 海口 570216)
贾乃龙1 王松海2 李传资1
肝脏局灶性病变是局灶性结节性增生、肝腺瘤、肝癌、胆管细胞癌、肝转移瘤等一系列肝脏占位性病变的统称,其诊断及良恶性鉴别一直是临床研究的难点[1]。近年来,随着影像学技术的不断发展,肝脏局灶性病灶的检出率有了明显提高,但受扫描技术、病灶大小、血供、分化程度及对比剂的特异性等多因素影响,对于≤2cm的肝脏局灶性病变的检出与定性诊断仍有一定困难[2]。动态对比增强MRI(DCE-MRI)是一种被广泛用于肝脏肿瘤性病变临床诊断及预后随访的功能性影像学检查方法[3]。钆塞酸二钠(Gd-EOB-DTPA)是一种新型的肝胆特异性对比剂,经静脉注射后快速渗透过肝内毛细血管网,分布于细胞外间隙并迅速达平衡状态,为病变诊断提供更多信息[4]。本研究旨在探究Gd-EOB-DTPA DCE-MRI和多排螺旋CT(MDCT)在≤2cm肝脏局灶性病变诊断中的应用价值,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析我院2017年10月~2018年10月经术后病理或临床随访证实的36例≤2cm肝脏局灶性病变患者的临床资料,其中男28例,女8例,年龄30~75(52.84±9.45)岁;病灶直径0.5~2cm;良性病变15例,恶性病变21例。
1.2 检查方法
1.2.1 MDCT检查:仪器选择美国GE公司Light VCT 64排螺旋CT,先行全肝平扫再行增强扫描,120kV,自动毫安,噪声指数8,层厚5mm,层间距5mm。常规二次拆薄重组,重组层厚1.25mm,层间距1.25mm,进行多平面重组。经高压注射器团注碘普罗胺(德国Bayer Vital GmbH,300mgI/mL),注射剂量95mL,注射速率3~4mL/s。使用Smart技术检测腹主动脉,当阈值达150HU时,启动肝动脉期扫描,延迟30s静脉期扫描,扫描时间3~5s。
1.2.2 DCE-MRI检查:仪器选择德国西门子Verio 3.0T MRI成像仪,造影剂为Gd-EOB-DTPA(德国Bayer Vital GmbH)。使用呼吸门控技术,自膈顶至双肾下极扫描,行常规平扫及增强扫描。平扫采用脂肪抑制(FS)技术行TSE T2WI(TE 2500ms,TE 104ms,矩阵277×384,视野36cm×36cm,翻转角150°,层厚5.0mm,层间距1.0mm)、三维容积内插屏气检查(3D VIBE)(TE 4.87ms,TE 2.35~2.48ms,矩阵167×256,视野27cm×27cm~36cm×36cm,翻转角10°,层厚2.5~5.0mm)和2D GRE T1WI(TE 170ms,TE 5.0ms,矩阵180×256,视野36cm×36cm,翻转角70°,层厚5.0mm,层间距1.0mm)。经外肘静脉团注Gd-EOB-DTPA行增强扫描,0.025mmol/kg,2mL/s,随后立即以相同速率注射生理盐水冲洗导管。注射后18~23s(动脉期)、45~50s(门静脉期)、120s(平衡期)分别行3D FS VIBE全肝扫描,参数同平扫。
1.3 图像分析 由2名高年资影像医师采用双盲法阅片,采用5分法统计病灶,5分:肯定存在;4分:可能存在;3分:不确定;2分:肯定不存在;1分:肯定不存在。以4~5分为阳性,1~3分为阴性。
1.4 统计学分析 应用SPSS 19.0软件处理数据,计数资料行χ2检验;并绘制受试者工作特征曲线(ROC曲线),计算ROC曲线下面积(AUC),分析DCE-MRI和MDCT对肝脏局灶性病变的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果 共197枚病灶。良性病灶28枚(14.21%),其中血管瘤16枚(8.12%),肝硬化结节5枚(2.54%),脂肪瘤2枚(1.02%),腺瘤2枚(1.02%),局灶性结节性增生3枚(1.52%);恶性病灶169枚(84.79%),其中肝细胞癌50枚(25.38%),肝管细胞癌25枚(12.69%),肝转移瘤94枚(47.72%)。45.9%,AUC为0.508,DCE-MRI对病灶的检出优势也更明显(见图2)。ROC曲线。
2.4 典型病例 见图3-8。
3 讨 论
2.2 DCE-MRI和MDCT对肝脏局灶性病变的诊断差异 本组36例患者中良性病变15例,恶性病变21例,其中16例经病理证实,20例经随访证实。DCE-MRI准确诊断28例,诊断符合率为77.79%,MDCT准确诊断20例,诊断符合率为55.56%。DCE-MRI对肝脏局灶性病变的诊断符合率显著高于MDCT,差异有统计学意义(χ2=4.000,P<0.05)。且MDCT检出的病灶,DCE-MRI均全部检出,而DCE-MRI检出的<1cm病灶,MDCT多未能检出。
2.3 DCE-MRI和MDCT检测肝脏局灶性病变的ROC曲线经ROC曲线分析 对于1~2cm肝脏局灶性病变,DCE-MRI检查诊断的敏感度及特异度分别为86.2%、90.4%,AUC为0.850,MDCT检查的敏感度及特异度分别为63.8%、54.9%,AUC为0.536,DCE-MRI对病灶的检出优势更明显(图1);对于<1cm肝脏局灶性病变,DCE-MRI检查诊断的敏感度及特异度分别为90.2%、86.5%,AUC为0.882,MDCT检查的敏感度及特异度分别为50.7%、
多数肝脏肿瘤患者确诊时已处于疾病晚期,失去手术机会,只能行保守治疗,可耐受手术治疗的患者由于远处转移,肿瘤恶性程度高等因素影响,其预后也不佳[5-6]。随着近年来肝胆特异性造影剂的应用日益广泛,使用肝胆特异性造影剂进行肝细胞期成像已成为肝脏局灶性病变影像学检查的重要关键[7]。目前常用的特异性造影剂主要是以金属钆为基础成分的顺磁性物质,以Gd-EOB-DTPA和钆贝葡胺(Gd-BOPTA)为代表,且二者比较,Gd-EOBDTPA肝脏摄取率(50%)明显高于Gd-BOPTA(2%~4%),Gd-EOB-DTPA胆道及肾脏排泄量相当,而Gd-BOPTA约96%经肾脏排泄,可导致肾脏负荷增加[8]。MDCT增强剂主要经肾代谢,对部分肾功能不全者可增加其肾功能损伤风险,因此临床应用价值亦不高[9]。而Gd-EOB-DTPA可经胆道及肾脏双途径代谢,其胆道分流代谢作用可显著提高肾功能损伤患者的检查安全性,降低肾损伤风险[10]。
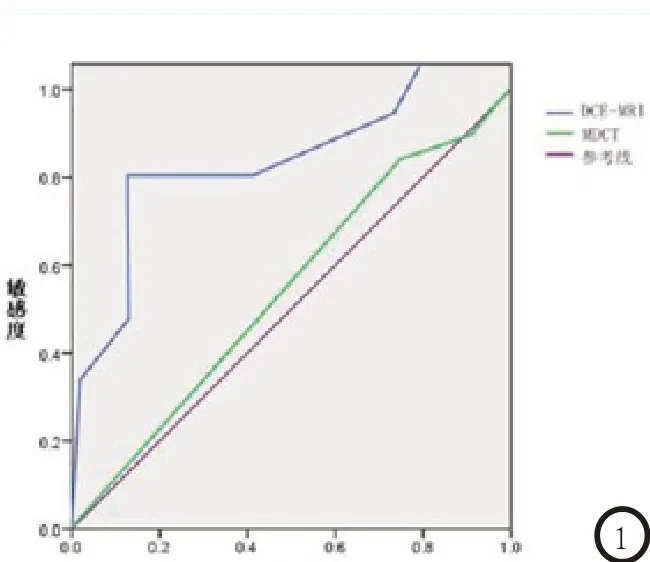
图1 1~2cm肝脏局灶性病变;

图2 <1cm肝脏局灶性病变。
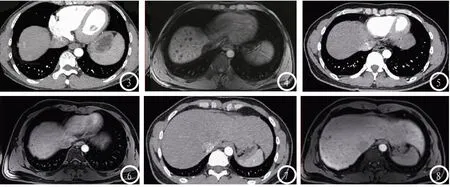
图3-4 男性,40岁,肝转移瘤。图3 MDCT示肝右叶近膈顶部动脉期结节状轻度强化灶。图4 DCEMRI示相同层面肝脏次部位有多个大小不等(直径多<1cm)的结节状低信号病灶。图5-8 男性,48岁,肝细胞癌。图5 MDCT示动脉期肝实质未见异常密度影。图6 DCE-MRI示肝右叶边缘可见多发结节状低信号影。图7 MDCT示肝实质密度均匀,未检出异常密度强化灶。图8 DCE-MRI示肝左、右叶实质内可见结节状低信号影。
Saito S等[11]研究证实Gd-EOB-DTPA在肝癌细胞肝胆期特异性摄取与有机阴离子转运多肽(OATP)及钠离子/牛黄胆酸共转运蛋白(NTCP)相关。且Gd-EOB-DTPA转运至肝脏后,由肝细胞特异性吸收并经胆管排泄,这一作用与多重耐药相关蛋白(MRP)中MRP2及MRP3相关[12]。Gd-EOB-DTPA虽然肝胆特异性较高,但部分受损肝细胞无法摄取Gd-EOB-DTPA,导致肝实质期病灶信号强度降低,影响DCE-MRI的诊断敏感性。目前国际上将<2cm的低血供肝癌结节定义为小肝癌(sHCC)。Böttcher J等[13-14]多项研究认为,DCE-MRI诊断价值更高,在MDCT无法准确诊断时,Gd-EOB-DTPA DCE-MRI检查可有效鉴别及定性诊断肝脏肿瘤。本研究发现DCE-MRI对肝脏局灶性病变的诊断符合率显著高于MDCT,且MDCT检出的病灶,DCEMRI均全部检出,而DCE-MRI检出的<1cm病灶,MDCT多未能检出。而联合Gd-EOB-DTPA DCE-MRI检查可尽早发现、诊断病变,对患者的临床治疗及预后具重要临床价值。进一步行ROC曲线分析,无论是对于1~2cm肝脏局灶性病变还是<1cm的肝脏局灶性病变,DCEMRI检查诊断的敏感度及特异度均明显高于MDCT,对病灶的检出优势也更明显,其原因可能在于部分<1cm的肝细胞癌、肝转移瘤、血管瘤、再生结节的分化程度及病理成分复杂,受血管生成、血供等多方面因素影响无法准确诊断。但本研究亦具一定局限性,如研究样本量较小,无法对整个肝脏进行病理评估,可能导致部分漏诊。
综上所述,联合Gd-EOB-DTPA DCE-MRI检查可为≤2cm肝脏局灶性病变的早期发现提供准确影像学依据,诊断价值明显优于MDCT检查,且对<1cm的肝脏局灶性病变的诊断价值更佳,对指导患者的临床治疗有重要临床意义。

