血清NT-proBNP、D-二聚体、ST2水平与COPD合并呼吸衰竭患者预后的相关性分析
孙彩玲 张华钊 孙淑红
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)为常见呼吸系统慢性疾病,常发于老年人群,以不完全可逆气流受限为临床特点,病情呈进行性加重,可进展为肺心病,威胁患者生命健康[1]。COPD 急性加重期,肺功能严重受限,易出现低氧血症及二氧化碳潴留,导致Ⅱ型呼吸衰竭(简称呼衰),Ⅱ型呼衰也是COPD 急性加重期常见且严重的并发症,能引起致残率、病死率增加,影响患者预后生存质量[2]。因此,及时检测患者病情进展,判断预后,对COPD 合并Ⅱ型呼衰诊疗非常重要。氨基末端B 型钠尿肽原(N-terminal pro-brain natriuretic peptide,NT-proBNP)作为一种心力衰竭的常用生化标志物,近年发现,其水平与呼衰严重程度密切相关[3]。D-二聚体(D-dimer,D-D)为反映机体血凝状态的重要指标,D-D 的升高与机体纤溶系统激活及血栓形成相关,而缺氧可增加凝血与纤溶机能紊乱,故D-D 水平也与COPD 合并Ⅱ型呼衰病情具有一定相关性[4]。人基质裂解素(human matrix lysin,ST2)为白细胞介素-1(interleukin-1,IL-1)受体家族的新成员,在炎症及变态反应性疾病中具有重要作用,目前,有研究表明,血清ST2 水平能随COPD 等肺部疾病的严重程度升高而变化,且与患者预后状态相关[5]。本研究评估入院时血清NT-proBNP、D-D、ST2 水平对患者预后的预测价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年3月至2019年7月本院112例COPD 合并Ⅱ型呼衰患者为研究对象。纳入标准:符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》[6]中COPD 诊断标准及Ⅱ型呼衰诊断标准;年龄>18 岁。排除标准:合并心、肾等重要脏器功能障碍;伴免疫系统、造血系统疾病;既往神经精神疾病史;合并意识障碍;合并肺栓塞、肺脓肿等肺部其他疾病。112例COPD 合并Ⅱ型呼衰患者男性67 例,女性45 例;年龄(68.45±9.25)岁。并纳入同期健康体检者56 例作为健康对照组。所有患者及家属均已签署知情同意书。且经本院医学伦理委员会审批。
1.2 方法
所有COPD 合并Ⅱ型呼衰患者均在入院时采取股动脉血及外周静脉血,使用血气分析仪(丹麦雷度公司)检测动脉血PaO2、PaCO2;使用电化学发光法(试剂盒由德国罗氏公司生产)检测血清NT-proBNP;采用全自动血凝仪(日本希思美康公司)检测D-D 水平;使用酶联免疫分析法(试剂盒由北京北方生物技术研究所生产)检测ST2 水平;采用COPD 评估测试(COPD assessment test,CAT)[7]评估临床症状,CAT 总分0~40 分,分数越高,临床症状越严重。并根据30 d 内预后情况分为死亡组(预后不良组)及生存组(预后良好组)。56 例健康对照组则采取空腹股动脉血及外周静脉血,检测方法同上述COPD 合并Ⅱ型呼衰患者。
1.3 统计学方法
应用SPSS 21.0 软件进行数据分析;计量资料以()表示,2 组间比较采用独立样本t检验,3组间比较采用单因素方差分析;计数资料以n(%)表示,采用χ2检验;采用受试者工作特征曲线(ROC 曲线)评估血清NT-proBNP、D-D、ST2 水平对COPD 合并Ⅱ型呼衰患者不良预后的预测价值,计算曲线下面积(AUC);以P<0.05 为差异有统计学意义。
2 结果
2.1 3 组基线资料比较
112例COPD 合并Ⅱ型呼衰患者入院后30 d 死亡31 例(27.68%),纳入预后不良组;生存81 例(72.32%),纳入预后良好组;3 组性别比较,差异无统计学意义(P>0.05);预后不良组与预后良好组年龄、PaO2比较,差异无统计学意义(P>0.05),但年龄均高于健康对照组(P<0.05),PaO2均低于健康对照组(P<0.05);3 组PaCO2比较,为预后不良组>预后良好组>健康对照组(P<0.05);且预后不良组CAT 评分高于预后良好组(P<0.05);见表1。
表1 3 组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data among the 3 groups[n(%),(±s)]
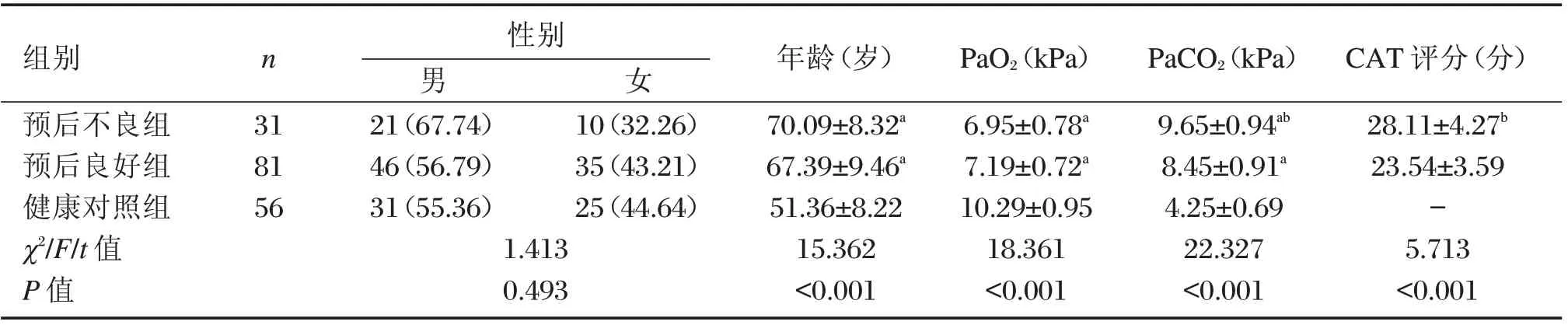
表1 3 组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data among the 3 groups[n(%),(±s)]
注:与健康对照组比较,aP<0.05;与预后良好组比较,bP<0.05。
组别预后不良组预后良好组健康对照组χ2/F/t 值P 值n 31 81 56性别男21(67.74)46(56.79)31(55.36)1.413 0.493女10(32.26)35(43.21)25(44.64)年龄(岁)70.09±8.32a 67.39±9.46a 51.36±8.22 15.362<0.001 PaO2(kPa)6.95±0.78a 7.19±0.72a 10.29±0.95 18.361<0.001 PaCO2(kPa)9.65±0.94ab 8.45±0.91a 4.25±0.69 22.327<0.001 CAT 评分(分)28.11±4.27b 23.54±3.59-5.713<0.001
2.2 3 组血清NT-proBNP、D-D、ST2 水平比较
3 组血清NT-proBNP、D-D、ST2 水平比较,均为预后不良组>预后良好组>健康对照组(P<0.05),见表2。
表2 3 组血清NT-proBNP、D-D、ST2 水平比较(±s)Table 2 Comparison of levels of serum NT-proBNP,D-D and ST2 among the 3 groups(±s)

表2 3 组血清NT-proBNP、D-D、ST2 水平比较(±s)Table 2 Comparison of levels of serum NT-proBNP,D-D and ST2 among the 3 groups(±s)
注:与健康对照组比较,aP<0.05;与预后良好组比较,bP<0.05。
组别预后不良组预后良好组健康对照组F 值P 值n 31 81 56 NT-proBNP(pg/mL)773.51±73.35ab 602.82±69.90a 216.54±41.09 89.465<0.001 D-D(ng/mL)617.09±71.08ab 458.21±76.98a 156.41±23.36 117.361<0.001 ST2(ng/L)541.66±70.59ab 380.77±71.38a 105.49±20.36 145.471<0.001
2.3 血清NT-proBNP、D-D、ST2 水平预测COPD合并Ⅱ型呼衰患者不良预后的价值分析
经ROC 曲线分析,发现血清NT-proBNP、DD、ST2 水平均对COPD 合并Ⅱ型呼衰患者不良预后具有较高预测价值(AUC=0.955、0.931、0.946,P<0.05),其cut-off 值分别为709.66 pg/mL、532.47 ng/mL、463.48 ng/L,见表3、图1。
3 讨论
COPD 合并Ⅱ型呼衰为临床危重症,患者常伴不同程度氧供失衡、炎症反应、内皮细胞受损、微循环障碍等病理状态,若未得到及时有效治疗,可诱发其他器官功能衰竭,也使该病具有较高致残率及致死率[8]。因此,如何准确评估病情进展、尽早预测患者预后,成为学术界研究的热点及难点。近年来,血清学检测在诊断学领域飞速发展,血清学指标具有检测方便、快速等优点,临床接受度较高[9]。对此,本研究就血清NT-proBNP、D-D、ST2 水平对COPD 合并Ⅱ型呼衰患者预后的预测价值展开分析,为COPD 合并Ⅱ型呼衰的诊疗提供新靶点,取得一定成果。

表3 血清NT-proBNP、D-D、ST2 水平预测COPD 合并Ⅱ型呼衰患者不良预后的价值Table 3 Value of serum NT-proBNP,D-D and ST2 in predicting the poor prognosis of patients with COPD and type Ⅱrespiratory failure

图1 血清NT-proBNP、D-D、ST2 水平预测COPD 合并Ⅱ型呼衰患者不良预后的ROC 曲线Figure 1 ROC curves of serum NT-proBNP,D-D and ST2 in predicting the poor prognosis of patients with COPD and type Ⅱrespiratory failure
本研究结果显示,112例COPD 合并Ⅱ型呼衰患者入院后30 d 死亡率为27.68%,与Hilty 等[10]报道的28%一致。表明COPD 合并Ⅱ型呼衰患者近期死亡风险较高,临床应及时评估患者预后,尽早予以干预措施,改善患者预后状况。另外,预后不良组PaCO2、CAT 评分均高于预后良好组,这也提示,二氧化碳潴留及临床症状严重者,预后差,该结果与向薇等[11]研究结果一致。向薇等[11]还认为,随着二氧化碳潴留的加重,机体酸中毒也更严重,而增加呼吸抑制、心脏功能受损等症状体征,加速病情进展,使患者预后不佳。但PaCO2等血气分析指标仅能评估酸碱平衡状态,CAT 评分也仅用于评估患者临床症状,故探寻其他更加准确、全面的评估指标,有其必要性。
谈定玉等[12]提出,COPD 合并呼衰的严重缺氧状态下,可诱导心肌细胞受损,且使机体肺动脉收缩,增加心脏负荷,诱发心功能衰竭。而NT-proBNP 作为反映心力衰竭情况的生化指标,对评估心功能受损程度有重要作用[13]。
Xu 等[14]也指出,纤溶系统、血凝状态也与COPD 合并Ⅱ型呼衰病情进展密切相关。COPD 患者长期处于缺氧状态,在合并Ⅱ型呼衰时,内皮细胞损伤急剧增加,导致微循环瘀滞,机体可进入血栓前期,这一高凝状态由刺激纤溶系统改变,使血栓形成风险进一步升高[15]。本研究中,预后不良组血清D-D 水平高于预后良好组,且D-D 对COPD 合并Ⅱ型呼衰患者不良预后具有较高预测价值。提示入院时伴高D-D 水平者,可能处于血液高凝状态,出现心脑血管事件风险较高,预后较差[16]。而D-D 预测COPD 合并Ⅱ型呼衰患者不良预后的cutoff 值为532.465 ng/mL,提示临床应在入院时积极检测血清D-D,在其水平高于532.465 ng/mL 时,应注意患者血液高凝状态,予以针对性干预措施,减少心脑血管事件,降低患者死亡风险。
炎症反应及免疫系统紊乱也是影响COPD 合并Ⅱ型呼衰患者预后的重要因素,炎症反应增强、免疫系统失衡可增加气道水肿程度,加重呼吸困难症状及呼吸循环紊乱,引起不良预后[17]。ST2 作为一种新型炎症因子,可选择性表达于Th2 细胞,参与Th2 细胞为主的炎症反应,且有学者发现,血清ST2 水平与呼吸困难严重呈显著正相关[18]。本研究结果显示,预后不良组血清ST2 水平高于预后良好组,且ST2 对COPD 合并Ⅱ型呼衰患者不良预后具有较高预测价值。究其原因可能与入院时血清ST2 水平较高者,机体炎症反应及免疫功能紊乱状态更严重,使入院治疗期间病情加速进展,预后不良有关[19]。本研究中,血清ST2 预测COPD 合并Ⅱ型呼衰患者不良预后的cut-off 值为463.48 ng/L,说明当患者入院血清ST2>463.48 ng/L时,机体炎症水平较高、病情较为严重,临床应予以重点监控,改善患者预后。
综上所述,血清NT-proBNP、D-D、ST2 水平对预测COPD 合并Ⅱ型呼衰患者不良预后的价值较高,临床应积极进行入院血清NT-proBNP、D-D、ST2检测,尽早评估患者预后状况,为诊疗提供依据。

