TACE联合射频消融对中期肝癌患者血清GP73、AFP、AFP-L3的影响
孟令武 李月圆 李志彬 李明玉
经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)为中晚期原发性肝癌(hepatocellular carcinoma,HCC)首选治疗方案[1]。TACE 后受新生血管产生以及侧支循环建立等因素的影响,单纯TACE 较难达到理想治疗效果,综合治疗已成为TACE 技术发展的主要方向[2]。射频消融(radiofrequency ablation,RFA)为局部微创治疗方法之一,研究发现TACE 联合RFA 治疗HCC 患者可获得理想治疗效果[3]。研究表明TACE 后甲胎蛋白(alpha fetoprotein,AFP)的检测为HCC 临床诊治工作指明了方向[4],由此揭开了关于HCC 患者治疗前后分子生物学标志物水平变化的研究热点。研究表明高尔基体糖蛋白-73(golgi glycoprotein-73,GP73)在HCC 早期诊治中灵敏度高于AFP[5]。甲胎蛋白异质体-3(alpha fetoprotein heterogeneity-3,AFP-L3)则是新近发现HCC 诊断标志物[6]。但目前国内有关TACE 联合RFA 治疗中晚期HCC 近期疗效及对血清GP73、AFP、AFP-L3 水平影响尚处于初步探索阶段,加之晚期HCC 存活率较低临床随访研究受限,为此本文展开临床前瞻性研究,旨在为中期HCC 患者早期诊治提供参考。
1 资料与方法
1.1 临床资料
选取2015年1月至2017年10月本院收治的中期HCC 患者为研究对象。纳入标准:符合《原发性肝癌规范化病理诊断指南(2015年版)》[7]中期HCC 诊断标准,入院后经增强电子计算机断层扫描(computed Tomography,CT)或腹部超声检查确诊为HCC;未出现肝内血管侵犯或肝外转移;自愿参与本研究,签署书面知情同意书;未接受全身放化疗。排除标准:严重肝肾功能不全;存在重度出血倾向;严重高血压;合并心脏病及糖尿病;严重腹水或肝静脉、动脉瘘;明显黄疸或腹腔积液。纳入300 例中期HCC 患者,根据非随机临床同期对照研究及患者自愿原则,分为对照组(n=150)及实验组(n=150),两组一般资料比较差异无统计学意义(P>0.05),有可比性,见表1。本研究征得本院医学伦理委员会批准同意。
表1 两组一般资料比较[(n=150,(±s)]Table 1 General data of the 2 groups[(n=150,(±s)]
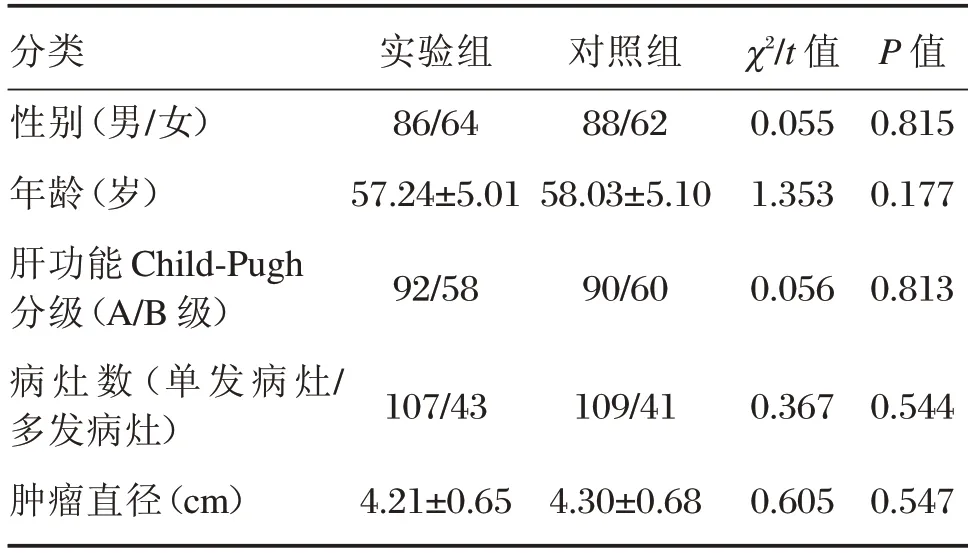
表1 两组一般资料比较[(n=150,(±s)]Table 1 General data of the 2 groups[(n=150,(±s)]
分类性别(男/女)年龄(岁)肝功能Child-Pugh分级(A/B 级)病灶数(单发病灶/多发病灶)肿瘤直径(cm)实验组86/64 57.24±5.01 92/58 107/43 4.21±0.65对照组88/62 58.03±5.10 90/60 109/41 4.30±0.68 χ2/t 值0.055 1.353 0.056 0.367 0.605 P 值0.815 0.177 0.813 0.544 0.547
1.2 试剂/仪器
主要试剂:5-氟尿嘧啶(上海经科化学科技有限公司)、奥沙利铂(武汉远启医药化工有限公司)、GP73、AFP、AFP-L3 试剂盒均由上海瑞番生物科技有限公司提供,超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒由北京热景生物技术有限公司提供。主要仪器:1.5T MR 数字减影血管造影和LightSpeed VCT 64 层螺旋CT(美国通用电气公司)、彩超(荷兰飞利浦,型号:iU22)等。
1.3 研究方法
①对照组:TACE 治疗,患者术前半小时肌注地西泮,常规消毒铺巾,局麻成功后,穿刺股动脉并注射对比剂,数字减影血管造影下对瘤灶行准确定位,对供血动脉行插管,将非离子型碘化油对比剂5 mL、5-氟尿嘧啶2 g、奥沙利铂200 mg 注入插管中,在血管造影引导下明胶海绵以及聚乙烯醇颗粒注入靶血管,导管拔出后对穿刺部位行加压包扎,持续5 天,1 次/月,3 个月为一个疗程,术后12 h确保患者下肢维持制动状态,密切关注穿刺部位是否渗血、血肿及皮纹等。②实验组:在TACE 治疗基础上联合RFA,TACE 操作步骤同对照组,在TACE 完成后15 d 开展RFA 治疗,对患者电针预插部位皮肤行常规消毒,局麻成功后,彩超引导下射频电极插入肿瘤组织,穿刺成功后将射频发生装置进行连接,消融功率约60 W(起始20 W,6 min 后逐渐增加至60 W),消融温度80℃,时间为12 min,≤3个球灶单针消融,4~6 个球灶双刀联合消融,耐受性差者建议分次行消融,为确保瘤灶彻底杀灭,射频消融范围需延长到正常组织1 cm。术后患者均行常规保肝、抗炎等治疗一周左右。
1.4 疗效评估
治疗结束后6 个月,实体瘤疗效评价标准(evaluation criteria of solid tumor efficacy,RECIST)[8]评估患者近期疗效,完全缓解(complete remission,CR):瘤灶消失维持时间≥4 个月;部分缓解(partial remission,PR):瘤灶体积缩小≥30%且维持4 周;疾病稳定(stabilization disease,SD):瘤灶体积缩小<30%或增大小于20%;疾病进展(progression disease,PD):瘤灶体积增大>20%或出现新病灶。总有效率=(CR+PR)/总例数×100%。
1.5 观察指标
①血清指标检测:治疗前、治疗结束后采用酶联免疫吸附法检测血清GP73、AFP 和AFP-L3 水平;放射免疫沉淀法检测两组患者血清超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)。②预后随访:治疗后均定期随访1、2年,末次随访时间为2019年10月,比较两组复发率、总生存率,复发定义:随访时经CT 或磁共振成像扫描检查发现新生瘤灶;总生存是从入院开始日期到随访截止日期仍存活的病例数。③不良反应发生情况。
1.6 统计学处理
采用SPSS 20.0 统计软件行分析,计数资料用%表示,组间比较行χ2检验,计量资料以()表示,组间比较行独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组实验近期疗效比较
两组实验在近期疗效结果显示,实验组近期有效率明显高于对照组,差异具有统计学意义(P<0.05),见表2。
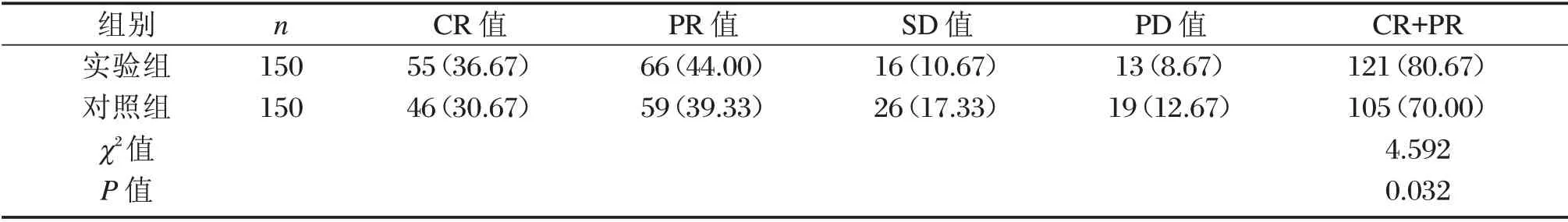
表2 两组近期疗效比较[n(%)]Table 2 Short-term curative effect in the two groups[n(%)]
2.2 血清GP73、AFP、AFP-L3 水平比较
与同组治疗前比较,治疗后两组GP73、AFP、AFP-L3 水平明显降低,且实验组明显低于对照组,差异具有统计学意义(P<0.05),见表3。
2.3 氧化应激指标比较
与同组治疗前比较,治疗后两组SOD、MDA 水平明显升高,差异具有统计学意义(P<0.05),治疗后两组比较差异无统计学意义,(P>0.05),见表4。
2.4 预后随访
治疗后1年复发率、治疗后1、2年总生存率比较差异无统计学意义(P>0.05),见表5。
2.5 两组不良反应发生情况比较
两组不良反应总发生率比较差异无统计学意义(P>0.05),见表6。
表3 治疗前后两组血清GP73、AFP、AFP-L3 水平比较[n,(±s)]Table 3 Serum GP73,AFP and AFP-L3 levels in the 2 groups before and after treatment[n,(±s)]

表3 治疗前后两组血清GP73、AFP、AFP-L3 水平比较[n,(±s)]Table 3 Serum GP73,AFP and AFP-L3 levels in the 2 groups before and after treatment[n,(±s)]
注:与同组治疗前比较,均aP<0.05。
组别GP73(ng/mL)AFP(ng/mL)AFP-L3(%)n 150 150 150时间治疗前治疗后治疗前治疗后治疗前治疗后实验组246.18±12.89 107.26±8.91a 380.13±39.76 121.56±11.96a 49.62±4.19 17.28±1.63a对照组245.98±12.95 162.57±9.96a 379.98±40.40 215.69±16.47a 50.07±4.24 23.65±2.43a t 值0.134 50.690 0.032 56.639 0.925 26.663 P 值0.893<0.001 0.974<0.001 0.356<0.001
表4 治疗前后两组氧化应激指标比较[n=150,(±s)]Table 4 Oxidative stress indexes in the 2 groups before and after treatment[n=150,(±s)]
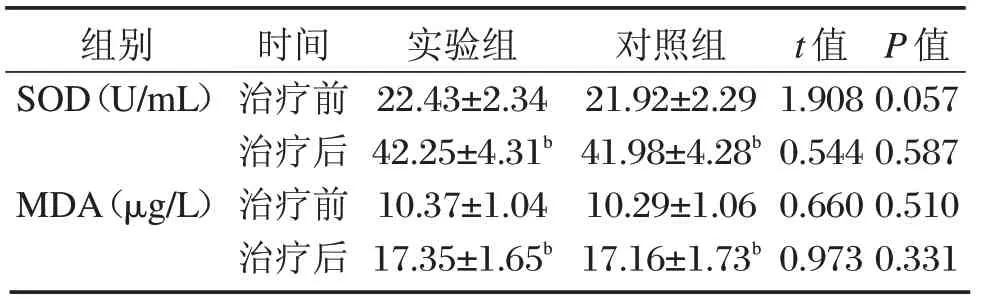
表4 治疗前后两组氧化应激指标比较[n=150,(±s)]Table 4 Oxidative stress indexes in the 2 groups before and after treatment[n=150,(±s)]
注:与同组治疗前比较,均bP<0.05。
组别SOD(U/mL)时间治疗前实验组22.43±2.34对照组21.92±2.29 t 值1.908 P 值0.057 MDA(μg/L)治疗后治疗前治疗后42.25±4.31b 10.37±1.04 17.35±1.65b 41.98±4.28b 10.29±1.06 17.16±1.73b 0.544 0.660 0.973 0.587 0.510 0.331
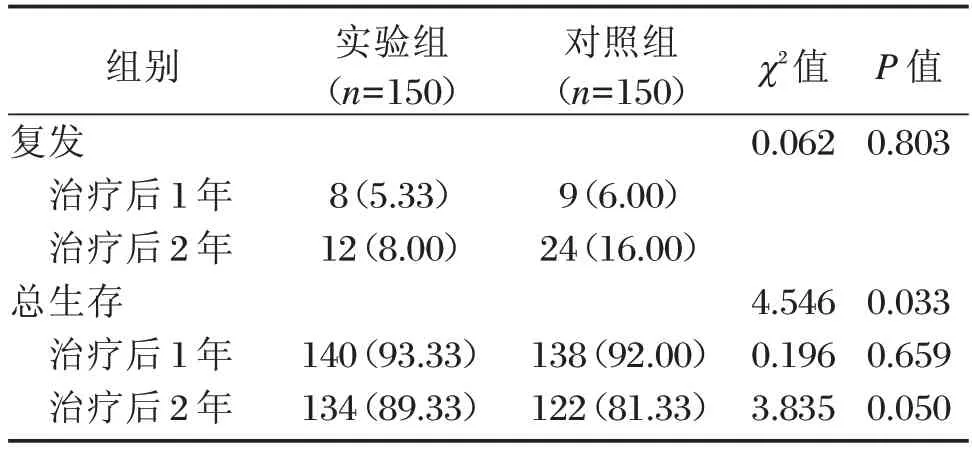
表5 两组预后随访情况比较[n(%)]Table 5 Prognosis of the 2 groups[n(%)]
表6 两组不良反应发生情况比较[n(%)]Table 6 Adverse reactions in the two groups[n(%)]
3 讨论
单纯TACE 治疗中期HCC 的疗效并不理想[10]。近年来国内外学者主张对HCC 患者采取综合疗法,尤其是TACE 联合RFA 在HCC 患者中的应用日益被重视。匡远黎等[11]文献报告指出TACE 联合RFA 治疗中晚期HCC 患者是安全可行的,国外学者也证实TACE 联合RFA 治疗可明显提高HCC 患者临床疗效[12]。TACE、RFA 治疗均属于有创操作,治疗中会引起机体氧化应激反应,SOD、MDA 则是评估机体氧化应激反应的有效指标,因而临床有必要密切关注TACE 联合RFA 治疗中期HCC 患者血清AFP、GP73、AFP-L3、SOD、MDA 水平变化。
Soichiro 等学者[13]研究表明HCC 患者TACE治疗前采用RFA 治疗可有效缩小瘤灶体积,而本研究结果表明TACE 联合RFA 治疗中期HCC 患者近期疗效优于TACE 单独治疗,因此考虑联合治疗近期疗效更佳。本结果还提示TACE 联合RFA 治疗中期HCC 患者可有效抑制GP73、AFP、AFP-L3 水平表达并降低患者复发风险。尽管目前国内外关于TACE 联合RFA 治疗前后HCC 患者血清GP73、AFP、AFP-L3 水平变化的研究不多,但相关研究指出血清GP73、AFP、AFP-L3 水平与肝癌病灶内细胞增殖、血管新生以及术后肝外转移复发密切相关,因此本研究推测联合治疗可提高近期疗效并降低复发率,或与联合治疗可更有效杀灭肿瘤细胞继而降低血清GP73、AFP、AFP-L3 水平有关。
本研究还提示TACE 联合RFA 治疗不会增加机体氧化应激反应,临床应用中有一定安全性。而本研究证实的TACE 联合RFA 治疗中期HCC 患者可有效降低术后2年复发率,与张庆永等[14]学者观点相符。不同的是本研究证实无论联合治疗还是单一TACE 治疗对中期HCC 患者近期复发率和生存率的影响相当,可能与张庆永等的研究样本量不多或对象来源较集中导致结果存在一定偏倚有关。
综上,TACE 联合RFA 治疗中期HCC 患者是安全可行的,不仅近期疗效佳,且可有效降低GP73、AFP、AFP-L3 水平,有一定临床推广应用优势。

