中老年女性乳腺癌患者骨丢失的临床研究
黄际远 郑洪银 肖翊
四川省医学科学院/四川省人民医院核医学科,四川成都610072
乳腺癌是世界上女性发病率最高的恶性肿瘤,占女性全部肿瘤的25%,每年死亡人数超过52万[1]。乳腺癌筛选试验以及更多有效治疗方法的出现使其死亡率逐年下降[2]。乳腺癌诊断和治疗后需长期随访,骨质疏松、糖尿病、肥胖、心血管疾病等是在对患者随访期间发现的高危因素[3]。女性绝经期前后雌激素水平下降,骨快速丢失,而乳腺癌的一些辅助治疗与骨丢失及骨折风险增高有关[4-5]。指南推荐乳腺癌患者应接受骨质疏松风险评估和治疗干预[6]。DXA对乳腺癌患者骨质疏松筛查及疗效评估有较高效价比[7]。本文将分析我院339例乳腺癌患者骨密度及骨质疏松患病情况,为患者骨健康管理及治疗干预提供参考依据。
1 研究对象与方法
1.1 研究对象
选取2010年2月至2017年12月在四川省人民医院接受治疗的乳腺癌患者339例作为乳腺癌组,年龄(61.8±11.3)岁,病程1月~15年。其中浸润性导管癌336例,导管内乳头状癌伴粘液癌1例,乳腺粘液癌1例,鳞癌1例。排除标准:引起继发性骨质疏松的各种疾病;全身骨显像提示骨转移;合并其他肿瘤者。乳腺癌组与对照组按1∶4纳入,从5 105名健康女性中随机选择1 356名作为对照组。全部为健康体检者,通过问诊及检查排除以下情况:有骨折病史、患有引起继发性骨质疏松的各种疾病、服用影响骨代谢的药物、患有严重肝肾功能损害及子宫或卵巢手术切除术后者。
1.2 方法
1.2.1 骨密度测量:选取GE LUNAR公司生产的Prodigy advance双能X线骨密度仪,每天按常规进行仪器质量控制,测量变异系数<1%。测定受试者腰椎(L1~4)、左侧股骨颈(neck)、大转子(troch)、Ward三角区、股骨干(shaft)、全髋(total)骨密度,单位为 g/cm2,变异系数(CV)分别为:0.87%、2.20%、2.97%、1.60%、0.97%、0.99%。采用美国GE公司MG双探头SPECT/CT,按骨显像常规操作行全身骨显像检查。
1.2.2 骨质疏松诊断[8]:以 DXA T-score为金标准,T-score≤-2.5 为骨质疏松,-2.5<T-score<-1为骨量减少,T-score≥-1为骨量正常。体质量指数(kg/m2)=W(kg)/H(m)2;亚洲骨质疏松自我评价工具(osteoporosis self-assessment tool for asians,OSTA)=0.2×(体重-年龄)[9]。
1.3 统计学分析
通过SPSS 17.0统计软件进行数据的整理和分析。以10岁为1年龄组分别计算各组BMD值,结果以珋x±s表示。BMD及参数之间相关性用Pearson相关分析。乳腺组与对照组间BMD及参数比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组、对照组BMD水平比较
随着年龄增长,乳腺癌组、对照组BMD逐渐降低。乳腺癌组腰椎、股骨干、全髋在40~49岁组BMD低于对照组,50~80岁BMD高于对照组。乳腺癌组左侧股骨颈、大转子40~59岁年龄段BMD低于对照组,60~80年龄段高于对照组。乳腺癌组Ward三角区各年龄组BMD均低于对照组。不同年龄乳腺癌组、对照组比较BMI无显著性差异(P>0.05),见表 1。
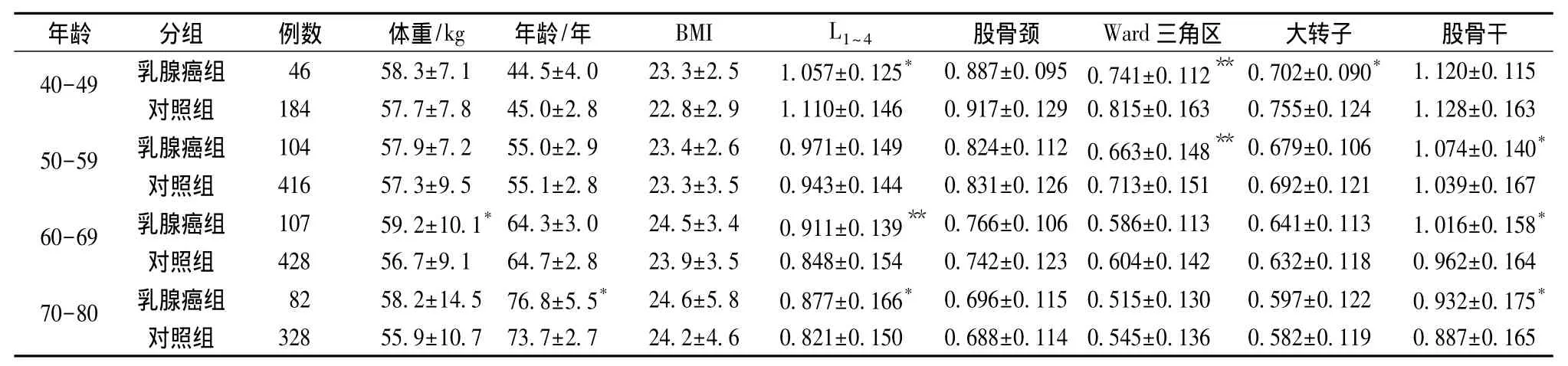
表1 不同年龄乳腺癌与对照组BMD(g/cm2)及一般资料比较Table 1 Comparison of BMD(g/cm2)and baseline characteristics between breast cancer and control groups
2.2 乳腺癌组与对照组骨丢失比较
随着年龄增加,乳腺癌组与对照组腰椎及股骨BMD累积丢失率增加。乳腺癌组腰椎、股骨干、总髋骨累积丢失率40~49岁组高于对照组,50~80岁年龄段低于对照组。乳腺癌组Ward三角区骨累积丢失率高于对照组。乳腺癌组骨股颈、大转子40~59岁年龄段骨丢失率高于对照组,60~80岁年龄段则低于对照组(见表2)。

表2 乳腺癌与对照组腰椎及股骨BMD累积丢失率(%)Table 2 The accumulative bone loss percentage at different skeletal sites in breast cancer and control groups(%)
2.3 乳腺癌组不同参数与BMD的相关分析
乳腺癌组身高、体重与 BMD呈正相关(r=0.277~0.398),与年龄及 BMD呈负相关(r=-0.441~-0.546)。BMI与BMD呈正相关(腰椎r=0.130~0.283;股骨 r=0.101~0.242)。OSTA 与BMD呈正相关(腰椎 r=0.535~0.591;股骨 r=0.382~0.592)。OSTA与BMD相关系数明显高于BMI,差异均有统计学意义(P<0.01)。见表3。

表3 乳腺癌组不同参数与腰椎、股骨BMD相关分析Table 3 Pearson correlation analysis of predictor variables and BMD of lumbar vertebrae and femur
2.4 乳腺癌与对照组OP检出率比较
随着年龄增加,乳腺癌组、对照组OP检出率逐渐增加。对照组不同年龄段腰椎OP检出率高于乳腺癌组。50~80岁年龄段股骨OP检出率高于乳腺癌组。乳腺癌组、对照组L1~4OP检出率分别为74例(21.83%)、439例(32.37%);乳腺癌组、对照组股骨 OP检出率分别为 49例(14.99%)、277例(20.43%)。见图 1、图 2、表 4。
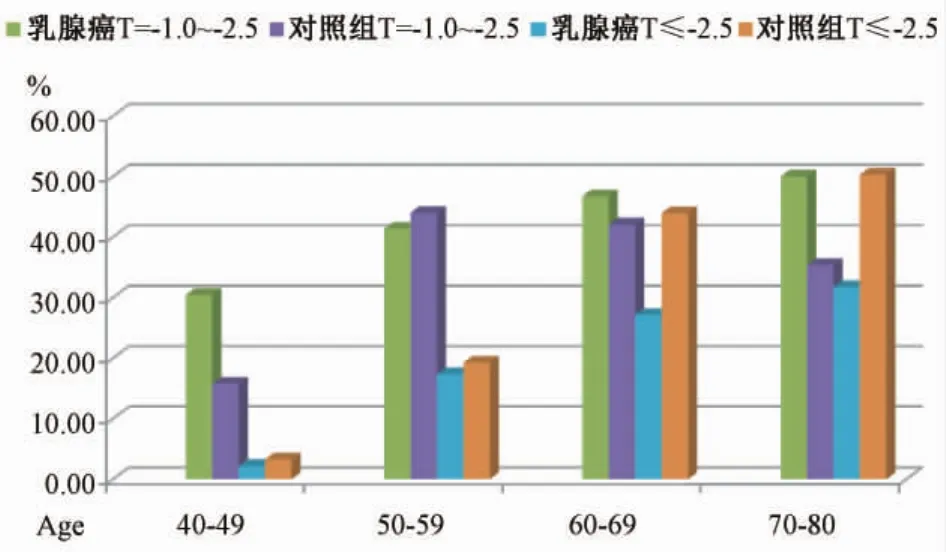
图1 乳腺癌组与对照组不同年龄腰椎 T-score分布比较(%)Fig.1 Comparison of L1-4 T-score distributions between breast cancer and control groups(%)
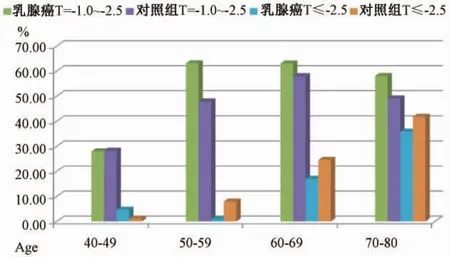
图2 乳腺癌组与对照组不同年龄股骨T-score分布比较(%)Fig.2 Comparison of femur T-score distributions between breast cancer and control groups(%)

表4 乳腺癌组、对照组不同年龄骨质疏松分布情况Table 4 Prevalence of OP in different age groups in breast cancer and control groups
3 讨论
随着乳腺癌患者生存时间的不断延长,人们开始重视存活者的生活质量,与治疗相关的骨丢失及骨质疏松骨折日益受到关注[10-12]。文献显示BMD较高者乳腺癌的发生风险也相对较高,一项入组70 878例绝经后女性和1 889例绝经后乳腺癌的荟萃分析[13]显示,腰椎和髋骨的BMD每增加一个标准差,乳腺癌患病风险分别增加 26%和 20%。Grenier等[14]的研究也提示高 BMD与乳腺癌风险增高有关。高BMD与乳腺癌关系可能基于长期高雌激素水平暴露,同时也增加乳腺癌的发病率[15]。骨密度与乳腺癌相关机制可能是受到内源性雌激素水平影响,雌激素通过与雌激素受体结合,直接调节成骨细胞的骨形成和破骨细胞的骨吸收;雌激素与其受体相结合,作用于腺上皮,促使乳腺肿瘤的发生与发展[16]。本组资料显示,乳腺癌组50岁以上的腰椎、股骨干、总髋及60~80岁年龄段的大转子、股骨颈骨密度均高于对照组,但本文为横断面研究,是否高BMD与乳腺癌发病率增加有关尚无确切证据。
随着年龄增长,乳腺癌组与对照组BMD均呈快速丢失,与既往文献一致[17]。健康女性及乳腺癌患者绝经以后雌激素水平均快速下降,成骨细胞活性减低,骨形成和钙盐沉积减少;甲状旁腺素活性增加,破骨细胞活跃,骨吸收增加、转换加快,导致骨量的快速丢失。但不同年龄、不同部位乳腺癌组与对照组骨丢失仍有差别,50岁以前对照组腰椎BMD较高,50岁以后则相反,两组股骨不同部位BMD也不同。文献[18]显示骨的不同部位达到峰值的年龄及水平不同,不同骨骼部位、同一部位不同区域的皮质骨、松质骨含量不一致,骨丢失时间和比例也不同。Riggs等[19]通过QCT对健康人群体积骨密度的研究显示,女性皮质骨、松质骨骨丢失并不同步。松质骨在年轻时已开始丢失,围绝经期加速,中年以后皮质骨开始丢失。本组资料显示,对照组50~80岁年龄段腰椎、股骨骨累积丢失率高于乳腺癌组,提示健康人群与乳腺癌患者不同年龄及骨骼部位骨丢失存在差异。
体重、BMI与BMD呈正相关,是骨质疏松的重要影响因素,与国内外文献报道一致[20-22]。其机理可能与身体重量带来的机械压力、肌肉拉力及激素变化等几方面有关。较高的BMI可使骨组织所承受的机械负荷加大,减少骨吸收而刺激骨形成,有利于提高骨强度和骨矿物含量。在指南中低BMI被当作OP的危险因素,低BMI乳腺癌患者更需积极治疗干预 OP[6,8-9]。本次研究显示,BMI与 BMD 呈正相关,但随增龄变化不明显,不能反映随着增龄女性骨快速丢失及OP患病率的增加。OSTA与BMD相关系数明显高于BMI,提示OSTA对女性乳腺癌OP风险预测明显优于BMI。OSTA是根据年龄和体重计算筛选OP高危人群的一种简便方法,对亚洲国家妇女进行OP的危险性筛选时效果较好[23]。原发性OP诊治指南推荐OSTA作为评估骨质疏松风险的工具[9]。笔者对成都地区健康中老年女性OP筛查中使用OSTA效果较好,可作为骨质疏松DXA检查人群初筛工具[24]。综上OSTA可作为乳腺癌OP风险预测工具之一。
乳腺癌化疗和内分泌治疗会降低患者的血清雌激素水平,加速骨流失,造成骨质疏松和骨折风险增加[25-26],但不同文献报道不完全一致。Ferreira等[27]以112例乳腺癌和224例健康人群为研究对象,结果表明股骨颈低骨量和OP患病率远高于对照组达,但健康对照样本较少,没有进行不同年龄分层比较。Peppone等[28]对550例乳腺癌和6 673例无肿瘤人群对比中发现,乳腺癌患者发生OP(OR=1.32)和跌倒(OR=1.23)几率更高。乳腺癌、非肿瘤组OP分别为33.4%和27.7%,但此研究也没有进行年龄分层,乳腺癌组年龄明显高于非肿瘤组。本组乳腺癌患者40~49岁组OP发生率较低,但腰椎、股骨低骨量人群分别占30.43%和27.91%,对照组腰椎、股骨低骨量人群分别占15.76%和28.26%,提示女性40岁以后应重视骨质疏松防治。不同文献之间差异的因素包括乳腺癌及健康人群样本量大小、年龄及其他OP危险因素分层对比、治疗方法的影响等。
本文结果显示50岁以后乳腺癌组BMD高于对照组,OP患病率低于对照组。原因可能包括:乳腺癌患者确诊前BMD高于健康人群;确诊乳腺癌后内分泌及相关治疗可引起骨丢失增加,但患者同时进行OP了治疗;健康女性绝经后亦处于骨快速丢失期但忽视了OP的防治。本次研究也存在一定的不足,为横断面研究,没有考虑治疗方法及时间的影响,同时也没有讨论BMD改变对骨折风险影响。

