半枝莲诱导大肠癌干细胞凋亡
魏丽慧,张晶晶,王 舒,方 翌,陈友琴,彭 军,林久茂*
(1. 福建中医药大学中西医结合研究院,福建 福州350122;2. 福建省中西医结合老年性疾病重点实验室,福建 福州350122;3. 福建中医药大学药学院,福建 福州350122)
大肠癌是常见的恶性肿瘤之一。 在我国,其发病率和病死率在恶性肿瘤中排第3 位和第5 位[1]。手术、化疗和放疗仍是临床上治疗大肠癌常用的策略,这些方法虽然能减少肿瘤的体积,但不能有效解决复发、转移的问题,特别转移性患者治疗后5年的生存率低于50%[2]。 研究发现,大肠癌干细胞是大肠癌细胞中占据一小部分比例的细胞群,具有自我更新、无限增殖的能力,在大肠癌的发生发展以及治疗后肿瘤复发、转移等过程中发挥着关键的作用[3-5]。 半枝莲(Scutellaria barbataD. Don)作为天然药用植物,具有清热解毒、利尿、散瘀等功效,临床多用于治疗肺癌、大肠癌等肿瘤性疾病[6-11]。课题组前期研究表明,半枝莲可通过调节miRNA 及Wnt、HH 等信号传导通路抑制大肠癌细胞增殖、 肿瘤血管生成和诱导细胞凋亡[12-17],并且具有抑制大肠癌细胞中干细胞比例的作用[18],但具体的抑制作用机制尚未阐明。 因此,本文以大肠癌干细胞为切入点,探讨半枝莲对大肠癌干细胞的作用及其调控机制。
1 实验材料
1.1 实验药物和细胞株 半枝莲购于福建中医药大学国医堂;人大肠癌SW480 细胞株购于上海中科院细胞库。
1.2 实验试剂 Leibovitz’s L-15 培养基、DMEM/F12 培养基、0.25%胰蛋白酶、 胎牛血清、B-27 Sup plement、Antibiotic-Antimycotic、StemPro Accutase cell Dissociation Reagent(美国Thermo Fisher Scientific公司);AnnexinV-APC/PI 凋亡试剂盒(江苏凯基生物技术股份有限公司);human EGF、human FGFbasic(美国Peprotech公司);台盼蓝(美国Amresco公司);mRNA 逆转录试剂盒、SYBR Premix Ex TaqⅡ试剂盒(美国TaKaRa公司);Bcl-2、Bax、GAPDH、二抗(美国Cell Signaling Technology 公司)。
1.3 实验仪器 超净工作台(苏州净化设备有限公司);二氧化碳培养箱、低速离心机(美国Thermo Fisher Scientific 公司);倒置显微镜系统(德国Leica公司);细胞计数仪(美国CountStar 公司);MOFLO XDP 分选型流式细胞仪(美国Beckman coulter 公司);Realtime-PCR 仪(美国ABI 公司);化学发光凝胶成像系统(美国Bio-Rad 公司)。
2 实验方法
2.1 常用试剂配制
2.1.1 半枝莲溶液配制 参考文献[18]制备半枝莲乙醇提取物,用DMSO(50%)+PBS(50%)配制成母液浓度为500 mg/mL 的溶液,超声溶解后,储存于-20 ℃冰箱备用。
2.1.2 大肠癌干细胞培养液配制 在无添加胎牛血清的DMEM/F12 培养基中加入20 ng/mL EGF、20 ng/mL bFGF、1×B27 Supplement 和1% Antibiotic-Antimycotic。
2.2 大肠癌干细胞培养 运用SP 细胞分选法分离大肠癌干细胞[19];分选得到的细胞用PBS 清洗1 次,加入大肠癌干细胞培养液,接种在低粘附6 孔板培养板,放培养箱中常规进行培养。 每两天添加培养液,当细胞生长至汇合度达80%左右时,加入StemPro Accutase cell Dissociation Reagent(干细胞消化酶)进行消化,观察细胞变圆且部分漂浮时加入2 倍体积含10% FBS 的L-15 培养液终止消化,1 000 r/min 离心3 min,弃上清,收集沉淀细胞,用干细胞培养液重悬制成单细胞悬液后传代或接板。
2.3 细胞形态学观察 将培养后的大肠癌干细胞按1×105个/mL 细胞密度接种于6 孔培养板中,每孔体积为2 mL,置于37 ℃细胞培养箱中培养48 h,分别用不同浓度半枝莲(0、0.25、0.5、0.75 mg/mL)干预24 h 后,用PBS 清洗1 次,用倒置显微镜观察细胞密度。
2.4 细胞存活率检测 上述“2.3”中干预的细胞,拍照后,加入干细胞消化酶进行消化收集细胞,用干细胞培养液进行重悬,取10 μL 细胞悬液与10 μL 0.4%的台盼蓝混匀,加入计数板中,在CountStar 细胞计数仪中计数,计算细胞存活率。

2.5 DAPI 检测细胞凋亡 用不同浓度半枝莲干预大肠癌干细胞24 h 后,用PBS 清洗1 次,制成细胞涂片,加入4%多聚甲醛进行细胞固定,15 min 后用PBS 清洗3 次,加入DAPI 溶液孵育15 min,再用PBS 清洗3 次,封片后用倒置荧光显微镜进行观察并拍照。
2.6 流式细胞仪检测细胞凋亡 用不同浓度半枝莲干预大肠癌干细胞24 h 后,用干细胞消化酶进行消化,收集的细胞用PBS 清洗1 次,加入200 μL 的Assay Buffer 进行重悬,并加入5 μL Annexin V-APC及5 μL PI,室温避光孵育15 min,再添加200 μL的Assay Buffer,用流式细胞仪检测细胞凋亡情况。
2.7 Bcl-2、Bax mRNA 检测 用不同浓度半枝莲干预大肠癌干细胞24 h 后,加入1 mL 的Trizol,按常规方法提取总RNA,测定浓度后取1 μg 样本进行逆转录, 参考逆转录试剂盒步骤; 得到的cDNA按照SYBR Premix Ex Taq Ⅱ试剂盒的步骤添加PCR 反应液,放入PCR 仪中进行扩增反应,以β-actin作为内参,采用2-ΔΔCT相对定量计算获得每组基因表达的水平。
2.8 Bcl-2、Bax 蛋白检测 以不同浓度的半枝莲干预大肠癌干细胞24 h 后,离心后去除上清,用PBS(预冷)清洗2~3 遍,加入裂解液RIPA,在冰上裂解15~20 min,用BCA 试剂盒进行浓度的测定。采用10% SDS-PAGE 胶进行电泳(90 V,40 min;120 V,50 min),电泳结束进行转膜,转膜后封闭液封闭1~2 h,PBS-T 缓冲液中充分振荡清洗;根据目的蛋白的分子量加入相应的一抗(Bcl-2、Bax、β-actin)进行孵育,4 ℃过夜。 孵育结束后,采用TBS-T 进行清洗。 加入相应的辣根过氧化物酶标记的二抗,室温孵育1 h。 最后用ECL 化学发光法显色,于化学发光凝胶成像系统检测蛋白的表达。
2.9 统计学分析 数据采用SPSS 24.0 统计软件进行处理。 结果用(x±s)表示;先进行正态性检验和方差齐性检验,满足条件者,两组比较采用t 检验;未满足条件者,两组比较用Wilcoxon 秩和检验。
3 结 果
3.1 半枝莲对大肠癌干细胞生长的影响 不同浓度的半枝莲处理大肠癌干细胞后,在倒置显微镜下观察大肠癌干细胞的形态变化,结果如图1 所示,对照组细胞生长较密集, 呈现良好的成球生长,半枝莲干预后,细胞数量明显减少,球体变小。
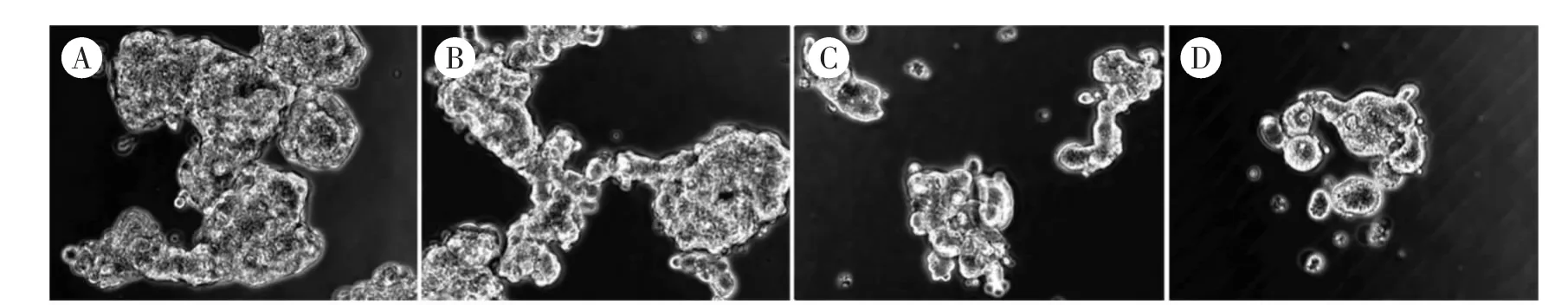
图1 半枝莲对大肠癌干细胞生长的影响(×100)
3.2 半枝莲对大肠癌干细胞增殖的影响 不同浓度的半枝莲处理大肠癌干细胞后,实验结果如图2所示,实验组与对照组(100%)比较,细胞存活率分别为75.92%、60.02%、41.1%。
3.3 半枝莲对大肠癌干细胞凋亡的影响 利用DAPI 染色检测细胞凋亡,结果如图3 所示,对照组细胞核荧光呈现弱染状态,随着半枝莲浓度的增加,出现核高染的细胞数增加,表明半枝莲干预可促进大肠癌干细胞凋亡的作用。 此外,我们进一步采用Annexin V-APC/PI 试剂盒检测半枝莲对大肠癌干细胞凋亡的影响。 结果见图4,随着半枝莲浓度的增加,凋亡的细胞数目逐渐增多。
3.4 半枝莲干预对大肠癌干细胞Bcl-2 和Bax mRNA表达的影响 经不同浓度半枝莲处理大肠癌干细胞24 h 后,如图5 所示,与对照组比较,Bcl-2/Bax mRNA 的比值随着半枝莲浓度的增加,显著下调。
3.5 半枝莲干预对大肠癌干细胞Bcl-2 和Bax 蛋白表达的影响 实验结果如图6 所示,与对照组比较,半枝莲干预后,Bcl-2 在蛋白水平的表达显著下调,但Bax 在蛋白水平表达没有明显的改变。 经过蛋白灰度值统计分析,与对照组比较,实验组的Bcl-2/Bax 比值随着半枝莲浓度的增加,显著的下调;提示,调控Bcl-2 及Bax 两者之间的平衡可能是半枝莲诱导大肠癌干细胞凋亡的重要机制。
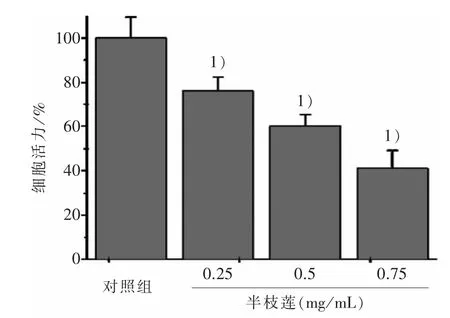
图2 4 组大肠癌干细胞活力比较
4 讨 论
肿瘤干细胞是肿瘤组织中存在的一小部分细胞,通常处于静息状态,当受到外界条件变化如细胞因子刺激时会导致肿瘤的发生、转移和复发,这均源于肿瘤干细胞拥有很强的自我更新、增殖分化和凋亡抵抗的潜能。 大肠癌发生、复发及转移的主要原因也是由于大肠癌干细胞的无限增殖分化和强大的抗凋亡特性所导致[3],故针对大肠癌干细胞治疗大肠癌已成为研究的热点。 临床常用放疗、化疗的方式治疗大肠癌,但给机体带来严重的副作用。中药治疗肿瘤具有安全、副作用小等优势,随着中药的更深层次研究,其作用机制也越清晰。 因此,进一步加强中药干预肿瘤干细胞的实验研究,研制出针对肿瘤干细胞的抗肿瘤药物,是今后科研工作的主要方向之一。
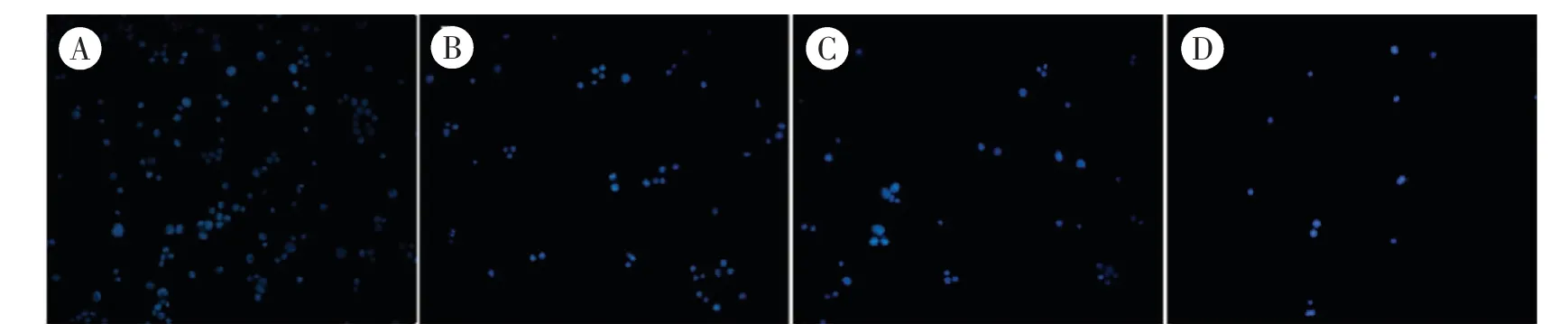
图3 DAPI 染色检测半枝莲对大肠癌干细胞凋亡的影响(×100)

图4 4 组大肠癌干细胞凋亡比例比较
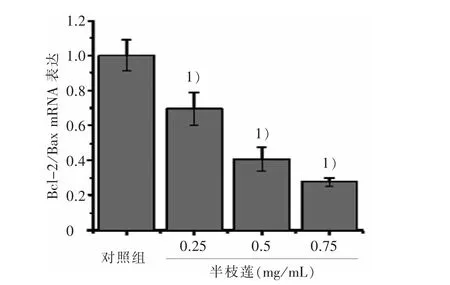
图5 4 组大肠癌干细胞Bcl-2/Bax mRNA 表达比较
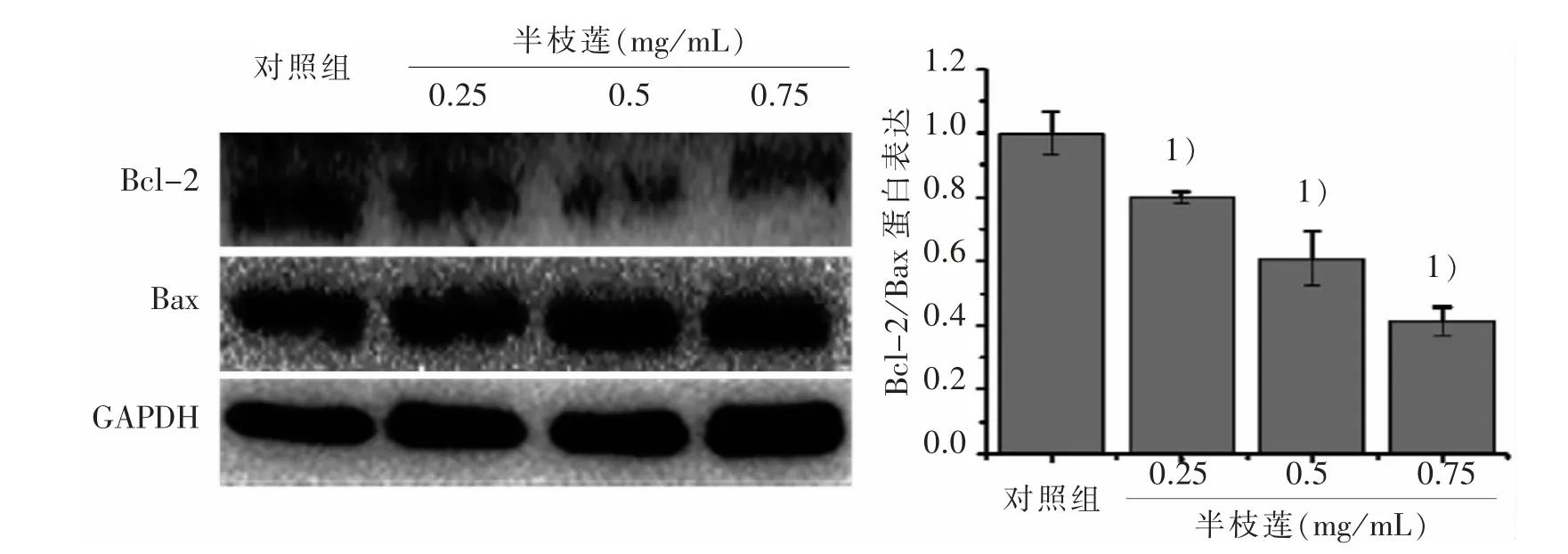
图6 4 组大肠癌干细胞Bcl-2 和Bax 蛋白表达比较
半枝莲是天然药用植物,现代多用于临床辅助治疗各种肿瘤性疾病[6-11],并且具有显著的疗效。基础研究也表明半枝莲具有抑制大肠癌细胞增殖及诱导凋亡的作用[12-14],本课题组前期研究表明半枝莲具有抑制大肠癌干细胞比例的作用[18],但具体的抑制作用机制尚未阐明清楚。 因此,本文以大肠癌干细胞为切入点,探讨半枝莲对大肠癌干细胞凋亡的影响及其作用机制。 实验采用倒置显微镜观察细胞的形态及密度,采用4%台盼蓝检测观察半枝莲对大肠癌干细胞生长的影响,结果均显示半枝莲可抑制大肠癌干细胞生长。 同时,利用DAPI 染色及Annexin V-APC 试剂盒检测半枝莲对大肠癌干细胞凋亡的影响,发现半枝莲干预大肠癌干细胞后,细胞凋亡率呈不同程度的增加,由此可知半枝莲能够诱导大肠癌干细胞的凋亡。
研究发现肿瘤干细胞凋亡与线粒体外膜通透性(MOMP)有关,MOMP 增大不仅促进肿瘤干细胞的凋亡, 还能通过阻断肿瘤干细胞信号通路如Wnt、Notch 等通路发挥抑制肿瘤干细胞增殖的作用[19-20]。研究报道,Bcl-2 蛋白家族在线粒体介导肿瘤干细胞凋亡发挥着重要的调节作用[21]。 Bcl-2 家族之间相互作用的异常调节会引起MOMP 的变化,诱导肿瘤干细胞凋亡[20]。 Bcl-2 家族由抗凋亡蛋白(Bcl-2等)、促凋亡蛋白(Bax、Bak 等)以及BH-3 结构域的促凋亡蛋白(Bad 等)组成[21-22]。 其中,Bcl-2 和Bax是最具代表性的抑制和促进凋亡的蛋白,Bcl-2 与Bax 可形成同源(Bax/Bax)或异源(Bcl-2/Bax)的二聚体,共同作用发挥着调节细胞凋亡的作用[23]。 当Bcl-2 高表达和Bax 的低表达, 导致二者的比值上调是细胞发生凋亡抵抗的重要因素。 因此,二者的比值决定了细胞的最终命运[24]。 实验结果显示,大肠癌干细胞用半枝莲处理24 h 后,Bcl-2/Bax 比率显著降低,提示半枝莲干预大肠癌干细胞24 h 后可改变Bcl-2、Bax 的mRNA 及蛋白的表达,通过影响两者之间的平衡,最终诱导细胞凋亡。

